
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Бақылау сұрақтары
Бақ ылау сұ рақ тары
1. Спектрлiк сапалық талдау негiзiне алынғ ан принциптер.
2. «Соң ғ ы» сызық тар деген қ андай сызық тар? Тексеру сызық тары ше?
3. Спектрлiк сапалық талдау (жартылай, не толық ) қ алай жү ргізiледi? Гартман диафрагмасы мен темiр спектрiнiң спектрограмманы талдау жү ргізгенде атқ аратын ролi.
4. Спектрдегi сызық тардың қ абаттасуын қ алай ескеруге болатынын тү сіндiрiп берiң iз.
5. Спектрлiк талдау қ ондырғ ысында электр доғ асы қ андай қ ызмет атқ арады (функциясы қ андай)?
6. Нелiктен ә рбiр химиялық элементтiң ерекше тек ө зiне тә н сызық тық спектрi болады? Осы спектр осы элементтiң кү рделі зат қ ұ рамына кiретiндiгiне немесе таза тү рде болғ андығ ына тә уелдi бола ма?
6. СУТЕГІ АТОМЫ СПЕКТРІН ЗЕРТТЕУ, РИДБЕРГ ТҰ РАҚ ТЫСЫН ЖӘ НЕ ЭЛЕКТРОН МАССАСЫН АНЫҚ ТАУ
6. 1. Жұ мыстың мақ саты мен мазмұ ны
Сутегi атомының спектрi жә не энергетикалық кү йлерi жү йесiмен танысу. Сутегi спектрiндегi сериялық заң дылық тарды зерттеу, Бальмер сериясы спектрлiк сызық тарының толқ ын ұ зындық тарын тә жiрибеде ө лшеу, Ридберг тұ рақ тысын жә не электрон массасын тә жiрибеде анық тау. Сутегi атомының энергетикалық диаграммасын тұ рғ ызу [1-10].
6. 2. Аппаратур а
МУМ-2 монохроматоры, сутегi толтырылғ ан газразрядтық тү тікше, қ оректендiру блогы.
6. 3. Қ ысқ аша теориялық мә лiметтер
6. 3. 1. Атомдық спектрлер. Сериялық заң дылық тар.
19-ғ. екiншi жартысында жү ргізiлген зерттеулер нә тижесiнде ә рбiр химиялық элементтiң атомдарының буы белгiлi бiр қ олайлы жағ дай жасалып қ оздырылғ анда сызық тық спектр деп аталатын жеке сызық тар жиынтығ ынан тұ ратын сызық тық спектр шығ аратындығ ы; жә не де ә рбiр химиялық элемент атомдарына тек осы элементке тә н нақ ты сызық тық спектр сә йкес келетiндiгi тағ айындалды. Сонымен, заттың сапалық жә не сандық қ ұ рамын оның сызық тық спектрiн зерттеу арқ ылы анық таудың физикалық тә сiлi-спектрлiк талдау негiздерi қ аланды (Киргхоф, Бунзен, 1859). Химиялық элементтердiң сызық тық спектрлерiн зерттеу нә тижелерiн талдаудан спектрлерде сызық тар ретсiз, қ алай болса солай емес, заң дылық пен орналасады деген қ орытынды жасалды. Ендi осы заң дылық тарды тағ айындау жә не бұ ларды тү сіндiру мiндетi алғ а қ ойылды.
Сутегiнiң сызық тық спектрiн егжей-тегжейлi зерттеп, швейцариялық мектеп мұ ғ алiмi И. Бальмер (1885) спектрде сол кезде белгiлi тоғ ыз сызық тың толқ ын ұ зындық тарын мына формула бойынша
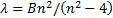 (6. 1)
(6. 1)
табуғ а болатындығ ын тапты; мұ ндағ ы В=364, 6 нм, ал n=3, 4, 5,... бү тін мә ндерiн қ абылдайды. (3. 1) формуланы Швед ғ алымы И. Ридберг (1890) басқ а тү рде жазуды ұ сынды:
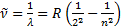 (6. 2)
(6. 2)
мұ ндағ ы 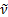 -спектрлiк сызық тың толқ ындық саны, см-1, l-толқ ын ұ зындығ ы, R-тұ рақ ты шама, Ридберг тұ рақ тысы деп аталады; n=3, 4, 5,... (6. 2) формула ө те жоғ ары дә лдiкпен тә жiрибеге сә йкес келетiн нә тижелер бередi.
-спектрлiк сызық тың толқ ындық саны, см-1, l-толқ ын ұ зындығ ы, R-тұ рақ ты шама, Ридберг тұ рақ тысы деп аталады; n=3, 4, 5,... (6. 2) формула ө те жоғ ары дә лдiкпен тә жiрибеге сә йкес келетiн нә тижелер бередi.
(6. 2) формула қ амтитын сутегi атомының спектрлiк сызық тар тобы Бальмер сериясы (6. 1 сур. ) деп аталады. Осы формулағ а қ арағ анда n-нiң мә нi ұ лғ айғ ан сайын кө ршiлес сызық тардың толқ ын ұ зындық айырмасы кеми бередi, спектрлiк сызық тар арасы жақ ындай тү седi. Ең соң ында, n=¥ болғ анда Бальмер сериясының шекарасы 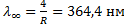 немесе
немесе 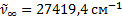 пайда болады.
пайда болады.

Сурет 6. 1. Бальмер сериясындағ ы сутегінің кө рінетін сә улелену сызық тары [33].
Сутегi атомы спектрiнде Бальмер сериясына жататын сызық тардан басқ а сызық тар да бар. Олар бiрнеше серия қ ұ райды (6. 2. сур. ).
Спектрдiң ультракү лгін бө лiгiндегi бiр топ сызық тар Лайман (1906) сериясы деп аталады:
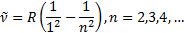
Сутегiспектрiнiң жақ ынинфрақ ызылбө лiгiндеПашен (1908) сериясыдепаталатынбiртопсызық бар. Бұ лармынаформуламенө рнектеледi:
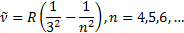
Бұ данбасқ аспектрдiң алысинфрақ ызылбө лiгiндеү шсериябар.
Олар:
Брэкетсериясы (1922): 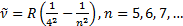
Пфунд сериясы (1924): 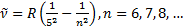
Хэмфри сериясы (1953): 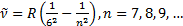
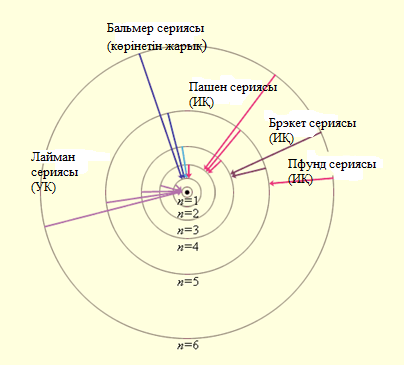
Сурет 6. 2. Сутегі атомының стационар орбиталары жә не спектрлік серияларының пайда болуы [34]
Осы сериялардың толқ ындық сандары (6. 2) Бальмер формуласына ұ қ сас, 22 орнына 12, 32, 42, 52, 62қ ойылғ ан формулалармен ө рнектеледi. Сонымен, сутегi атомының барлық спектрлiк сызық тарын мынадай жалпы формуламен ө рнектеуге болады:
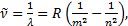 (6. 3)
(6. 3)
мұ ндағ ыmжә не n-бү тін сандар, жә не m< n; берiлген серия ү шінn= m+1, m+2,... болады. Лайман сериясы ү шінm=1, Бальмер сериясы ү шінm=2 жә не т. т.
(6. 3) ө рнектен сутегi спектрiндегi сызық тар шексiз кө п екенiн кө руге болады (n-нiң ү лкен мә ндерiне сә йкес келетiн серия шетiне таман сызық тар бiрiне-бiрiө те жиi орналасып, ажыратылуы қ иындай тү седi). Сонымен, сутегi спектрiнде байқ алатын сызық тар ө те кө п болғ анымен бұ лар ө те қ арапайым тә уелдiлiкпен бейнеленедi. Берiлген серияның барлық сызық тары iшiнен толқ ын ұ зындығ ы ең ү лкен спектрлiк сызық серияның бас сызығ ыдеп, ал n=¥ -ке сә йкес келетiн сызық ты – серияның қ ысқ а толқ ынды шекарасы деп аталады; бұ ғ ан ү здіксiз спектр жалғ асып жатады.
6. 3. 2. Спектрлiк терм. Комбинациялық принцип. Атомдардың сызық тық спектрлерiн зерттеу нә тижелерiне сү йенiп, Ридберг (1889) берiлген серияның барлық сызық тарының толқ ындық сандары (жиiлiктерi) мына қ атынасты
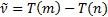 (6. 4)
(6. 4)
қ анағ аттандырады деген қ орытынды жасады; мұ ндағ ы m-тұ рақ ты, серияны анық тайтын тұ рақ ты мә нге ие сан, ал ncанының ө згерiсi(n=m+1, m 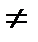 2,... ) берiлген серияның барлық сызық тарын бередi; Т(m), Т(n)-спектрлiк термдер. Сутегi атомының (6. 3) сериялық формуласымен салыстырудан спектрлiк термдердiң тиiсiнше мына қ атынастарғ а
2,... ) берiлген серияның барлық сызық тарын бередi; Т(m), Т(n)-спектрлiк термдер. Сутегi атомының (6. 3) сериялық формуласымен салыстырудан спектрлiк термдердiң тиiсiнше мына қ атынастарғ а
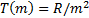 жә не
жә не 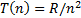 (6. 5)
(6. 5)
тең болатындығ ы келiп шығ ады.
1908 ж. Ритц тә жiрибелiк деректердi қ орыту нә тижесiнде комбинациялық принцип деп аталатын ереже ұ сынды. Осы ережеге сә йкес, кез-келген атомның шығ ару спектрiндегi барлық сызық тарды спектрлiк термдердiң (64) комбинациясы тү рінде ө рнектеуге болады.
6. 3. 3. Атомның планетарлық моделi. 1911 ж. Резерфорд атомның ядролық (планетарлық ) моделiн (ү лгiсiн) ұ сынды (6. 3. сур. ); бұ л атом қ ұ рылысы жө нiндегi қ азiргi кө рiнiстерге келудегi маң ызды қ адам болды. Осы модельге сә йкес Ze оң заряды бар ядроны дө ң гелек (немесе эллипстiк) орбита бойынша электрондар электростатикалық тартылыс кү шi ә серiнен айналып жү редi (гравитациялық тартылыс кү штерi ә серiнен планеталардың Кү ндi айналатындығ ына ұ қ сас). Ядро заряды электрондардың қ осынды зарядына тең, ө йткенi атомдар электрлiк бейтарап жү йе.
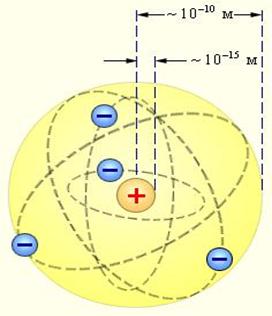
Сурет 6. 3. Атомның Резерфорд бойынша ядролық (планетарлық )моделі[33]
Резерфорд моделi, алайда, классикалық физика шең берiнде орнық сыз болады, яғ ни қ ирап қ алуғ а тиiс. Классикалық электродинамика заң дарына сә йкес ядроны айнала қ озғ алатын электрон электромагниттiк толқ ындарды ү здіксiз шығ аруғ а, сондық тан да ол ө з энергиясын жоғ алта беруге тиiс. Осының нә тижесiнде электрондар ядроғ а бiрте-бiрте спираль бойымен жақ ындап, соң ында ядроғ а қ ұ лайды. Осы қ орытындылар атомдардың бақ ыланатын орнық тылығ ынақ арама-қ айшы келедi (6. 4 - сур. ). Бұ ғ ан қ оса, атомдардың тә жiрибеде байқ алатын оптикалық спектрлерi (6. 3. 1; 6. 3. 2 қ араң ыз) ү здіксiз емес, жiң iшке спектрлiк сызық тардан тұ рады, яғ ни атомдар берiлген химиялық элементке тә н белгiлi жиiлiктегi электромагниттiк толқ ындарды (жарық ты) ғ ана шығ арады жә не жұ тады.
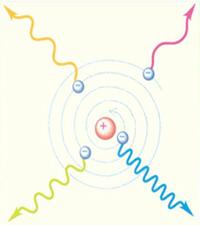
Сурет 6. 4. Резерфордтың атом моделінің орнық сыздығ ы [33]
6. 3. 4. Бор постулаттары. Атомның энергия дең гейлерiнiң диаграммасы. Аталғ ан қ арама-қ айшылық тарды шешу ү шін жаң а тү сінiктер қ ажет болды. Н. Бор (1913) алғ аш болып атомның планетарлық моделiн ендi ғ ана жаң адан пайда бола бастағ ан кванттық теориямен (Планк гипотезасы) байланыстыру керектiгiн алғ ашқ ы болып тү сіндi. Сонымен Бор атомның кванттық теориясын жасауғ а бiрiншi болып ұ мтылыс жасады. Бұ л теория ескiргенiне қ арамастан, жеткiлiктi қ арапайым, бiрталай қ ұ былыстарды кө рнекi тү сіндiруге мү мкіндiк бередi. Сондық тан да қ азiргi уақ ытта да мә селен, стационарлық кү йлер ұ ғ ымын енгiзгенде, қ олданылады.
Бор теориясының негiзiне екi постулат алынғ ан.
1-постулат(стационарлық кү йлер постулаты) (6. 5 - сур. ): атомды нақ ты дискреттiк энергия мә ндерiмен сипатталатын стационарлық уақ ытқ а байланысты ө згермейтiн кү йлер болады, бұ л кү йлерде ол энергия шығ армайды. Атомның стационарлық кү йлерiне стационарлық орбиталар сә йкес келедi; осы орбиталар бойынша электрондар қ озғ алады. Электрондар стационарлық орбиталар бойымен қ озғ алғ анда электромагниттiк толқ ындар шығ армайды.
Атомның стационарлық кү йiндегi дө ң гелек орбита бойынша қ озғ алатын электронның импульс моментi
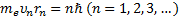 (6. 6)
(6. 6)
шартын қ анағ аттандыратын дискреттi квантталғ ан мә ндер қ абылдауы тиiс; мұ ндағ ы me-электрон массасы, un-радиусы rnn-i орбитадағ ы оның жылдамдығ ы; 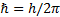 .
.
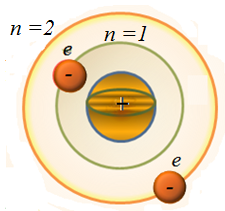
Сурет 6. 5. Бордың бірінші постулатының иллюстрациясы[33]
2-постулат(жиiлiктер ережесi)(6. 6-сур. ): атом бiр стационарлық кү йден басқ асына ауысқ ан жағ дайда энергиясы тиiстi стационарлық кү йлер энергияларының айырымына тең
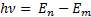 (6. 7)
(6. 7)
фотон шығ арылады (жұ тылады).
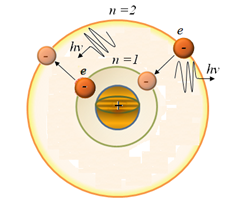
Сурет 6. 6. Бордың екінші постулатының иллюстрациясы[33]
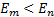 болғ ан жағ дайда фотон шығ арылады,
болғ ан жағ дайда фотон шығ арылады, 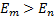 болғ анда фотон жұ тылады. Мү мкін болатын кванттық ауысуларғ а сә йкес келетiн дискреттiк
болғ анда фотон жұ тылады. Мү мкін болатын кванттық ауысуларғ а сә йкес келетiн дискреттiк
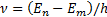
жиiлiктер жиыны атомның сызық тық спектрiн анық тайды.
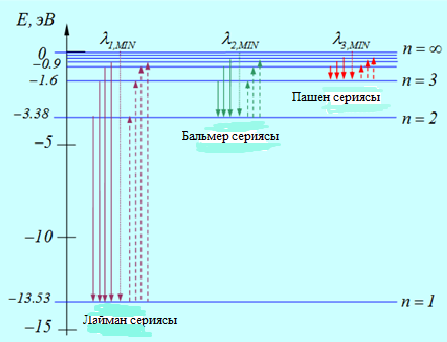
Сурет 6. 7. Бор теориясы бойынша сутегі атомының энергетикалық дең гейлері мен кө шулері: тұ тас сызық тар (жоғ арыдан тө мен) – сә уенің шығ арылуы, пунктир сызық тар (тө меннен жоғ ары) – жұ тылуы[33]
Бор постулаттары классикалық физика тү сінiктерiмен қ арама-қ айшы келедi. Бiрақ атом дү ниесiн бейнелеуде дә л тү сінiктерден бас тарту жә не Планк тұ рақ тысының енгiзiлуi революциялық физикалық идеялардың ұ сынылуына жә не қ азiргi кванттық теорияның жасалуына алып келдi.
Бiрiншi постулат орнық ты атомның болатындығ ын растайды. Ал екiншi постулат тiкелей комбинациялық принциппен байланысқ ан. Шынында да, (6. 7) формуладан (6. 4) формуланы пайдаланғ анда мына формула шығ ады
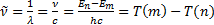 (6. 8)
(6. 8)
Осыдан n-кү йдегi атом энергиясы T(n) терммен мына қ атынаспен байланысқ андығ ы кө рiнедi
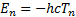 (6. 9)
(6. 9)
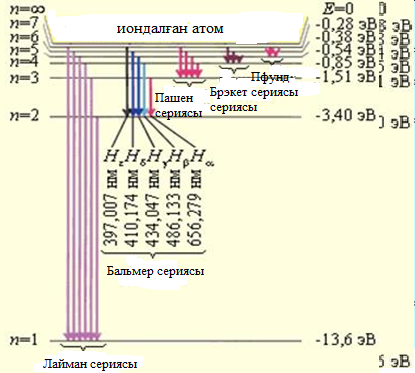
Сурет 6. 8. Сутегі атомның энергетикалық диаграммасы. Ә р тү рлі спектрлік серияғ а сә йкес келетін кө шулер кө рсетілген. Бальмер сериясының бірінші сызық тарының толқ ын ұ зындық тары кө рсетілген. [33]
Ең аз энергия Е1 сә йкес келетiн негiзгi кү йде атом мейлiнше ұ зақ тұ рады. Ал қ алғ ан барлық кү йлер қ оздырылғ ан болады. Атомды осындай кү йге ауыстыру процесi қ оздыру деп аталады. Қ озғ ан кү йде атом салыстырмалы қ ысқ а уақ ытқ а, ә детте t~10-8 с кiдiредi. Бiрақ бұ л уақ ыт атомдық масштабта ұ зақ уақ ытқ а саналады. ө йткенi жарық сә улесiнiң жиiлiгi ~1014 с-1, ал осы жарық t=10-8с уақ ыт iшiнде 106 тербелiс жасайды (6. 8 - сур. ).
Қ озғ ан кү йден атом негiзгi кү йге бiрден тiкелей ауысады, немесе бұ лардың араларындағ ы бiрнеше тө менiрек қ озғ ан кү йлер арқ ылы бiртiндеп ауысады. Ә рбiр байқ алатын спектрлiк сызық екi энергия дең гейлерi арасындағ ы ауысу нә тижесiнде пайда болады.
Атом энергиясының санақ басы ә детте оның байланысқ ан кү йлерiне сә йкес келетiн барлық Е1, Е2, Е3,... дискреттiк мә ндерi терiс таң балы (Е< 0) болатындай таң далып алынады. Оң мә ндер (Е> 0) жағ дайында атом кү йлерi байланыспағ ан – атомоң ионғ а жә не электронғ а ыдырайды. Электронды атомнан бө лiп алу процесi иондау деп аталады. Иондалғ ан кү йлерде ион жә не электронның қ озғ алыстары бiр-бiрiнен тә уелсiз болатындық тан бұ лардың қ осынды Еэнергиясы кез-келген мә н қ абылдай алады, яғ ни квантталмайды. Еiиондану энергиясы деп негiзгi кү йде тұ рғ ан атомғ а оны иондау ү шін берiлуге тиiс ең аз энергияны айтады. Диаграммадан иондану энергиясы атомның негiзгi кү йi энергиясының абсолюттiк шамасына тең болатындығ ы кө рiнедi: 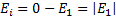
Иондану энергиясын ә детте эВ-пен ө рнектейдi. Бұ ғ ан осы жағ дайда иондану потенциалы терминi қ олданылады.
Ә р тү рлi стационарлық кү йлердегi атомның қ ұ рылымы да ә р тү рлi болады. Сонымен, атом бiр стационарлық кү йден екiншiсiне ауысқ анда оның қ ұ рылымы да ө згерiске ұ шырайды. Ең елеулi ө згерiс иондану кезiнде, атом электроннан айырылғ анда, болады.
Атом, hv энергиясыEiиондалу энергиясынан басым келетiн, яғ ни 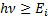 , фотонды жұ ту нә тижесiнде атомның иондануы мү мкін. Бұ л процесс фотоионданудеп аталады. Атомнан жұ лынып шығ арылғ ан электронның кинетикалық энергиясы
, фотонды жұ ту нә тижесiнде атомның иондануы мү мкін. Бұ л процесс фотоионданудеп аталады. Атомнан жұ лынып шығ арылғ ан электронның кинетикалық энергиясы 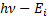 болады. Фотоиондануғ а керi процесс радиациялық рекомбинация деп аталады. Осы процесс нә тижесiнде ион мен электрон байланысып стационарлық кү йлердiң бiрiндегi атом пайда болады, ал босатылғ ан энергия бiр немесе бiрнеше фотон тү рінде шығ арылады.
болады. Фотоиондануғ а керi процесс радиациялық рекомбинация деп аталады. Осы процесс нә тижесiнде ион мен электрон байланысып стационарлық кү йлердiң бiрiндегi атом пайда болады, ал босатылғ ан энергия бiр немесе бiрнеше фотон тү рінде шығ арылады.
Атомды қ оздыру немесе иондауғ а қ ажеттi энергия, оны белгiлi жиiлiктегi жарық пен жарық тандырғ анда ғ ана емес, кинетикалық энергиясы қ айсыбiр табалдырық шамадан артық басқ а бө лшектермен серпiмсiз соқ тығ ысқ анда да атомғ а берiлуiмү мкін.
Мә селен газды қ ыздырғ анда ә рқ ашан атомдардың басқ а жеткiлiктi дә режедегi жылдам атомдармен (жә не де иондану нә тижесiнде газда пайда болатын электрондармен) серпiмсiз соқ тығ ысқ ан жағ дайда қ оздырылуы (иондануы) қ абат жү редi. Мұ ны температуралық қ оздыру (иондау) дейдi. Т температураны ө сiргенде қ оздырылғ ан кү йлердiң ә рқ айсысындағ ы атом саны тез артады. Энергиясы Еnқ оздырылғ ан кү йдiң қ оныстануы Больцман ү лестiрiлуiмен анық талады:
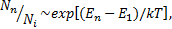
мұ ндағ ы Nn-қ оздырылғ ан кү йдегi атом саны; N1 негiзгiкү йдегi атом саны; k-Больцман тұ рақ тысы. Бө лмелiк температура жағ дайында 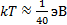 ал
ал 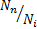 қ атынасы елеусiз аз болады.
қ атынасы елеусiз аз болады.
Сондық тан суық газ, егер оның атомдары басқ аша жолмен қ оздырылмағ ан болса, онда жарық шығ армайды. Суық газдың жұ тылу спектрiнде негiзгiкү йден ауысуларғ а сә йкес келетiн жиiлiктерi 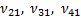 1, жә не т. б. сызық тардың ғ ана болатындығ ы
1, жә не т. б. сызық тардың ғ ана болатындығ ы 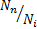 қ атынасының аздығ ымен тү сіндiрiледi.
қ атынасының аздығ ымен тү сіндiрiледi.
6. 3. 5. Сутегi атомының энергия дең гейлерi жә не спектрi. Еn энергия дең гейлерiнiң орналасу заң дылығ ы сутегi атомында ең қ арапайым.
Сутегi атомының термi (6. 5) формуласымен ө рнектеледi. Демек, энергия мә ндерiнiң дискреттi жиыны, яғ ни сутегi атомының энергетикалық спектрi мына формуламен анық талады:
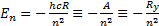 (6. 10)
(6. 10)
мұ ндағ ы, Ry=hcRэнергетикалық тұ рақ ты(Ридберг)Ry=13, 595 эВ;
1, 2, 3,... ¥ мә ндерiн қ абылдайтын n саны бас кванттық сан деп аталады. Ол сутегi атомының энергия дең гейлерiн анық тайды. Энергияның терiс таң балы болуы атомдағ ы электронның байланысқ ан кү йде тұ рғ андығ ын кө рсететiндiгi жайында айтылғ ан болатын.
Сутегi атомындағ ы электрон энергиясының ең аз мә нiне (байланыс энергиясының ең ү лкен шамасына) n=1 саны сә йкес келедi. n®¥ болғ анда энергия Еn®0 болады. Бұ л электронның шексiздiктегi тыныштық кү йiне сә йкес келедi. n саны ө скенде кө ршi энергия дең гейлерiнiң ара қ ашық тығ ы кемидi жә не нө лге асимптотикалық ұ мтылатын болады. Бұ л n кванттық санының мә ндерiү лкен болғ ан жағ дайда энергияның ү здіксiз дерлiк ө згеретiндiгiн, ал n кiшi болғ ан жағ дайда энергия мә ндерi секiрмелiтү рдеө згеретiндiгiн кө рсетедi.
6. 10) формула сутегi атомының энергия дең гейлерiн анық тайды. Осы формула бойынша 6. 8-суретте сутегi атомының энергия дең гейлерiнiң диаграммасы тұ рғ ызылғ ан. n=1 болатын кү й негiзгi, немесе қ алыпты кү й. Қ алғ ан кү йлер ( 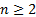 болатын жағ дайлар) атомның қ озғ ан кү йлерi.
болатын жағ дайлар) атомның қ озғ ан кү йлерi. 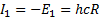 шамасы атомғ а оның электронын
шамасы атомғ а оның электронын  кү йге ауыстыру ү шін, яғ ни электронның атомнан жұ лынып шығ арылуы ү шін қ ажеттi ең аз энергия. Бұ л атомның ионданғ андығ ын кө рсетедi. Демек физикалық мағ ынасы бойынша R Ридберг тұ рақ тысы (Дж, эВ) сутегi атомының иондану энергиясын сипаттайды. I1 шамасы иондану потенциалы (В), немесе энергиясы (эВ) деп аталады. Қ айсыбiр n-iншiқ оздырылғ ан кү йде тұ рғ ан атомды да иондауғ а болады. Сонда оның иондану потенциалы
кү йге ауыстыру ү шін, яғ ни электронның атомнан жұ лынып шығ арылуы ү шін қ ажеттi ең аз энергия. Бұ л атомның ионданғ андығ ын кө рсетедi. Демек физикалық мағ ынасы бойынша R Ридберг тұ рақ тысы (Дж, эВ) сутегi атомының иондану энергиясын сипаттайды. I1 шамасы иондану потенциалы (В), немесе энергиясы (эВ) деп аталады. Қ айсыбiр n-iншiқ оздырылғ ан кү йде тұ рғ ан атомды да иондауғ а болады. Сонда оның иондану потенциалы 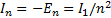 .
.
Сутегi атомы спектрлiк серияларының қ алай пайда болатындығ ын 6. 8-сурет кө мегiмен оң ай тү сінуге болады. Егер атом қ озғ ан E2кү йде тұ рғ ан болса, онда ол негiзгi кү йге энергиясы 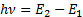 фотон шығ арып барып ауысады. Осы сә уленiң толқ ындық саны
фотон шығ арып барып ауысады. Осы сә уленiң толқ ындық саны 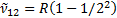 Лайман сериясының бас сызығ ына сә йкес келедi. Басқ а қ озғ ан энергия дең гейлерiнен негiзгi дең гейге ауысқ анда Лайман сериясының барлық сызық тары пайда болады. Сутегi атомы энергиялары Е3, Е4, Е5,... қ оздырылғ ан кү йлерден E2қ оздырылғ ан дең гейге ауысулар жасағ анда Бальмер сериясы пайда болады. Сутегi атомының басқ а сериялары да осығ ан ұ қ сас пайда болады. Сутегi атомы шығ аратын ең ұ зын толқ ынды (l»15, 7м) сә улесi галактика аралық газ тұ мандық тарды зерттеулер кезiнде тiркелген, ол n=701®m=700 кванттық ауысуына сә йкес келедi. Сутегi атомдарының жұ тылу спектрiнде тек бiр серия-Лайман сериясы болады. Сонымен Бор постулаттарын пайдаланғ анда сутегi атомы спектрiнiң қ алай пайда болатындығ ын тү сіндiру мү мкін болды. Бор жә не Ридберг тұ рақ тысын тiкелей есептеп шығ арды, бұ л оның теориясының ү лкен жең iсi болды.
Лайман сериясының бас сызығ ына сә йкес келедi. Басқ а қ озғ ан энергия дең гейлерiнен негiзгi дең гейге ауысқ анда Лайман сериясының барлық сызық тары пайда болады. Сутегi атомы энергиялары Е3, Е4, Е5,... қ оздырылғ ан кү йлерден E2қ оздырылғ ан дең гейге ауысулар жасағ анда Бальмер сериясы пайда болады. Сутегi атомының басқ а сериялары да осығ ан ұ қ сас пайда болады. Сутегi атомы шығ аратын ең ұ зын толқ ынды (l»15, 7м) сә улесi галактика аралық газ тұ мандық тарды зерттеулер кезiнде тiркелген, ол n=701®m=700 кванттық ауысуына сә йкес келедi. Сутегi атомдарының жұ тылу спектрiнде тек бiр серия-Лайман сериясы болады. Сонымен Бор постулаттарын пайдаланғ анда сутегi атомы спектрiнiң қ алай пайда болатындығ ын тү сіндiру мү мкін болды. Бор жә не Ридберг тұ рақ тысын тiкелей есептеп шығ арды, бұ л оның теориясының ү лкен жең iсi болды.
6. 3. 6. Сутегi атомын модельдiк (Бор моделi тұ рғ ысынан) қ арастыру. Сутегi атомы ү шін (жә не сутегi тә рiздi ион) (6. 10) энергияның квантталу ережесiн қ арапайым модельдiк кө рiнiстердi пайдаланып табуғ а болады.
Сутегi атомындағ ы электронның қ озғ алысын қ арастырайық; оң айлық ү шін дө ң гелек стационарлық орбиталармен шектелейiк. Кулондық кү шә серiнен шең бер бойымен қ озғ алатын электрон ү шін Ньютонның 2-заң ы негiзiнде мына тең дiктi жазамыз
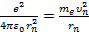 (6. 11)
(6. 11)
мұ ндағ ы meжә не un-радиусы rn орбитадағ ы электронның массасы мен жылдамдығ ы, e0 -электрлiк тұ рақ ты. Осы тең дiкке (6. 6) квантталу шартынан un жылдамдық ты қ ойып, тең дiктi rn-ге қ атысты шешемiз; сонда n-i стационарлық орбита радиусы ү шін ө рнек алынады:
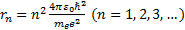 (6. 12)
(6. 12)
(6. 12) ө рнегi сутегi атомының Бор ұ сынғ ан моделiндегi рұ қ сат етiлген орбиталар радиустарын анық тайды. Ядроғ а ең жақ ын орбитағ а n=1 сә йкес келедi;
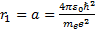 (6. 13)
(6. 13)
Бұ л тұ рақ ты шама Бор радиусы деп аталады жә не ол сутегi атомының ең кiшi орбитасының мө лшерiн анық тайды. (6. 12) ө рнегiнен 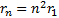 , болатындығ ы келiп шығ ады, яғ ни стационарлық кү йлер ү шін орбиталар радиустары квантталғ ан
, болатындығ ы келiп шығ ады, яғ ни стационарлық кү йлер ү шін орбиталар радиустары квантталғ ан 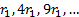 мә ндерге тең болады. Осы радиустардың ә рқ айсысы кванттық сан деп аталатын n бү тін санның квадратына пропорционал.
мә ндерге тең болады. Осы радиустардың ә рқ айсысы кванттық сан деп аталатын n бү тін санның квадратына пропорционал.
Сутегi атомындағ ы электронның толық энергиясы оның кинетикалық энергиясы 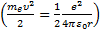 мен ядроның электростатикалық ө рiсiндегi потенциалдық энергиясының
мен ядроның электростатикалық ө рiсiндегi потенциалдық энергиясының 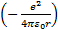 қ осындысына тең:
қ осындысына тең:
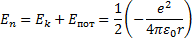
Стационарлық орбиталар радиустары ү шін (6. 12) квантталғ ан мә ндерiн ескергенде
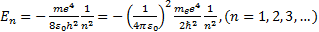 (6. 14)
(6. 14)
мұ ндағ ы минус таң басы электрон байланысқ ан кү йде тұ рғ андығ ын бiлдiредi. (6. 14) ө рнектен сутегi атомындағ ы электрон энергиясы тек дискреттi мә ндер қ абылдайтындығ ы, яғ ни атом энергиясының квантталғ андығ ы келiп шығ ады. (6. 14) формула Бальмердiң формуласын Бордың жиiлiктер ережесiмен салыстырудан алынғ ан (6. 10) ө рнекпен дә л келедi. Осы жағ дайда R¥ Ридберг тұ рақ тысы бұ ғ ан қ оса Ry энергетикалық тұ рақ ты iргелi тұ рақ тылар арқ ылы былай ө рнектеледi:
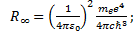 (6. 15)
(6. 15)
R¥ теориялық мә нiнің R тә жiрибелiк мә ндерiнен аздағ ан айырмашылығ ы бар. Айырмашылық тың болу себебi (6. 15) формуланы қ орытқ ан кезде атом ядросы қ озғ алмайды, яғ ни электрон массасына салыстырғ анда шексiз ауыр деп саналды. Бұ л «¥ » белгiсiмен белгiленген. Шындығ ында ядро массасы шектеулi, осыдан электрон да, ядро да атомның ауырлық центрiн айнала қ озғ алады. Сондық тан ядро қ озғ алысын ескеру ү шін me электрон массасын 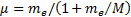 келтiрiлген массағ а ауыстыру керек, мұ ндағ ы М-ядро массасы. Демек, Ридберг тұ рақ тысы жә не энергетикалық тұ рақ ты ядро массасына тә уелдi болуғ а тиiс. Сонымен, ядро массасының шектеулiлiгiн есепке алғ анда, Ридберг тұ рақ тысы жә не энергетикалық тұ рақ ты Ryмә нi мына формулалармен анық талулары тиiс
келтiрiлген массағ а ауыстыру керек, мұ ндағ ы М-ядро массасы. Демек, Ридберг тұ рақ тысы жә не энергетикалық тұ рақ ты ядро массасына тә уелдi болуғ а тиiс. Сонымен, ядро массасының шектеулiлiгiн есепке алғ анда, Ридберг тұ рақ тысы жә не энергетикалық тұ рақ ты Ryмә нi мына формулалармен анық талулары тиiс
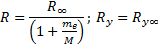
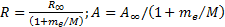 (6. 16)
(6. 16)
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|