
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
7. СІЛТІЛІК МЕТАЛДАР СПЕКТРЛЕРІНДЕГІ СЕРИЯЛЫҚ ЗАҢДЫЛЫҚТАРДЫ ЗЕРТТЕУ
7. СІЛТІЛІК МЕТАЛДАР СПЕКТРЛЕРІНДЕГІ СЕРИЯЛЫҚ ЗАҢ ДЫЛЫҚ ТАРДЫ ЗЕРТТЕУ
7. 1. Жұ мыстың мақ саты мен мазмұ ны
Кү рделi атомдар спектрлерiн жү йелеудiң жалпы принциптерiн игеру. Li, Na, K атомдарының шығ ару спектрлерiндегi сызық тардың толқ ын ұ зындық тарын анық тау. Бұ ларды атомның энергетикалық диаграммасындағ ы белгiлi термдер арасындағ ы кванттық ауысулармен сә йкестендiру, сызық тарды сериялар бойынша топтастыру. Сiлтiлiк элементтер атомдарының энергия дең гейлерiн, иондану энергиясын, кванттық ақ ауды жә не атомдардың тиiмдi зарядын анық тау[1-10, 19-23].
7. 2. Жұ мыс орындалатын тә жiрибелiк қ ондырғ ы
Li, Na, K атомдар спектрлерiн алу ү шін жарық кө зi ретiнде ИВС-28 генераторынан жандырылатын доғ алық разряд қ олданылады. Спектрлердi талдау, спектрлiк сызық тардың толқ ын ұ зындық тарын анық тау жә не бұ ларды тең дестiру ДСП-1 немесе ПС-18 спектропроекторында спектрлiк сызық тар атласы кө мегiмен жү ргiзiледi.
7. 3. Теориялық кiрiспе
7. 3. 1. Сiлтiлiк элемент атомының қ ұ рылымы. Барлық кү рделi атомдар iшiнен сiлтiлiк элементтер (Li, Na, K, Rb, Cs) атомдарының сыртқ ы электрондық қ абық шасы ең қ арапайым-ол тек жалғ ыз электроннан тұ рады (7. 1, 7. 1а – сур. ).
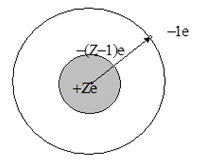
Сурет 7. 1 Сілтілік металлдың қ ұ рылысы[38]
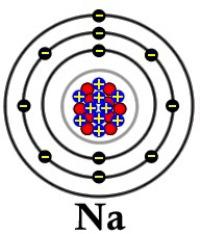
Сурет 7. 1 a. Сілтілік металлдың қ ұ рылысы(натрий)[39]
Атомның қ алғ ан 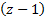 электроны ядромен бiрiгiп жеткiлiктi орнық ты атомдық қ алдық қ ұ райды. Осы атомдық қ алдық қ ұ рылымы элементтердiң периодтық жү йесiндегi бұ лардың (Li, Na, K... ) ә рқ айсысының алдында тұ рғ ан инерттi газ (He, Ne, Ar,... ) атомынiкi қ андай болса, дә л сондай болады. Осы жағ дай сiлтiлiк металл атомын сутегi атомына ұ қ сас етедi жә не атомдық қ алдық зарядының шамасы +1e-ге жуық
электроны ядромен бiрiгiп жеткiлiктi орнық ты атомдық қ алдық қ ұ райды. Осы атомдық қ алдық қ ұ рылымы элементтердiң периодтық жү йесiндегi бұ лардың (Li, Na, K... ) ә рқ айсысының алдында тұ рғ ан инерттi газ (He, Ne, Ar,... ) атомынiкi қ андай болса, дә л сондай болады. Осы жағ дай сiлтiлiк металл атомын сутегi атомына ұ қ сас етедi жә не атомдық қ алдық зарядының шамасы +1e-ге жуық 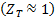 болатын тиiмдi ядро ролiн атқ арады. Ал сiлтiлiк элемент атомының сутегi атомынан айырмашылығ ы – сыртқ ы(валенттiк) электронның атомдық қ алдық iшiне бiраз ене алатындығ ымен байланысты. Жалпы кванттық заң дарғ а сә йкес атомдағ ы электрон қ атаң бiр орынғ а шоғ ырланғ ан емес, оның орнын дә л кө рсетуге болмайды, негiзiнде оның координатын дә л кө рсетуге болмайды, атом iшiндегi кең iстiктiң белгiлi бiр бө лiгiнде болу ық тималдығ ын есептеуге немесе басқ аша айтқ анда, электрондық ық тималдық бұ лт тығ ыздығ ын есептеуге болады. Кейбiр кү йлерде сыртқ ы электронның ық тималдық бұ лты атом қ алдығ ы iшiне енiп кетедi, бұ л жағ дайда электронның ә серлесетiн
болатын тиiмдi ядро ролiн атқ арады. Ал сiлтiлiк элемент атомының сутегi атомынан айырмашылығ ы – сыртқ ы(валенттiк) электронның атомдық қ алдық iшiне бiраз ене алатындығ ымен байланысты. Жалпы кванттық заң дарғ а сә йкес атомдағ ы электрон қ атаң бiр орынғ а шоғ ырланғ ан емес, оның орнын дә л кө рсетуге болмайды, негiзiнде оның координатын дә л кө рсетуге болмайды, атом iшiндегi кең iстiктiң белгiлi бiр бө лiгiнде болу ық тималдығ ын есептеуге немесе басқ аша айтқ анда, электрондық ық тималдық бұ лт тығ ыздығ ын есептеуге болады. Кейбiр кү йлерде сыртқ ы электронның ық тималдық бұ лты атом қ алдығ ы iшiне енiп кетедi, бұ л жағ дайда электронның ә серлесетiн 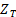 тиiмдi ядро заряды ө сетiн болады.
тиiмдi ядро заряды ө сетiн болады.
Мұ ндағ ы маң ызды жағ дай-сыртқ ы электрон қ озғ алатын тиiмдi ө рiстiң орталық симметриялы болатындығ ы. Осы себептi электронның Uпотенциалдық энергиясы атомдық қ алдық центрiнен электронғ а дейiнгi rқ ашық тық қ а ғ ана тә уелдi болады: 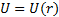 . Ү лкен қ ашық тық тарда қ алдық тағ ы электрондар ядроны экрандайды:
. Ү лкен қ ашық тық тарда қ алдық тағ ы электрондар ядроны экрандайды: 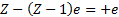 .
.
Осының салдарынан тиiмдi ө рiс 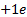 нү ктелiк зарядтың кулондық ө рiсiмен дә л келедi, ал
нү ктелiк зарядтың кулондық ө рiсiмен дә л келедi, ал 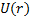 потенциалы сутегi атомынiкi сияқ ты болады:
потенциалы сутегi атомынiкi сияқ ты болады:
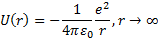
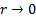 болатынядроғ ажақ ынмаң айдаэкрандауболмайдыдаэлектронядроментiкелейә серлеседi.
болатынядроғ ажақ ынмаң айдаэкрандауболмайдыдаэлектронядроментiкелейә серлеседi.
Осыжағ дайдағ ыэлектронның атомдық қ алдық пенә серлесуiнiң потенциалдық энергиясыбылайанық талады:
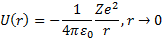
Алr-дiң бү кiл ө згеру аймағ ы ү шін
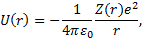
мұ ндағ ы 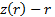 ө скенде шамасы Z -тен 1-ге дейiн баяу кемитiн қ айсыбiр функция. Сiрә
ө скенде шамасы Z -тен 1-ге дейiн баяу кемитiн қ айсыбiр функция. Сiрә 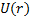 тә уелдiлiгiнiң қ исығ ы сутегi потенциалы ү шін
тә уелдiлiгiнiң қ исығ ы сутегi потенциалы ү шін 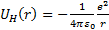
 тә уелдiлiгi қ исығ ынан тө мен жатады (7. 2-сурет).
тә уелдiлiгi қ исығ ынан тө мен жатады (7. 2-сурет).
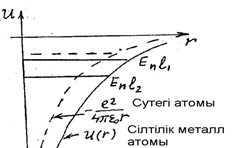
Сурет 7. 2U(r) тә уелділік қ исығ ы
Сiлтiлiк металдар атомдары мен сутегi атомының қ ұ рылысындағ ы ұ қ састық қ а байланысты бұ лардың энергия дең гейлерiнiң орналасуында да, спектрлерiнде де ұ қ састық болады екен. Демек, сiлтiлiк элементтер атомдарының қ асиеттерiн егжей-тегжейлi қ арастыруғ а кiрiспес бұ рын, сутегi атомын кванттық бейнелеуге тоқ талғ ан жө н.
7. 3. 2. Сутегi атомын кванттық бейнелеу. Сутегi атомы ү шін Шредингер тең деуiн
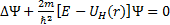 (7. 1)
(7. 1)
шешу мына нә тижелерге келтiредi. Бә рiнен бұ рын сутегi атомының байланысқ ан кү йлерi (E< 0) En белгiлi энергия мә ндерiмен дискреттi жиынтығ ын тү зедi:
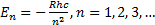 (7. 2)
(7. 2)
мұ ндағ ы 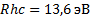 -сутегi атомын негiзгi кү йден иондау энергиясы; R=109678 см-1-Ридберг тұ рақ тысы; n-бас кванттық сан, бiрден бастап барлық бү тін мә ндер қ абылдай алады. En энергия дең гейлерi азғ ындалғ ан, яғ ни ә рбiр дең гейге (демек, ә рбiр n-бас кванттық санына) электрондық бұ лт пiшiнi жә не электронның
-сутегi атомын негiзгi кү йден иондау энергиясы; R=109678 см-1-Ридберг тұ рақ тысы; n-бас кванттық сан, бiрден бастап барлық бү тін мә ндер қ абылдай алады. En энергия дең гейлерi азғ ындалғ ан, яғ ни ә рбiр дең гейге (демек, ә рбiр n-бас кванттық санына) электрондық бұ лт пiшiнi жә не электронның 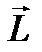 орбиталық импульс моментi ө згеше болатын бiрнеше кү й сә йкес келедi.
орбиталық импульс моментi ө згеше болатын бiрнеше кү й сә йкес келедi.
Орбиталық момент мына заң бойынша квантталады:
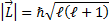
мұ ндағ ы  ℓ -орбиталық кванттық сан:
ℓ -орбиталық кванттық сан:  ℓ =0, 1, 2,..., n-1.
ℓ =0, 1, 2,..., n-1.
ℓ -мә ндерi ә ртү рлікү йлерді латын ә рiптерiмен белгiлейдi:
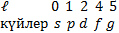
жә неосығ ансә йкес 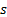 -кү йлер,
-кү йлер, 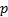 -кү йлер,
-кү йлер, 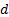 -кү йлержә нет. т. депаталады.
-кү йлержә нет. т. депаталады.
ℓ ә ртү рлікү йлердегiэлектрондық бұ лттардың пiшiнi жайындажалпыкө рiнiстi 7. 3-суреттенкө ругеболады.
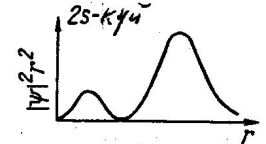
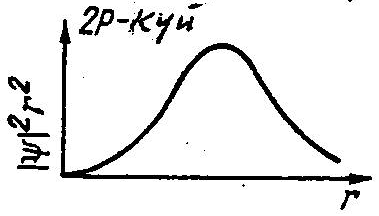
Сурет 7. 3 Электрондық бұ лт
Суретте 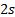 ,
, 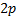 –кү йлерi ү шін
–кү йлерi ү шін  жә не
жә не 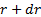 радиустары арасындағ ы шарлық қ абаттан электронның табылу ық тималдығ ы тығ ыздығ ын сипаттайтын
радиустары арасындағ ы шарлық қ абаттан электронның табылу ық тималдығ ы тығ ыздығ ын сипаттайтын 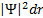 шамаларының графиктерi кескiнделген. Жалпы заң дылық мынадай: электрондық бұ лт мө лшерi
шамаларының графиктерi кескiнделген. Жалпы заң дылық мынадай: электрондық бұ лт мө лшерi 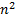 -қ а тура пропорционал ө седi жә не ℓ кванттық саны ө скенде атомның шеткi жағ ына қ арай қ айта ү лестiрiлiнедi.
-қ а тура пропорционал ө седi жә не ℓ кванттық саны ө скенде атомның шеткi жағ ына қ арай қ айта ү лестiрiлiнедi.
Сутегi атомындағ ы энергияның ℓ бойынша азғ ындалуы кездейсоқ жағ дай болып табылады жә не ол потенциалдың 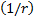 функция (кулондық ) ретiнде тө мендеуiмен байланысты.
функция (кулондық ) ретiнде тө мендеуiмен байланысты.
7. 3. 3. Сiлтiлiк элемент атомдарының энергия дең гейлерi. Сiлтiлiк металлатомының стационарлық кү йлерi энергияларын (7. 1) Шредингертең деуi кө мегiментабуғ аболады. Бiрақ мұ ндапотенциалдық энергиясутегi атомындағ ыдайемесбасқ ашаболады. Егерсiлтiлiкметаллатомындабарлығ ы 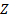 электронболсаоның
электронболсаоның 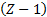 электроныядроменбiрiгiпедә уiрорнық тытұ лғ а (атомдық қ алдық ) қ ұ раптұ рады; алоның электрө рiсiндеатомдық қ алдық пенжеткiлiктi ә лсiзбайланысқ ансыртқ ы (валенттiк) электронқ озғ аладыдепсанауғ аболатындығ ыжоғ арыдаайтылғ анболатын. Кейбiрмағ ынадасiлтiлiкметаллатомдарысутегi тә рiздi болғ аныменбiрақ толық дә лсондайемес. Мә селе, сыртқ ыэлектронның электрондық тұ лғ аныбiршамадеформациялап, осыданө зi қ озғ алатынө рiстi бұ рмалап, ө згертеалатындығ ындаболыптұ р. Бiрiншi жуық таудаатомдық қ алдық (тұ лғ а) ө рiсiноның центрiндеорналасқ ан+енү ктелiкзарядө рiсi меннү ктелiкдипольө рiсiнiң суперпозициясыретiндеқ арастыруғ аболады. Осыжағ дайдадипольосi ә рқ ашандасыртқ ыэлектронғ абағ ытталғ анболады. Сондық тансыртқ ыэлектронтұ лғ аө рiсiнiң бұ рмалаң дығ ынақ арамастансфералық -симметриялығ ысақ талатынө рiстеқ озғ алатынболады. Сондаваленттiкэлектронқ озғ алатынполяризацияланғ анатомдық қ алдық тың ө рiсiннү ктелiкзарядө рiсiнедипольө рiсi қ абаттасқ анө рiсдепесептеп, потенциалдық энергияныжуық тү рдебылайө рнектеугеболады
электроныядроменбiрiгiпедә уiрорнық тытұ лғ а (атомдық қ алдық ) қ ұ раптұ рады; алоның электрө рiсiндеатомдық қ алдық пенжеткiлiктi ә лсiзбайланысқ ансыртқ ы (валенттiк) электронқ озғ аладыдепсанауғ аболатындығ ыжоғ арыдаайтылғ анболатын. Кейбiрмағ ынадасiлтiлiкметаллатомдарысутегi тә рiздi болғ аныменбiрақ толық дә лсондайемес. Мә селе, сыртқ ыэлектронның электрондық тұ лғ аныбiршамадеформациялап, осыданө зi қ озғ алатынө рiстi бұ рмалап, ө згертеалатындығ ындаболыптұ р. Бiрiншi жуық таудаатомдық қ алдық (тұ лғ а) ө рiсiноның центрiндеорналасқ ан+енү ктелiкзарядө рiсi меннү ктелiкдипольө рiсiнiң суперпозициясыретiндеқ арастыруғ аболады. Осыжағ дайдадипольосi ә рқ ашандасыртқ ыэлектронғ абағ ытталғ анболады. Сондық тансыртқ ыэлектронтұ лғ аө рiсiнiң бұ рмалаң дығ ынақ арамастансфералық -симметриялығ ысақ талатынө рiстеқ озғ алатынболады. Сондаваленттiкэлектронқ озғ алатынполяризацияланғ анатомдық қ алдық тың ө рiсiннү ктелiкзарядө рiсiнедипольө рiсi қ абаттасқ анө рiсдепесептеп, потенциалдық энергияныжуық тү рдебылайө рнектеугеболады
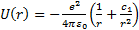 , (7. 3)
, (7. 3)
мұ ндағ ы 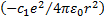 - сiлтiлiкметаллатомдарыө рiсiнiң сутегi атомыө рiсiненайырмашылығ ыескерiлетiнтү зету. Атомдық қ алдық тың электрө рiсi сфералық – симметриялы, яғ нибұ рыштарғ а
- сiлтiлiкметаллатомдарыө рiсiнiң сутегi атомыө рiсiненайырмашылығ ыескерiлетiнтү зету. Атомдық қ алдық тың электрө рiсi сфералық – симметриялы, яғ нибұ рыштарғ а 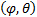 тә уелсiздепсанауғ аболады. Сондасiлтiлiкметаллатомыү шінШредингертең деуiнiң бұ рыштық бө лiгi сутегi атомындағ ыдайболады.
тә уелсiздепсанауғ аболады. Сондасiлтiлiкметаллатомыү шінШредингертең деуiнiң бұ рыштық бө лiгi сутегi атомындағ ыдайболады.
R(r)радиалдық толқ ындық функцияү шінШредингертең деуi былайшаө згередi:
сутегi ү шінтең деудегi 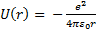 орнына (7. 3) ө рнегiнқ оюкерекболады.
орнына (7. 3) ө рнегiнқ оюкерекболады.
Сутегiатомыү шінШредингертең деуi (толқ ындық функцияның R(r)радиалдық бө лiгi ү шін) мынатү рдежазылады [6]:
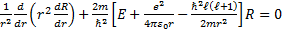 (7. 4)
(7. 4)
Осытең деудiсiлтiлiкметаллатомыү шінжазатынболсақ, онда (7. 4) тең деудегi жақ ша iшiндегi екi ө рнекорнынамынаө рнектi алукерекболады:
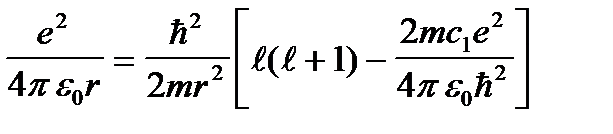 (7. 5а)
(7. 5а)
егер
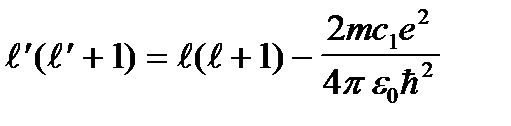 (7. 5б)
(7. 5б)
белгiлеуiн енгiзсек, онда (7. 4) тең деуi орнына соғ ан ұ қ сас тең деу алынады:
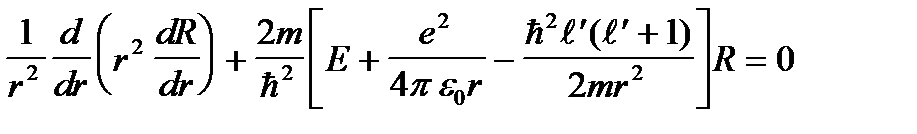 (7. 6)
(7. 6)
Сутегi атомы ү шін (7. 4) тең деуiнiң шешiмi белгiлi. Ендi (7. 6) тең деуiнiң де шешiмi сутегi есебiнiкi сияқ ты болады, тек мұ нда l орнына l¢ -пен алмастырылғ ан. Сонымен, сiлтiлiк металл атомының Е энергиясы ү шін сутегi есебiндегiдей, бiрақ l кванттық саны l¢ санына алмастырылғ ан ө рнек алынады
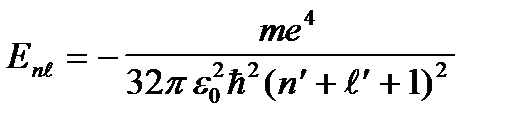 (7. 7)
(7. 7)
Сiлтiлiк металдар атомдарының энергия дең гейлерi (7. 7) формуласының сутегi атомы ү шін
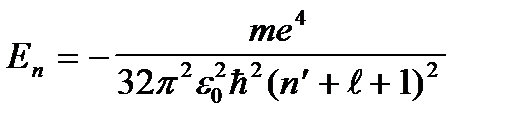
формуладан ө згешелiгi, (n=n¢ +l+1) бас кванттық сан орнына (n*=n¢ +l+1) саны (тиiмдi кванттық сан) тұ р. n* саны ендi бү тін сан емес, ө йткенi (7. 5б) тең дiгiмен анық талатын l¢ саны бү тін сан болмайды:
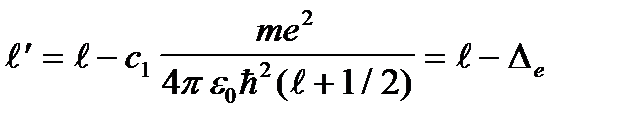 (7. 8)
(7. 8)
мұ ндағ ы Dl тү зету шамасы кванттық ақ ау деп аталады. (7. 8) бойынша l¢ мә нiн пайдаланғ анда n* тиiмдi кванттық саны былай ө рнектеледi:
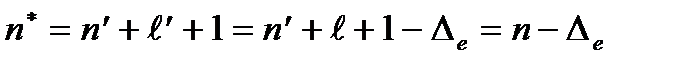 (7. 9)
(7. 9)
Ендi (7. 7) формуласына n* мә нiн жә не R Ридберг тұ рақ тысын енгiземiз, сонда
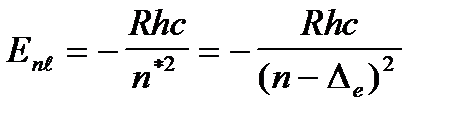 (7. 7а)
(7. 7а)
Бұ лформуласутегiатомыү шін (7. 2) формулағ аұ қ сас.
Атомдық қ алдық тың валенттiкэлектронғ аұ йытқ ытушыә серiнDlкванттық ақ ау кө мегiмен ескеру орнына, оны а экрандау тү зетуi арқ ылы да ескеруге болады. Сонда (7. 7а) ө рнектi мына тү рде жазуғ а болады
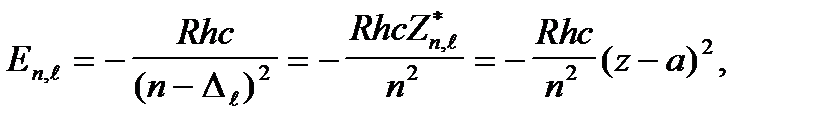 (7. 7б)
(7. 7б)
мұ ндағ ы
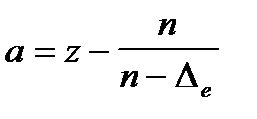 (7. 7в)
(7. 7в)
экрандау тұ рақ тысы, z*nl-«тиiмдi ядро» заряды.
Сонымен Еnl энергия дең гейлерin бас кванттық санына ғ ана емес, l орбиталық кванттық санғ а да тә уелдi болып шық ты. Dl кванттық ақ ау шамасы l-ге тә уелдi болатындық тан, n санының мә нi бiрдей, бiрақ l сандары ә р тү рлі дең гейлер сутегi атомында беттесiп жататын (азғ ындалғ ан) болса, сiлтiлiк металдар атомдарында бұ лар бiрiнен-бiрi ажырамайды. Бұ л n санының бiр мә нi жағ дайында энергия дең гейлерi l санының ә р тү рлі мә ндерi ү шінә р тү рлі болатынын бiлдiредi. Осы жағ дайда орбиталық кванттық сан бойынша азғ ындалу жойылды дейдi. l орбиталық кванттық сан мә нi ө скенде Dlтү зетуiнiң ролi ә лсiрейдi (7. 1-кесте). Сондық тан сiлтiлiк элемент атомы энергиясының lсанының тә уелдiлiгi оның ү лкен мә ндерi жағ дайында iс жү зінде бiлiнбейдi. Сiлтiлiк металдар атомдары ү шін спектрлiк термдер
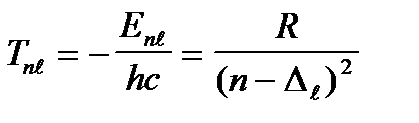 (7. 10)
(7. 10)
формуласымен анық талады. Осындай формуланы Ридберг 19ғ. тә жiрибе нә тижелерiн қ орыту нә тижесiнде тапқ ан болатын.
7. 1-кесте
Li, Na, K, Rb, Csү шін Dl кванттық ақ ау мә ндерi
| z, элемент | D0 º Ds | D1 º Dp | D2 º Dd | D3 º Df |
| 3 Li | 0, 412 | 0, 041 | 0, 002 | 0, 000 |
| 11 Na | 1, 373 | 0, 883 | 0, 010 | 0, 001 |
| 19 K | 2, 230 | 1, 776 | 0, 146 | 0, 007 |
| 37 Rb | 3, 1ұ 5 | 2, 711 | 1, 233 | 0, 012 |
| 55 Cs | 4, 131 | 3, 649 | 2, 448 | 0, 022 |
7. 4-суретте сiлтiлiк металдың бiрi-литийдiң термдерi мен сутегi термдерi арасындағ ы жоғ арыда айтылғ ан қ атынас бейнеленген. Энергия дең гейлерi орын аз алу ү шін дө ң гелек ноқ ат тү рінде кескiнделген. Сутегiде 2s жә не2p; 3s, 3pжә не3d; 4s, 4pжә не4dдең гейлерiө зарадә лкеледi, аллитийдеболса2sпен2pдең гейлерiбiр-бiрiненкү штiалшақ орналасқ ан; 3s, 3pжә не3dдең гейлерiнiң алшақ тауыаздаужә несутегiдең гейлерiнежақ ынорналасады (ә сiресе3pжә не3d); ең соң ында4pжә не4dдең гейлерiө зарабiрiмен-бiрiжә несутегiдең гейлерiмендә лкеледiдеугеболады.
7. 3. 4. Сiлтiлiк металдар спектрлерi. Сiлтiлiк металл атомдарының шығ ару спектрлерi, сутегi атомының спектрi сияқ ты, кө птеген спектрлiк сызық тардан тұ рады.
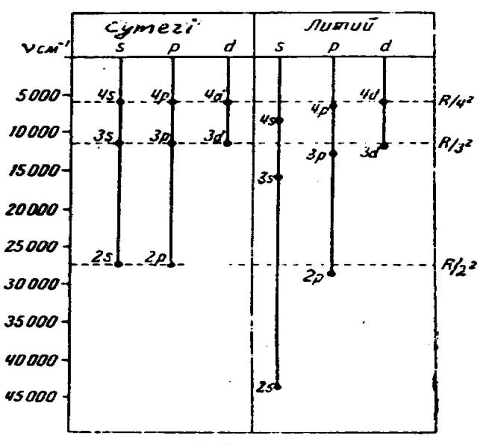
Сурет 7. 4 Литийдiң термдерi мен сутегi термдерiн салыстыру
Осы спектрлiк сызық тарды мұ қ ият жү йелеу нә тижесiнде бұ ларды ә рқ айсысы қ оздырылғ ан атомның қ андай да бiр белгiлi дең гейге ауысуымен байланысты серияларғ а топтастыру мү мкін болады.
Атомның мү мкін болатын стационарлық кү йлерiнiң жиынтығ ын энергетикалық дең гейлер диаграммасы (схемасы) тү рінде кескiндеу қ олданылады. 7. 5-7. 7-суреттерде Li, Na, K атомдарының энергетикалық дең гейлер диаграммалары келтiрiлген. Бұ ларда электрон бiр энергетикалық кү йден басқ асына ауысқ ан кезде атом шығ аратын немесе жұ татын кейбiр спектрлiк сызық тардың толқ ын ұ зындық тары кө рсетiлген.
Сiлтiлiк металдар иондарының спектрлерiн зерттеу атомдық қ алдық тың (яғ ни ядро жә не (z-1) электронның ) импульс моментi нө лге тең 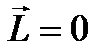 болатынын кө рсеттi. Демек, сiлтiлiк металл атомының орбиталық моментi оның сыртқ ы электронының моментiне тең болады жә не l кванттық санымен анық талады:
болатынын кө рсеттi. Демек, сiлтiлiк металл атомының орбиталық моментi оның сыртқ ы электронының моментiне тең болады жә не l кванттық санымен анық талады: 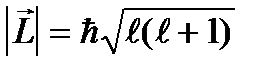 .
.
Сұ рыптау ережесi. Сә уле шығ ару (жә не жұ ту) сыртқ ы электронның бiр дең гейден басқ а дең гейге ауысу нә тижесiнде iске асады. Бiрақ ауысулардың барлығ ы мү мкін болмайды екен. Мү мкін болатыны тек сыртқ ы электронның l орбиталық кванттық саны бiрге ө згеретiн
Dl=±1 (7. 11)
жағ дайлардағ ы ауысулар ғ ана екен. Бұ л рұ қ сат етiлген ауысулар тек s-жә не p-кү йлер арасында, p-жә не d-кү йлер арасында d-жә не f-кү йлер арасында болады деген мағ ына бередi. Бұ л жағ дайларда n бас кванттық сан кез-келген бү тін санғ а ө згере алады.
Кванттық теория тұ рғ ысынан сұ рыптау ережелерi бiр кванттық кү йден басқ а бiр кванттық кү йге ауысу ық тималдығ ымен байланысты болады. Сонда сұ рыптау ережелерi тиым салатын ауысулардың ық тималдығ ы iс жү зінде нө л болады екен.
Спектрлiк сериялар. (7. 4) сұ рыптау ережелерiне сү йенiп литий атомдары спектрiнде мына сериялардың байқ алатындығ ын оң ай тү сіндiруге болады:
–бас серия: 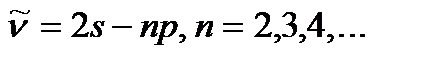
–айқ ын серия: 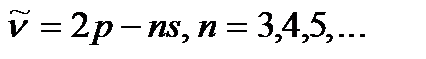
–диффузиялық серия: 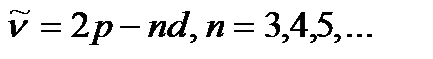 (7. 12)
(7. 12)
–iргелi, немесе Бергман сериясы: 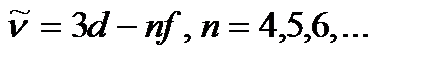
мұ ндағ ы  -шығ арылатын сызық тың толқ ындық саны. Бас серияның
-шығ арылатын сызық тың толқ ындық саны. Бас серияның 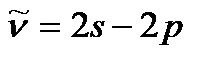 ауысуына сә йкес келетiн спектрлiк сызығ ының интенсивтiгi ең жоғ ары болады. Осы сызық ты резонанстық деп атайды.
ауысуына сә йкес келетiн спектрлiк сызығ ының интенсивтiгi ең жоғ ары болады. Осы сызық ты резонанстық деп атайды.
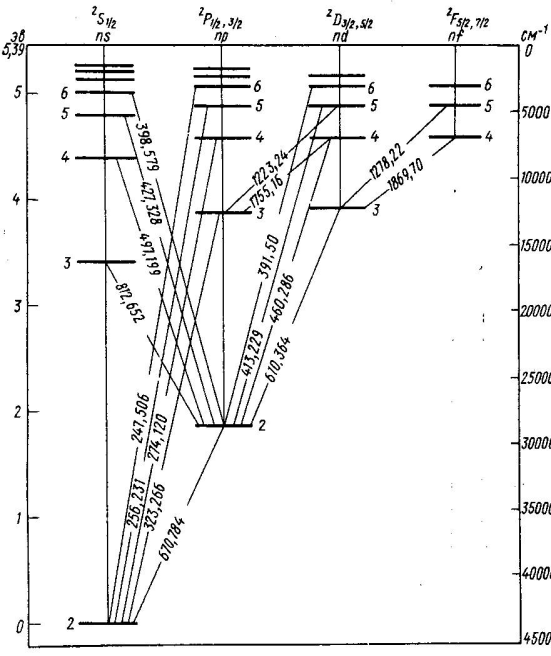
Сурет7. 5 Литий атомының энергетикалық дең гейлерінің схемасы
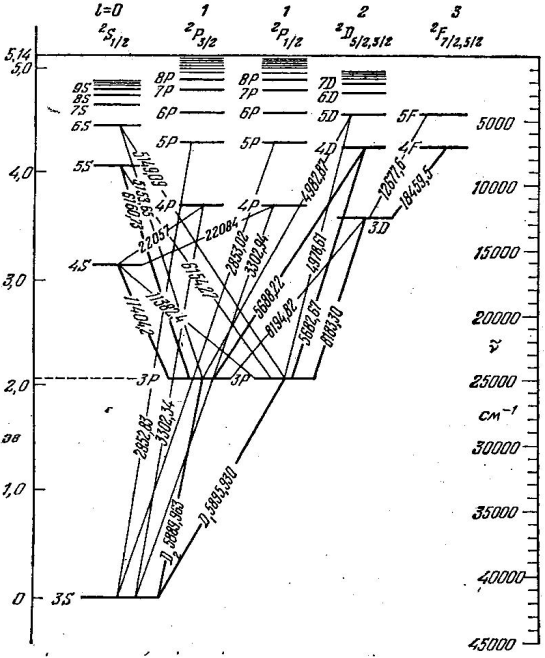
Сурет 7. 6 Натрий атомының энергетикалық дең гейлерінің схемасы
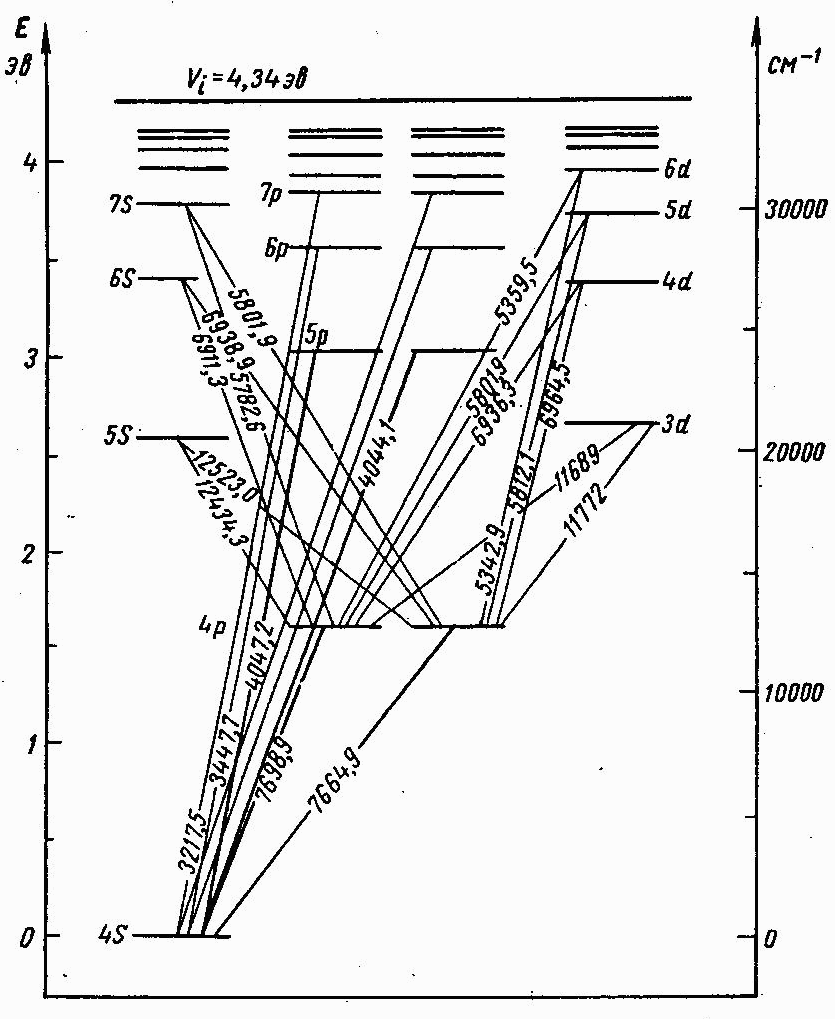
Сурет 7. 7 Калий атомының энергетикалық дең гейлерінің схемасы
(7. 12) ө рнектерiнде сериялар символдық тү рде жазылғ ан. Айқ ын тү рде бұ ларды екi тиiстi термнiң айырымы тү рінде жазады. Мә селен, литийдiң бас сериясы былай жазылады:
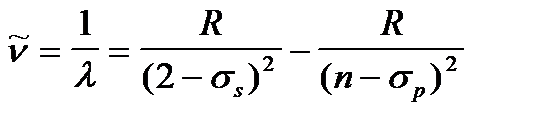 , n=2, 3, 4,... (7. 13)
, n=2, 3, 4,... (7. 13)
Басқ а серияларды да осы сияқ ты жазуғ а болады. Ескеретiн нә рсе, Dl кванттық ақ ау (немесе ридбергтiк тү зетулер Dl =-se) ә рбiр серия аумағ ында iс жү зінде тұ рақ ты болады да, ал бiр сериядан басқ а серияғ а ауысқ анда ө згередi.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|