
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Příklad kysličníku 3 страница
ROZDĚ LENÍ CHEMIE
1. Chemie anorganická (neú strojná ) zkoumá prvky a jejich slouč eniny, s vý jimkou slož itě jš í ch slouč enin uhlí ku.
2. Chemie organická (ú strojná ) zkoumá slouč eniny uhlí ku, ať př irozené, nebo př ipravené umě le.
3. Chemie fyziká lní zkoumá chemické dě je pomocí fyziká lní ch poznatků (např í klad elektrochemie, fotochemie apod. ).
4. Biochemie zkoumá dě je v ž ivé hmotě (trá vení, asimilace apod. ).
CHEMICKÉ LÁ TKY
1. Smě si jsou lá tky, jejichž rů znorodé slož ky mů ž eme okem nebo mikroskopem rozeznat a fyziká lně od sebe oddě lit. (Tř eba magnetem oddě lit ze smě si pí sku a ž elezný ch pilin od pí sku ž elezo. )
Jemné č á steč ky pevný ch lá tek rozptý lené v kapalině tvoř í suspenzi (hlí na ve vodě ). Drobné kapič ky kapaliny rozptý lené v jiné kapalině tvoř í emulzi. Pevné lá tky oddě lujeme od kapalin filtrací. Kapalina proteč e filtrem jako filtrá t. Smě si stejnorodé tvoř í roztoky (sů l ve vodě ). Roztok mů ž e bý t tuhý (slitiny, sklo), kapalný i plynný. Roztok je smě s molekul lá tky rozpuš tě né v rozpouš tě dle. Zná me roztoky nasycené (za studena i za varu), zř edě né a koncentrované. Lá tky jsou rozpustné a nerozpustné. Rozpustnost lá tky udá vá její nejvě tš í množ ství, které se rozpustí ve 100 gramech rozpouš tě dla př i urč ité teplotě. (Rozpustnost vě tš inou stoupá se stoupají cí teplotou. )
Koncentrace roztoku je množ ství rozpuš tě né lá tky (v g) v urč ité m množ ství roztoku. (5%ní roztok cukru znamená, ž e ve 100 g roztoku je 5 g cukru. )
Slož ky smě sí od sebe oddě lujeme plavení m a usazová ní m (sedimentací ), od-stř eď ová ní m a filtrací, odpař ová ní m a krystalizací, destilací a sublimaci a flotací (např. př i ú pravě rudy).
Destilace je oddě lová ní kapaliny z roztoků varem; vzniklé pá ry se chlazení m srá ž ejí, zkapalň ují. Vzniká destilá t.
Sublimací př echá zí skupenství tuhé př í mo v plynné (jó d, naftalen, suchý led, tj. pevný kyslič ní k uhlič itý ).
2. Slouč eniny jsou lá tky slož ené ze dvou nebo z ví ce prvků. Prvky jsou v nich navzá jem vá zané (voda, sů l kuchyň ská, soda apod. ). Prvek označ ujeme chemickou znač kou, slouč eninu chemický m vzorcem. Vzorec udá vá, z jaký ch prvků je tvoř ena slouč enina a v jaké m pomě ru jsou v molekule slouč eniny jejich atomy. Molekulová hmotnost slouč eniny je dá na souč tem atomový ch hmotností vš ech jejich prvků. (At. hmotnost C je 12, O2 je 32. Molekulová hmotnost CO2 je tedy 12 + 32 = 44). Uhlí k a kyslí k jsou slouč eny v pomě ru hmotností 12: 32. Ve 44 g CO2 je tedy 12 g uhlí ku a 32 g kyslí ku. Chemická znač ka znamená atom, vzorec znač í molekulu. Spojení m atomů stejné ho prvku vzniká molekula prvku, spojení m atomů rů zné ho druhu vzniká molekula slouč eniny.
Kapalné a tuhé prvky tvoř í molekuly o rů zné m poč tu atomů, prvky plynné se sklá dají v molekulu obyč ejně ze dvou atomů.
3. Prvky jsou lá tky tak jednoduché, ž e se už chemicky rozdě lit nedají. Prvek tvoř í atomy stejný ch chemický ch vlastností. Je tolik druhů atomů, kolik je prvků. Dosud zná me 88 prvků př irozený ch a 17 prvků umě lý ch. V zemské ků ř e jsou prvky zastoupeny takto:
Kyslí k 49 %, kř emí k 26 %, hliní k 7, 5 %, ž elezo 4 %, vá pní k 3 %, sodí k 2, 5 %, draslí k 2, 5 %, hoř č í k 2, 5 % a vodí k 1 %. To je 98 %, tvoř ený ch deví ti prvky. Na ostatní ch 79 prvků zbý vají pouze 2 %!
Atomová hmotnost je č í slo udá vají cí, kolikrá t je atom urč ité ho prvku tě ž š í než jedna dvaná ctina hmotnosti izotopu uhlí ku 12C.
Prvky dě lí me na kovy a nekovy. (Ví z tabulku prvků! )
Geniá lní roztř í dě ní prvků provedl ruský chemik D. J. Mendě lejev (1834-1907).
ZÁ KLADNÍ CHEMICKÉ REAKCE
Chemický rozklad (analý za) je reakce, v ní ž se slouč eniny rozklá dají (š tě pí ) na slouč eniny jednoduš š í nebo na prvky.
CaCO3 à CaO + CO2 (pá lení vá pence na vá pno)
2HgO à 2Hg + O2 (rozklad teplem – ž í há ní m)
2H2O à 2H2 + O2 (rozklad elektr. proudem-elektrolý za)
Chemické sluč ová ní (synté za) je reakce, v ní ž se prvky sluč ují ve slouč eniny nebo slouč eniny jednoduché v slož itě jš í.
Hoř ení:
hoř ení uhlí ku C + O2 à CO2 (kyslič ní k uhlič itý )
hoř ení sí ry S + O2à SO2 (kyslič ní k siř ič itý )
hoř ení vodí ku 2H2 + O2à 2H2O (voda)
Hoř ení je okyslič ová ní (oxidace) za vzniku tepla a svě tla. Vznikají př itom kyslič ní ky (oxidy).
Podvojná zá mě na je reakce, v ní ž ze dvou slouč enin vznikají dvě jiné.
NaCl + AgNO3à AgCl + NaNO3 2NaCl + H2SO3à 2HCl + Na2SO3
Př í mý m slouč ení m kovů se sí rou vznikají sirní ky: Fe + Sà FeS (sirní k ž eleznatý )
2Ag + Sà Ag2S (sirní k stř í brný )
Pb + S à PbS (sirní k olovnatý )
Chemické nahrazová ní (substituce) je reakce, př i ní ž urč itý prvek vstupuje do slouč eniny a nahradí v ní prvek jiný.
H2SO4 + Zn à ZnSO4 + H2 (sí ran zineč natý )
CuSO4 + Fe à FeSO4 + Cu (sí ran ž eleznatý )
Redukce (odkyslič ová ní ) je odní má ní kyslí ku ze slouč enin kyslí katý ch (oxidů ).
1. Redukce vodí kem: CuO + H2 à Cu + H2O
2. Redukce uhlí kem: PbO + C à Pb + CO
3. Redukce kyslič ní kem uhelnatý m: PbO + CO à Pb + CO2
Vš echny reakce jsou doprová zeny změ nou teploty. Buď se teplo uvolň uje – reakce exotermické, nebo se spotř ebuje – reakce endotermické.
ZÁ KLADNÍ CHEMICKÉ ZÁ KONY
Zá kon o zachová ní hmoty: Souč et hmotností lá tek př ed reakcí se rovná souč tu hmotností lá tek po reakci.
Tento zá kon dal chemii vě decký zá klad. Ř í ká, ž e nic nelze stvoř it z nič eho, ž e nic nelze ani znič it.
Podle tohoto zá kona musí bý t v kaž dé chemické reakci poč et atomů př ed reakcí a po reakci stejný (2H2 + O2 à 2H2O).
Zá kon stá lý ch pomě rů sluč ovací ch: Prvky se sluč ují ve slouč eniny za stá lý ch pomě rů hmotností.
V CuO je sluč ovací pomě r vyjá dř en atomový mi hmotnostmi: Cu: O = 64: 16 (4: 1) C: O = 12: 16 (3: 4) C: O2 = 12: 32 (3: 8)
Zá kon ná sobný ch pomě rů sluč ovací ch: Tvoř í -li dva prvky ví ce slouč enin, jsou vá hová množ ství jednoho prvku, která jsou slouč ena se stejný m množ ství m prvku druhé ho, v pomě ru malý ch a celý ch č í sel.
v CuO: Cu: O = 64: 16
v Cu2O: Cu2: O = 128: 16 Cu: Cu2 = 64: 128 = 1: 2
v SO2: S: O2 = 32: 32 v SO3: S: Os = 32: 48 O2: O3 = 32: 48 = 2: 3
Zá kon stá lý ch pomě rů objemový ch (tý ká se jen plynů ): Objemy plynný ch lá tek jsou př i chemický ch reakcí ch v pomě ru malý ch celý ch č í sel. Grammolekula kaž dé plynně lá tky zaují má př i teplotě 0 °C př i tlaku 760 torrů objem 22, 4 litru.
H2 + Cl2à 2HCl
Objem: 22, 4 l + 22, 4 l = 2. 22, 4 l
1 objem + 1 objem se slouč í na 2 objemy (pomě r je 1: 1: 2)
MOCENSTVÍ PRVKŮ
Mocenství (vaznost) je vlastnost atomů prvků vá zat se s urč itý m poč tem atomů prvků jiný ch.
Mocenství se vyjadř uje č í slem udá vají cí m, s kolika atomy vodí ku se slouč í nebo kolik atomů vodí ku nahradí atom prvku. Jednotkou je sluč ovací schopnost vodí ku. Mocenství znač í me ř í mskou č í slicí vpravo nahoř e u znač ky prvku: H‘ –OII – Al‘“ – Clv atd. Prvky mohou bý t jednomocné až osmimocné.
Chemické ná zvosloví je odvozeno na zá kladě mocenství prvků. Protož e kyslí k se sluč uje té mě ř se vš emi prvky a tvoř í s nimi kyslič ní ky, jsou ná zvy kyslič ní ků zá kladem č eské ho chemické ho ná zvosloví. Mocenství je vyjá dř eno př í ponou př í davné ho jmé na v ná zvu kyslič ní ku. Podle té to př í pony ihned pozná me mocenství, a tí m i poč et atomů prvků, které tvoř í př í sluš ný kyslič ní k.
NÁ ZVOSLOVÍ KYSLIČ NÍ KŮ
| Mocenství | Pomě r poč tu atomů | Typ kyslič ní ku | Př í pona |
Př í klad kyslič ní ku | |
| I | 2: 1 | R2O | –ný | NaaO | – kyslič ní k sodný |
| II | 1: 1 | RO | –natý | CaO | – kyslič ní k vá penatý |
| III | 2: 3 | R2O3 | –itý | Al2O3 | – kyslič ní k hlinitý |
| iv | 1: 2 | RO2 | –ič itý | CO2 | – kyslič ní k uhlič itý |
| v | 2: 5 | R2O5 | –eč ný | p2O5 | – kyslič ní k fosforeč ný |
| –ič ný | N2O5 | – kyslič ní k dusič ný | |||
| vi | 1: 3 | RO3 | –ový | SO3 | – kyslič ní k sí rový |
| vii | 2: 7 | R2O7 | –istý | Mn2O7 | – kyslič ní k manganistý |
| viii | 1: 4 | RO4 | –ič elý | OsO4 | – kyslič ní k osmič elý |
Od ná zvů kyslič ní ků se odvozují i ná zvy jiný ch slouč enin: Ag2S-sirní k stř í brný, FeS – sirní k ž eleznatý, NaCl – chlorid sodný, CaCl2 – chlorid vá penatý atd.
CO LZE VYPOČ Í TAT Z CHEMICKÝ CH VZORCŮ
Chemický vzorec udá vá vá hové slož ení slouč eniny. Ze vzorce a z atomový ch hmotností prvků (které jsou uvedeny v tabulce prvků ) vypoč teme i procentové slož ení. Souč et atomový ch hmotností vš ech prvků ve slouč enině udá vá molekulovou hmotnost slouč eniny. A dě lí me-li atomovou hmotnost prvku ve slouč enině molekulovou hmotností slouč eniny, dostaneme v procentech množ ství onoho prvku ve slouč enině.
Př í klady:
Kolik % vá pní ku je ve vá penci?
Vá penec (uhlič itan vá penatý ) CaCO3 má molekulovou hmotnost 100 (je to souč et atomový ch hmotností vš ech prvků ve vá penci. 40 + 12 + 3. 16 = 100). Procento vá pní ku: 40: 100 = 0, 40. Ve vá penci je tedy 40 % vá pní ku!
Kolik procent olova je v galenitu?
Galenit (sirní k olovnatý ) PbS má molekulovou hmotnost 207 + 32 = 239. Obsah olova: 207: 239 = 0, 866. V galenitu je tedy 86, 6 % olova!
Kolik krystalické vody je v modré skalici?
Modrá skalice (sí ran mě dnatý ) CuS04. 5H2O má molekulovou hmotnost 63 + 32 + 64 + 5. (2 + 16) = 249. Voda má atomovou hmotnost 5. (2 + 16) = 90. Procento vody je 90: 249 = 0, 361. V modré skalici je tedy 36, 1 % vody!
ANORGANICKÉ SLOUČ ENINY
1. Kyslič ní ky (oxidy) jsou slouč eniny prvků s kyslí kem.
2Na +O à NaaO 2K + O à K2O
2. Hydroxidy jsou slouč eniny kovů se skupinou OH‘ (hydroxyl).
Na2O + H2O à 2NaOH (hydroxid sodný )
CaO +H2O à Ca (OH) 2 (hydroxid vá penatý )
NH3 + H2O à NH4OH (hydroxid amonný – č pavek)
3. Kyseliny jsou slouč eniny nekovový ch kyslič ní ků a vody.
CO2 + H2O à H2CO3 (kyselina uhlič itá )
SO3 + H2O à H2SO4 (kyselina sí rová )
N2O5 + H2O à 2HNO3 (kyselina dusič ná )
Kyseliny bezkyslí kové:
H2 + Cl2 à 2HCI (chlorovodí k) H2 + S à H2S (sirovodí k)
Kyseliny a hydroxidy zkoumá me zkoumadly (indiká tory). Lakmus v hydroxidu zmodrá, fenolftalein zč ervená. Kyseliny barví lakmus nač erveno. Kyselý charakter kyseliny udá vá vodí k (nikoli kyslí k! ).
TABULKA DŮ LEŽ ITÝ CH KYSELIN
| Druh | Jmé no | Vzorec | Zbytek | Odvoz soli |
| jednosytné | dusič ná | HNO3 | (NO3) I | dusič nany |
| chlorovodí ková | HCl | (Cl) ‚ | chloridy | |
| dvojsytné | uhlič itá | H2CO3 | (CO3) II | uhlič itany |
| siř ič itá | H2SO3 | (SO3) II | siř ič itany | |
| sí rová | H2SO4 | (SO4) II | sí rany | |
| trojsytné | fosforeč ná | H3PO4 | (PO4) III | fosforeč nany |
4. Soli.
Reakcí, v ní ž na sebe pů sobí kyselina a zá sada, vzniká sů l a voda. Tomuto pochodu ř í ká me neutralizace.
Soli jsou slouč eniny zbytků kyselin (viz tabulku kyselin! ) s kovy nebo se skupinou (NH4)
Vzorec soli odvozujeme od vzorce kyseliny (v ní ž je atom vodí ku nahrazen atomem kovu) a od zbytku kyseliny. Ná zev soli je odvozen od ná zvu kyseliny (viz tabulku kyselin! ). Př í pona se ř í dí pravidly o mocenství. Např í klad: NaNO3 – dusič nan sodný, Ca2 (NO3) 2-dusič nan vá penatý, Al2 (NOa) 3- dusič nan hlinitý apod.
Dvojsytné kyseliny tvoř í dvě skupiny solí: kyselé a normá lní.
Kyselé soli (hydrosoli) mají nahrazen jen jeden atom vodí ku atomem kovu. Např. NaHS04 (hydrosí ran sodný ).
Normá lní soli mají oba atomy vodí ku nahrazeny atomy kovu. Např. Na2CO3 (uhlič itan sodný ).
Soli vznikají
a) neutralizaci kyselin a zá sad
NaOH + HNO3 à NaNO3 + H2O
b) reakcí zá sadotvorný ch (kovový ch) kyslič ní ků s kyselinami
CaO + H2SO4 à H2O + CaSO4
c) reakcí hydroxidů s kyselinotvorný mi kyslič ní ky (nekovový mi)
2NaOH + CO2à Na2CO3 + H2O
d) reakcí ně který ch kovů s kyselinami
Zn + H2SO4à H2 + ZnSO4
ZÁ KLADNÍ POZNATKY Z CHEMIE
 kovy
kovy
 Prvky nekovy
Prvky nekovy
 Chemicky č isté lá tky
Chemicky č isté lá tky
 kyslič ní ky
kyslič ní ky

 Slouč eniny hydroxidy
Slouč eniny hydroxidy
kyseliny
soli
Oxidace
Kov + kyslí kà kyslič ní k kovu (dá vá s kyselinou sů l a vodu)
2Na + O à Na2O
Na2O + H2SO4à Na2SO4 + H2O
Nekov + kyslí kà kyslič ní k nekovu (dá vá se zá sadou sů l a vodu)
S + 3O à SOs
SO3 + 2NaOH à H2O + Na2SO4
Reakce s vodou
Kyslič ní k kovu + vodaà – hydroxid [Na2O + H2O à 2Na (OH) 2]
Kyslič ní k nekovu + vodaà kyselina [SO3 + H2Oà H2SO4)
Neutralizace
Hydroxid + kyselinaà voda a sů l (2NaOH + H2SO4à 2H2O + Na2SO4)
NĚ KOLIK SLOV O ORGANICKÉ CHEMII
Organická chemie se zabý vá slouč eninami uhlí ku (CIV) a jejich př emě nami. V organický ch slouč eniná ch bý vá kromě uhlí ku ješ tě vodí k, č asto kyslí k a ně kdy ješ tě dusí k, sí ra, fosfor a jiné prvky.
Dosud zná me př es dva milió ny organický ch slouč enin. Vě tš inou byly př ipraveny v laboratoř í ch.
Ohromné množ ství organický ch slouč enin lze vysvě tlit schopností uhlí ku tvoř it s jiný mi atomy uhlí ku ř etě zce.
V př í rodě vznikají organické slouč eniny v organismech rostlin a ž ivoč ichů. Zá kladní rostlinný chemický proces, jí mž vzniká organická slouč enina, je asimilace. Rostliny př ijí mají ze vzduchu CO2 a z pů dy H2O. Pů sobení m sluneč ní energie a zelené ho listové ho barviva, chlorofylu, vzniká z CO2 a z H2O bunič ina, celuló za.
chlorofyl
6CO2 + 5H2O + energie slunce à C6H10O5 + 6O2
katalyzá tor
Zá kladní př ehled organický ch slouč enin
1a) Uhlovodí ky s vazbou jednoduchou (nasycené ) jsou: metan (CH4), etan (C2H6), propan (C3H8), butan (C4H10), pentan (C5H12) atd.
U uhlovodí ků pí š eme kromě obvyklý ch chemický ch vzorců ješ tě vzorce strukturní, které ná m prozrazují vnitř ní stavbu (strukturu) molekul.
Př í klady:
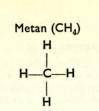
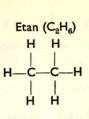
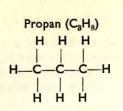
Uhlovodí ky s C3 až C10 jsou kapalné (benzí n, petrolej). Uhlovodí ky s Cu až C15 jsou mazlavé (strojní oleje, vazelí na). Uhlovodí ky s C16 a ví ce jsou tuhé (parafí n).
1b) Uhlovodí ky s vazbou dvojnou, trojnou (nenasycené )
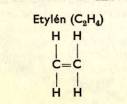
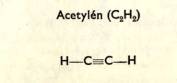
Molekuly nenasycený ch uhlovodí ků se mohou vzá jemně vá zat ve velké molekuly (vazba dvojná př echá zí v jednoduchou).
… CH2-CH2-CH2-CH2-CH2…
Tak z etylé nu vznikají polyetylé ny.
Z uhlovodí ků plynný ch vznikají vysokomolekulá rní slouč eniny (tuhé ). Tato reakce se nazý vá polymerace a vznikají v ní polymery s vlastnostmi plastický ch hmot. Etylé n a acetylé n jsou zá kladní suroviny pro vý robu umě lý ch hmot (syntetický kauč uk apod. ).
1c) Ropa je smě s rů zný ch uhlovodí ků a jiný ch slouč enin.
Frakč ní destilací uvolň ují se př i rů zný ch teplotá ch rů zné lá tky:
př i 40-150 °C surový benzí n
př i 150-250 °C petrolej (nafta)
př i 250-350 °C plynný olej
nad 350 °C surové oleje, vazelí na, parafí n. Zbytek je asfalt.
1d) Rozkladná destilace dř eva a uhlí. Př i tepelné m rozkladu (1000 až 1200 C bez př í stupu vzduchu) vzniká v plyná rná ch a koksá rná ch: 1. ze dř eva: dř evný plyn, dehet, lí h (metanol), ocet a dř evě né uhlí,
2. z uhlí sví tiplyn, dehet a koks.
Z dehtu se vyrá bě jí barviva, lé ky, cukerí n, vý buš niny a jiné hmoty. 1e) Syntetický benzí n vzniká hydrogenací (obohacení vodí kem) hně douhelné ho dehtu. (Naš e vý roba v Zá vodech č eskoslovensko-sově tské ho př á telství v Zá luž í u Mostu. )
II. Cukry vznikají asimilací v zelený ch rostliná ch (fotosynté za). Jsou slož eny z atomů C, H a O. Dě lí me je na jednoduché a slož ené.
1. Jednoduché:
cukr hroznový (glukó za) C6H1206
cukr ovocný (fruktó za) C6H1206 (stejné slož ení, ale jiná struktura molekuly)
2. Slož ené ze dvou molekul cukrů jednoduchý ch:
cukr ř epný (sacharó za) C12H22O11 cukr sladový (maltó za) cukr mlé č ný (laktó za)
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|