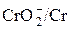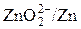Гидролиз солей 3 страница
|
|
| Элемент
| Реакция
| E0
| | N
| 3N2 + 2ē = 2N3-
| -3,4
| | 3N2 + 2H+ + 2ē = 2HN3
| -3,1
| | N2 + 4H2O + 2ē = 2NH2OH + 2OH-
| -3,04
| | N2 + 4H2O + 4ē = N2H4 + 4OH-
| -1,16
| | N2 + 8H2O + 6ē = 2NH4OH + 6OH-
| -0,74
| | NO2- + H2O + ē = NO + 2OH-
| -0,46
| | NO2- + 6H2O + 6ē = NH4OH + 7OH-
| -0,15
| | NO3- + 2H2O + 3ē = NO + 4OH-
| -0,14
| | NO3- + 7H2O + 8ē= NH4OH + 9OH-
| -0,12
| | NO3- + H2O + 2ē= NO2- + 2OH-
| 0,01
| | N2 + 6H+ + 6ē = 2NH3
| 0,057
| | N2H4 + 4H2O + 2ē = 2NH4OH + 2OH-
| 0,1
| | N2 + 8H+ + 6ē = 2NH4+
| 0,275
| | 2NO2- + 4H2O + 6ē = N2 + 8OH-
| 0,41
| | NH2OH + 2H2O + 2ē = NH4OH- + 2OH-
| 0,42
| | 2NO2 + 4H2O + 8e = N2 + 8OH-
| 0,53
| | NO3- + 2H+ + e = NO2 + H2O
| 0,78
| | NO3- + 2H+ + e = NO2 + H2O
| 0,80
| | 2NO + 2H2O + 4e = N2 + 4OH-
| 0,85
| | HNO2 + 7H+ + 6e = NH4+ + 2H2O
| 0,864
| | NO3- + 10H+ + 8e = NH4+ + 3H2O
| 0,87
| | 2NO2 + 2e = 2NO2-
| 0,88
| | N2O + H2O + 2e = N2 + 2OH-
| 0,94
| | NO3- + 3H+ + 2e = HNO2 +2H2O
| 0,94
| | NO3- + 4H+ + 3e = NO + 2H2O
| 0,957
| | NO3- + 4H+ + 3e = NO +2H2O
| 0,96
| | HNO2 + H+ + e = NO + H2O
| 1,00
| | NO2 + 2H+ + 2e = NO + H2O
| 1,03
| | NO2 + H+ + e = HNO2
| 1,09
| | 2NO3- + 10H+ + 8e = N2O + 5H2O
| 1,116
| | 2NO3- + 12H+ + 10e = N2 + 6H2O
| 1,246
| | 2HNO2 + 4H+ + 4e = N2O + 3H2O
| 1,297
| | 2NO2 + 8H+ + 8e = N2 + 4H2O
| 1,36
| | 2HNO2 + 6H+ + 6e = N2 + 4H2O
| 1,45
| | 2NO + 4H+ + 4e = N2 + 2H2O
| 1,678
| | N2O + 2H+ + 2e = N2 + H2O
| 1,766
| | Na
| Na+ + e = Na
| -2,714
| | Nd
| Nd3+ + 3e = Nd
| -2,431
| | Ni
| γ-NiS + 2e = Ni + S2-
| -1,04
| | α-NiS + 2e = Ni + S2-
| -0,83
| | Ni(OH)2 + 2e = Ni + 2OH-
| -0,72
| | Ni(NH3)62+ + 2e = Ni + 6NH3
| -0,49
| | NiCO3 + 2e = Ni + CO32-
| -0,45
| | Ni2+ + 2e = Ni
| -0,25
| | Ni(OH)2 + 2H+ + 2e = Ni + 2H2O
| 0,110
| | NiO + 2H+ + 2e = Ni + H2O
| 0,116
| | NiO2 + 4H+ + 2e = Ni2+ + 2H2O
| 1,68
| | Np
| Np3+ + 3e = Np
| -1,856
| | Np4+ + e = Np3+
| 0,152
| | NpO2+ + 4H+ + 2e = Np3+ + 2H2O
| 0,451
| | NpO2+ + e = NpO2
| 0,564
| | NpO22+ + e = NpO2+
| 1,149
| | Np2O5 +2H+ + 2e = 2NpO2 + H2O
| 1,253
| | O
| O2 + 2H2O + 4e = 4OH-
| 0,401
| | O2 + 2H+ +2e = H2O2
| 0,682
| | H2O2 + 2e = 3OH-
| 0,88
| | O2 + 4H+ + 4e = 2H2O
| 1,229
| | O3 + H2O + 3e = O2 + 2OH-
| 1,24
| | O3 + 6H+ + 6e = 3H2O
| 1,511
| | H2O2 + 2H+ + 2e = 2H2O
| 1,776
| | O3 + 2H+ + 2e = O2 + H2O
| 2,07
| | Os
| OsO2 + 2H2O + 4e = Os + 4OH-
| -0,15
| | OsCl63- + e = Os2+ + 6Cl-
| 0,4
| | OsO4 + 8H+ + 8e = Os + 4H2O
| 0,85
| | OsCl62- + e = OsCl63-
| 0,85
| | Os2+ + 2e = Os
| 0,85
| | OsO4 + 4H+ + 4e = OsO2 + 2H2O
| 0,96
| | P
| H2PO2- + e = P + 2OH-
| -2,05
| | HPO32- + 2H2O + 2e = H2PO2- + 3OH-
| -1,57
| | PO43- + 2H2O+ 2e = HPO32- + 3OH-
| -1,12
| | 2H3PO4 + 2H+ + 2e = H4P2O6 + 2H2O
| -0,94
| | P + 3H2O + 3e = PH3 + 3OH-
| -0,89
| | H3PO2 + H+ + e = P + 2H2O
| -0,51
| | H3PO3 + 3H+ + 3e = P(белый) + 3H2O
| -0,502
| | H3PO3 + 3H+ + 2e = H3PO2 + H2O
| -0,50
| | H3PO3 + 3H+ + 3e = P(красный) + 3H2O
| -0,454
| | H3PO4 + 5H+ + 5e = P(белый) + 4H2O
| -0,411
| | H3PO4 + 4H+ + 4e = H3PO2 + 2H2O
| -0,39
| | H3PO4 + 5H+ + 5e = P(красный) + 4H2O
| -0,383
| | H3PO4 + 2H+ + 2e = H3PO3 + H2O
| -0,276
| | H3PO3 + 2H+ + 2e = H3PO2 + H2O
| -0,50
| | P + 3H+ + 3e = PH3
| 0,06
| | H4P2O6 + 2H+ + 2e = 2H3PO3
| 0,38
| | Pb
| PbS + 2e = Pb + S2-
| -0,93
| | PbO + H2O + 2e = Pb + 2OH-
| -0,58
| | PbCO3 + 2e = Pb + CO32-
| -0,506
| | PbI2 + 2e = Pb + 2I-
| 0,365
| | PbSO4 + 2e = Pb + SO42-
| -0,3563
| | PbF2 + 2e = Pb + 2F-
| -0,350
| | PbBr2 + 2e = Pb + 2Br-
| -0,280
| | PbCl2 + 2e = Pb + 2Cl-
| -0,268
| | Pb2+ + 2e = Pb
| -0,126
| | PbO32- + H2O + 2e = PbO22- + 2OH-
| 0,2
| | PbO + 2H+ + 2e = Pb + H2O
| 0,248
| | Pb(OH)2 + 2H+ + 2e = Pb + H2O
| 0,277
| | PbO2 + H2O + 2e = PbO + 2OH-
| 0,28
| | Pb3O4 + 2H+ + 2e = 3PbO + H2O
| 0,972
| | PbO2 + 4H+ + 2e = Pb2+ + 2H2O
| 1,449-1,455
| | PbO2 + SO42- + 4H+ + 2e = PbSO4 + 2H2O
| 1,685
| | Pb4+ + 2e = Pb2+
| 1,694
| | Pd
| Pd(OH)2 + 2e = Pd + 2OH-
| 0,07
| | PdI62- + 2e = PdI42- + 2I-
| 0,623
| | PdCl42- + 2e = Pd + 4Cl-
| 0,623
| | PdO + 2H+ + 2e = Pd + H2O
| 0,896
| | PdCl62- + 4e = Pd + 6Cl-
| 0,96
| | Pd2+ + 2e = Pd
| 0,987
| | PdBr62- + 2e = PdBr42- + 2Br-
| 0,993
| | PdO2 + 2H+ + 2e = PdO + H2O
| 1,283
| | PdCl62- + 2e = PdCl42- + 2Cl-
| 1,288
| | Pt
| PtS + 2e = Pt + S2-
| -0,95
| | PtS2 + 2e = PtS + S2-
| -0,64
| | Pt(OH)2 + 2e = Pt + 2OH-
| 0,15
| | PtI62- + 2e = PtI42- + 2I-
| 0,393
| | PtBr42- + 2e = Pt + 4Br-
| 0,58
| | PtBr62- + 2e = PtBr42- + 2Br-
| 0,59
| | PtCl62- + 2e = PtCl42- + 2Cl-
| 0,720
| | PtCl42- + 2e = Pt + 4Cl-
| 0,73
| | Pt(OH)2 + 2H+ + 2e = Pt + 2H2O
| 0,980
| | PtO2 + 2H+ + 2e = Pt(OH)2
| 1,045
| | Pt2+ + 2e = Pt
| 1,188
| | Ra
| Ra2+ + 2e = Ra
| -2,925
| | Rb
| Rb+ + e = Rb
| -2,925
| | S
| SO42- + H2O + 2e = SO32- + 2OH-
| -0,93
| | 2SO42- +5H2O + 8e = S2O32- + 10OH-
| -0,76
| | SO32- + 3H2O + 4e = S + 6OH-
| -0,66
| | 2SO32- + 3H2O + 4e = S2O32- + 6OH-
| -0,58
| | S22- + 2e = 2S2-
| -0,524
| | S + 2e = S2-
| -0,48
| | 2S + 2e = S22-
| -0,476
| | S + H+ + 2e = HS-
| -0,065
| | S2O32- + 6H+ + 8e = 2S2- + 3H2O
| -0,006
| | S4O62- + 2e = 2S2O32-
| 0,08
| | SO42- + 8H+ + 8e = S2- + 4H2O
| 0,149
| | S + 2H+ + 2e = H2S
| 0,141-0,17
| | SO42- + 4H+ + 2e = H2SO3 + H2O
| 0,17
| | SO32- + 6H+ + 6e = S2- + 3H2O
| 0,231
| | 2SO42- + 10H+ + 8e = S2O32- + 5H2O
| 0,29
| | SO42- + 10H+ + 8e = H2S + 4H2O
| 0,311
| | SO42- + 8H+ + 6e = S + 4H2O
| 0,357
| | 2H2SO3 + 2H+ + 4e = S2O32- +3H2O
| 0,40
| | H2SO3 + 4H+ + 4e = S +3H2O
| 0,449
| | S2O32- + 6H+ + 4e = 2S + 3H2O
| 0,5
| | 2SO32- + 6H+ + 4e = S2O32- + 3H2O
| 0,705
| | S2O82- + 2e = 2SO42-
| 2,01
| | Sb
| SbO2- + 2H2O + 3e = Sb + 4OH-
| -0,675
| | Sb + 3H+ + 3e = SbH3
| -0,51
| | SbO3- + H2O + 2e = SbO2- + 2OH-
| -0,43
| | Sb2O3 + 6H+ + 6e = 2Sb + 3H2O
| 0,152
| | SbO+ + 2H+ + 3e = Sb + H2O
| 0,212
| | SbO3- + 2H+ + 3e = SbO2- + H2O
| 0,353
| | SbO2- + 4H+ + 3e = Sb + 2H2O
| 0,446
| | Sb2O5 + 6H+ + 4e = 2SbO+ + 3H2O
| 0,581
| | Sb2O5 + 4H+ + 4e = Sb2O3 + 2H2O
| 0,671
| | Sc
| Sc3+ + 3e = Sc
| -2,077
| | Se
| Se + 2e = Se2-
| -0,92
| | Se + 2H+ + 2e = H2Se
| -0,40
| | SeO32- + 3H2O + 4e = Se + 6OH-
| -0,366
| | SeO42- + H2O + 2e = SeO32- + 2OH-
| 0,05
| | H2SeO3 + 4H+ + 4e = Se + 3H2O
| 0,741
| | SeO42- + 4H+ + 2e = H2SeO3 + H2O
| 1,15
| | Si
| SiO32- + 3H2O + 4e = Si + 6OH-
| -1,7
| | SiF62- + 4e = Si + 6F-
| -1,2
| | SiO32- + 6H+ + 4e = Si + 3H2O
| -0,455
| | Si + 4H+ + 4e = SiH4
| 0,102
| | Sn
| SnS + 2e = Sn + S2-
| -0,94
| | Sn(OH)62- + 2e = HSnO2- + H2O + 3OH-
| -0,93
| | HSnO2- + H2O + 2e = Sn + 3OH-
| -0,91
| | SnF62- + 4e = Sn + 6F-
| -0,25
| | Sn2+ + 2e = Sn
| -0,136
| | SnO2 + 2H+ + 2e = SnO + H2O
| -0,108
| | SnO2 + 4H+ + 4e = Sn + 2H2O
| -0,106
| | SnO + 2H+ + 2e = Sn + H2O
| -0,104
| | Sn(OH)2 + 2H+ + 2e = Sn + 2H2O
| -0,091
| | SnCl62- + 2e = SnCl42+ + 2Cl- ( 1M HCl)
| 0,14
| | Sn4+ + 2e = Sn2+
| 0,151
| | Sr
| Sr2+ + 2e = Sr
| -2,888
| | Te
| Te + 2e = Te2-
| -1,14
| | Te + 2H+ + 2e = H2Te
| -0,72
| | TeO32- + 2H2O + 4e = Te + 6OH-
| -0,57
| | TeO2 + 4H+ + 4e = Te + 2H2O
| 0,529
| | TeO42- + 2H+ + 2e = TeO32- + H2O
| 0,892
| | H6TeO6 + 2H+ + 2e = TeO2 + 4H2O
| 1,02
| | Ti
| Ti2+ + 2e = Ti
| -1,63
| | TiO + 2H+ + 2e = Ti + H2O
| -1,306
| | TiF62- + 4e = Ti + 6F-
| -1,19
| | TiO2 + 4H+ + 4e = Ti + 2H2O
| -0,86
| | TiO2(рутил) + H+ + 4e = Ti3+ + 2H2O
| -0,666
| | TiO2(рутил) + 2H+ + 4e = Ti2+ + 2H2O
| -0,502
| | Ti3+ + e = Ti2+
| -0,368
| | Ti4+ + e = Ti3+ (5M H3PO4)
| -0,15
| | TiO2+ + 2H+ + 2e = Ti2+ + H2O
| -0,135
| | TiO2+ + 2H+ + e = Ti3+ + H2O
| 0,10
| | Tl
| Tl2S + 2e = 2Tl + S2-
| -0,93
| | TlI + e = Tl + I-
| -0,753
| | TlBr + e = Tl + Br-
| -0,658
| | TlCl + e = Tl + Cl-
| -0,557
| | TlOH + e = Tl + OH-
| -0,344
| | Tl+ + e = Tl
| -0,3363
| | Tl(OH)3 + 2e = TlOH + 2OH-
| -0,05
| | Tl2O3 + 3H2O + 4e = 2Tl+ + 6OH-
| 0,02
| | TlOH + H+ + e = Tl + H2O
| 0,778
| | Tl3+ + 2e = Tl+
| 1,252
| | U
| UO2 + 2H2O + 4e = U + 4OH-
| -2,39
| | U3+ + 3e = U
| -1,798
| | U4+ + e = U3+
| -0,607
| | UO22+ = UO2+
| 0,05
| | UO22+ + 4H+ + 2e = U4+ + 2H2O
| 0,334
| | UO2+ + 4H+ + e = U4+ + 2H2O
| 0,62
| | V
| V2+ + 2e = V
| -1,175
| | V3+ + e = V2+
| -0,255
| | VO2+ + 4H+ + 5e = V + 2H2O
| -0,25
| | VO22+ + e = VO+
| -0,044
| | VO2+ + 4H+ + 3e = V2+ + 2H2O
| 0,360
| | V2O5 + 6H+ + 2e = 2VO2+ + 3H2O
| 0,958
| | VO2+ + 2H+ + e = VO2+ + H2O
| 1,004
| | VO43- + 6H+ + 2e = VO+ + 3H2O
| 1,256
| | H2VO4- + 4H+ + e = VO2+ + 3H2O
| 1,314
| | W
| WO42- + 4H2O + 6e = W + 8OH-
| -1,05
| | WO2 + 4H+ + 4e = W + 2H2O
| -0,119
| | WO3 + 6H+ + 6e = W + 3H2O
| -0,09
| | W2O5 + 2H+ + 2e = 2WO2 + H2O
| -0,031
| | 2WO3 + 2H+ + 2e = W2O5 + H2O
| -0,029
| | WO42- + 8H+ + 6e = W + 4H2O
| 0,049
| | 2WO42- + 6H+ + 2e = W2O5 + 3H2O
| 0,801
| | Zn
| ZnS + 2e = Zn + S2-
| -1,405
| | Zn(CN)42- + 2e = Zn + 4CN-
| -1,26
| | Zn(OH)2 + 2e = Zn + 2OH-
| -1,245
| | Zn(OH)42- + 2e = Zn + 4OH-
| -1,22
| | ZnO22- + 2H2O + 2e = Zn + 4OH-
| -1,216
| | ZnCO3 + 2e = Zn + CO32-
| -1,06
| | Zn(NH3)42+ + 2e = Zn + 4NH3
| -1,04
| | Zn2+ + 2e = Zn
| -0,763
| | ZnO22- + 4H+ + 2e = Zn + 2H2O
| 0,441
| | Zr
| ZrO2+ + 2H+ + 4e = Zr + H2O
| -1,570
| | ZrO2 + 4H+ + 4e = Zr + 2H2O
| -1,553
| | Zr4+ + 4e = Zr
| -1,539
|
|
| |
|
|
|
Таблица 2
Окислительно-восстановительные потенциалы водорода, кислорода и некоторых металлов в кислой, нейтральной и щелочной средах
| Среда
| | Кислая (pH = 0)
| Нейтральная (pH = 7)
| Щелочная (pH = 14)
| | Red/Ox пара
| j0, B
| Red/Ox пара
| j0, B
| Red/Ox пара
| j0, B
| | Mg2+/Mg
| -2.36
| Mg(OH)2/Mg
| -2.38
| Mg(OH)2/Mg
| -2.69
| | Al3+/Al
| -1.66
| Al(OH)3/Al
| -1.88
| 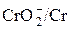
| -1.32
| | Zn2+/Zn
| -0.76
| Cr(OH)3/Cr
| -0.93
| 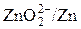
| -1.22
| | Cr3+/Cr
| -0.74
| Zn(OH)2/Zn
| -0.81
| 
| -0.91
| | Fe2+/Fe
| -0.44
| Sn(OH)2/Sn
| -0.50
| Fe(OH)2/Fe
| -0.87
| | Cd2+/Cd
| -0.40
| Fe(OH)2/Fe
| -0.46
| 2H2O/H2
| -0.83
| | Co2+/Co
| -0.28
| 2H2O/H2
| -0.41
| Cd(OH)2/Cd
| -0.82
| | Ni2+/Ni
| -0.25
| Cd(OH)2/Cd
| -0.41
| Co(OH)2/Co
| -0.73
| | Sn2+/Sn
| -0.14
| Co(OH)2/Co
| -0.32
| Ni(OH)2/Ni
| -0.72
| | Pb2+/Pb
| -0.13
| Ni(OH)2/Ni
| -0.30
| 
| -0.54
| | 2H+/H2
| 0.00
| Pb(OH)2/Pb
| -0.14
| Bi2O3/2Bi
| -0.45
| | Ag+/Ag
| +0.80
| BiO+/Bi
| -0.04
| 
| -0.36
| | Bi3+/Bi
| +0.21
| Cu(OH)2/Cu
| +0.19
| Cu(OH)2/Cu
| -0.22
| | Cu2+/Cu
| +0.34
| AgCl/Ag
| +0.22
|
|
| | O2/2H2O
| +1.22
| O2/4OH-
| +0.81
| O2/4OH-
| +0.40
| |
|
| Cl2/2Cl-
| +1.36
|
|
|
Таблица 3
Названия некоторых кислот и их солей
|