
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Рецензент: А.В.Колтунов, доцент кафедры ОПИ Уральского государственного горного университета
Министерство образования и науки РФ
ФГБОУ ВПО
«Уральский государственный горный университет»
М. Н. Попова
ХИМИЯ
Контрольные задания для студентов-заочников всех направлений
бакалавриата и специалитета
Екатеринбург 2013
Министерство образования и науки РФ
ФГБОУ ВПО «Уральский государственный горный университет»
ОДОБРЕНО
Методической комиссией горномеханического факультета УГГУ
« » 2013 г.
Председатель комиссии
профессор
В.П.Барановский.
М.Н.Попова ХИМИЯ
Контрольные задания для студентов - заочников всех направлений бакалавриата и специалитета
Издание УГГУ Екатеринбург,2013
А 94
Рецензент: А.В.Колтунов, доцент кафедры ОПИ Уральского государственного горного университета
Учебное пособие рассмотрено на заседании кафедры химии 27 июня 2013 г. (протокол № 10) и рекомендовано для издания в УГГУ.
Попова М.Н.
А 94 Химия: контрольные задания для студентов - заочников всех направлений бакалавриата и специалитета /М.Н.Попова -Екатеринбург: Изд-во УГГУ, 2013. - С.58
Контрольные задания состоят из 9 разделов, включающих задания по основным темам химии. Цель данного пособия - проверить знания по химии поступивших студентов - заочников, подготовить их к выполнению лабораторного практикума, усвоении материала в курсе лекций.
С. Уральский государственный горный университет, 2013 С Попова М.Н.,2013
ОГЛАВЛЕНИЕ
1. Введение 5
2. Строение атома 6
3 . Химическая кинетика и равновесие 8
3.1. Скорость химических реакций 8
3.2. Химическое равновесие 10
4. Растворы электролитов 13
4.1. Концентрация растворов 13
4.2. Электролитическая диссоциация 18
4.3. Гидролиз солей 22
5. Окислительно-восстановительные процессы 25
5.1. Окислительно-восстановительные реакции 25
5.2. Гальванические элементы 28
5.3. Электрохимическая коррозия 31
5.3. Электролиз растворов 33
6. Номера вариантов 38
7. Список литературы 42
8. Приложение 43
Введение
Без химии трудно представить прогресс в горном деле. Все сферы горного производства пронизаны современной химической наукой и технологией. Поэтому горный инженер любой специальности должен обладать достаточными знаниями в области химии.
Основной вид занятий студентов–заочников – самостоятельная работа над учебным материалом. По курсу химии она складывается из следующих этапов: изучение материала по учебникам и учебным пособиям; выполнение контрольной работы, посещение лекций, выполнения лабораторного практикума, сдачи зачёта или экзамена в период экзаменационной сессии. К лабораторному практикуму допускаются только студенты, сдавшие в срок контрольные задания.
Контрольную работу студент должен писать в тетради и сдавать для регистрации в деканат. На обложке тетради указать фамилию, имя, отечество, номер группы, номер варианта, название специальности. Обязательно полностью переписать условия заданий, иначе работа не будет проверена. Вариант задания соответствует последним двум цифрам номера зачётной книжки (или студенческого билета) студента (номера вариантов «соответствующих заданий приведены в конце данной методической разработки»).
1. Строение атома
Задание 1. Какой подуровень заполняется в атоме электронами после заполнения подуровня 4р?
Решение. Подуровню 4р отвечает сумме n+l, равная 4+1=5. Такой же суммой n+l характеризуют подуровни 3d(3+2=5) и 5s(5+0=5) . Однако состоянию 3d отвечает меньшее значение n(n=3), чем состоянию 4р, поэтому подуровень 3s будет заполняться раньше, чем подуровень 4р. Следовательно, в соответствии с правилом Клечковского после заполнения подуровня 4р будет заполняться подуровень 5d, которому отвечает на единицу большее значение n(n=5) .
Задание 2. Напишите электронные формулы атомов и ионов, укажите положение их в периодической системе Д. И. Менделеева (номер периода, группа, подгруппа): Na+; Cl-
Решение. Электронная формула химического элемента натрия следующая: 1s2 2s2 2p6 3s1. Oн расположен в третьем периоде, первой группе, главной подгруппе периодической системы Д. И. Менделеева.
Электронная формула иона Cl-: 1s2 2s2 2p6 3s2 3p6. Хлор расположен в третьем периоде, седьмой группе, главной подгруппе периодической системы Д. И. Менделеева.
Каждое задание содержит 2 вопроса (а, б)
Задания к разделу 2
| Номер задания | а) Укажите численные значения главного и орбитального квантовых чисел данных подуровней, рассчитайте последовательность их заполнения | б) Напишите электронные формулы предложенных атомов и ионов, укажите их положение в системе (номер периода, группа, подгруппа) |
| 3p; 4s; 2p | Fe; Na+ | |
| 3d; 4p; 3p | Co; Br- | |
| 5d; 4p 4d | Ni; Ba2+ | |
| 3d; 4f; 5s | Zn; Ca2+ | |
| 4d; 4s; 5s | Sn; S2- | |
| 6s; 4p; 4f | W; Bi3+ | |
| 3d; 5s; 7p | S; La3+ | |
| 4d; 6s; 5d | F; Tl3+ | |
| 4p; 5p; 4f | Br; Zr4+ | |
| 3d; 3p; 2s | Al; Hg2+ | |
| 5d; 3s; 6s | Pb; Au3+ | |
| 6d; 4f; 5p | Ge; Ag+ | |
| 5d; 3p; 4d | Ga; Sb3+ | |
| 7s; 6p; 4d | Ni; Bi3+ | |
| 5d; 4p; 3d | Cl; Pb2+ | |
| 5s; 6s; 4p | Y; Hf4+ | |
| 6p; 5f; 6d | Zr; At- | |
| 5d; 5s; 4f | Ta; Ga3+ | |
| 3s; 4d; 3p | Mo; Cu2+ | |
| 5f; 4d; 4s | Cr; Se2- |
3. Химическая кинетика и равновесие
3.1 Скорость химических процессов
В зависимости от характера реакции скорость определяется следующим образом. Для гомогенных систем (однородным по составу и свойствам) скорость измеряется:
V = 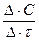
где V – скорость химической реакции, моль/л∙сек.
ΔC – изменение концентрации вещества за время Δτ = τ2 – τ1
τ1 – исходный момент времени, с,
τ2 – текущий момент времени, с (τ2 > τ1)
В гетерогенных системах (состоящих из 2х или более однородных частей, находящихся в разном фазовом состоянии) при определении скорости концентрации твердых веществ не учитываются. Скорость реакции зависит от природы реагирующих веществ, концентрации, температуры, давления и присутствия катализаторов.
Скорость химической реакции прямо пропорциональна произведению молярных концентраций реагирующих веществ.
Пример 1. H2 + Cl2 = 2HCl
V® = k× СH2×СCl2
где k – константа скорости прямой реакции
СH2- концентрация водорода, моль/л
СCl2- концентрация хлора, моль/л
Концентрация веществ может обозначаться квадратными скобками, заключенными вокруг формулы вещества. Например, для этой реакции скорость прямой реакции можно записать так:
V® = k× [H2]×[Cl2]
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа: при повышении температуры на каждые 100 скорость большинства реакций увеличивается в 2-4 раза
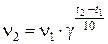
где γ – температурный коэффициент скорости реакции, значения которого для большинства реакций лежит в интервале от 2 до 4.
ν2 - скорость реакции при температуре t2, oC
ν1 - скорость реакции при температуре t1, oC
Пример 2. Температурный коэффициент скорости реакции равен 2,8. Во сколько раз возрастёт скорость реакции при повышении температуры от 200 до 75 0С ?
Решение. t2 - t1 = 75 – 20 = 55 оС. Обозначив скорость реакции при 20о и 75о соответственно ν1 и ν2 получаем: ν2/ ν1 =2,855/10=2,85,5=287.
Скорость реакции увеличится в 287 раз.
2.2 Химическое равновесие
Состояние системы, при котором скорости прямой и обратной реакции равны, называют химическим равновесием. Состояние равновесия характеризуется константой равновесия Кс.
Гомогенная система:
2СО (г) + О2 = 2СО2 (г)
Кс= 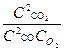
где Ссо; СО2; ССО2 – равновесные концентрации веществ, моль/л.
Гетерогенная система:
Fe2O3 (т) + 3Н2 (г) = 3Fe (т)+3Н2О (г)
Кс= 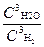
В выражении константы равновесия концентрация твердой фазы не входит, так как она является практически постоянной величиной.
На состояние равновесия системы влияют давление, концентрация реагирующих веществ и температура. Система может находиться в состоянии равновесия бесконечно долго. Если изменить условия его существования, равновесие будет нарушено. Переход из одного равновесного состояния в другое называют смещением равновесия. Определить направление смещения равновесия позволяет принцип Ле Шателье: если находящаяся в равновесии система подвергается внешнему воздействию, равновесие смещается в направлении, которое способствует ослаблению этого воздействия.
Пример. 1 Для реакции N2 (г)+ 3H2 (г) = 2NH3 (г) в какую сторону смещается равновесие если увеличить концентрацию аммиака и давление?
Решение: С увеличением концентрации аммиака равновесие смещается влево. С увеличением давления в этой системе равновесие смещается вправо.
Пример 2. В системе А(г)+2В(г)=С(г) равновесные концентрации равны Сра =0,06 моль/л, Срв =0,12 моль/л , Срс =0,216 моль/л . Найти константу равновесия реакции и исходные концентрации веществ А и В.
Решение: Константа равновесия выражается уравнением:
Кс= 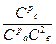 =
= 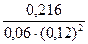 = 250
= 250
Для нахождения исходных концентраций веществ А и В следует учесть, что согласно уравнению реакции, из 1 моль А и 2 моль В образуется 1 моль С. Поскольку по условию задачи в каждом литре системы образовалось 0, 216 моль вещества С, то при этом было израсходовано 0,216 моль вещества А и 0,216*2 = 0,432 моль вещества В. Таким образом, искомые исходные концентрации равны:
Соа = 0,06+0,216=0,276 моль/л,
Сов = 0,12+0,432=0,552 моль/л.
Задания к разделу 2.
21. Напишите выражение для константы равновесия реакции:
Si + 2Н2О ↔ SiO2+2H2
22. Рассчитайте исходную концентрацию СО для реакции, если равновесные концентрации [CO]=0,01, [СОS] = 0,03 моль/л.
Sb2S3+3CO=2Sb+3COS
23. Температурный коэффициент скорости реакции равен 2,5. Во сколько раз увеличится скорость, если температуру повысить на 40°?
24. В какую сторону сдвинется равновесие системы C+2N2O ↔ CO2+2N2 если увеличить объём системы?
25. Как повлияет на равновесие реакции СаCO3 ↔ CaO+CO2 -179 кДж, понижение температуры?
26. Напишите выражение для константы равновесия реакции:
Fе2О3 +3CO ↔2Fe + ЗСО2
27. Чему равна начальная концентрация NО2, если в момент равновесия
концентрация NO была 0,3 моль/л , О2 – 0,15 моль/л, NO2 - 0,2 моль/л.
28. Во сколько раз изменится скорость химической реакции, если температуру понизили с 25° до -15о при температурном коэффициенте скорости 2?
29. Куда сдвинется равновесие реакции Н2 +J2 ↔ 2HJ при уменьшении объёма системы в 3 раза?
30. Куда сдвинете я равновесие реакции N2О4 ↔ 2NO2 -Q, если повысить температуру в системе?
31. Напишите выражение для константы равновесия реакции:
2N2O ↔ 2N2 + O2
32. Чему равна скорость реакции СuO + 2HNO3 = Сu(NО3)2 + Н2О при
концентрации 3 моль/л и константе скорости реакции К = 0,4 ?
33. Во сколько раз уменьшится скорость химической реакции при снижении температуры с 50 до 20 С°, если температурный коэффициент равен 3 ?
34. В какую сторону сдвинется равновесие реакции CO + Н2О ↔ СО2 + Н2 при увеличении давления?
35. В какую сторону сдвинется равновесие реакции 2С + О2 ↔ 2СО; ΔН0 = - 105 кДж при понижении температуры ?
36. Написать выражение для константы равновесия реакции:
2C2H4 (г) + 5O2 ↔ 4CO2 + 2H2O (пар)
37. Рассчитать начальную концентрацию кислорода для реакции, если равновесные концентрации кислорода равна 0,34 моль/л, а диоксида азота равна 0,72 моль/л.
2NO + O2 ↔ 2NO2
38. Температурный коэффициент скорости реакции равен 5. Во сколько раз увеличится скорость реакции, если температуру повысить с 800 до 1100С.
39. В какую сторону сдвинется равновесие реакции при уменьшении объёма системы: 2CO + O2 ↔ 2CO2
40. В системе: N2 + O2 ↔ 2NO ΔH0=180 кДж. Произошло повышение температуры. В какую сторону сдвинулось равновесие?
Задания 41-60 . Напишите математическое выражение Кс (константы химического равновесия) для обратимых реакций и укажите направление смещения равновесия при изменении условий:
А) уменьшении парциального давления одного из исходных газообразных веществ;
Б) понижении давления;
В) повышении температуры.
| Номер задания | Уравнение реакции | ΔНо, кДж/моль |
| 2N2O (г) + O2 (г) = 4NO (г) | ||
| 4NH3 (г) + 5O2 (г) = 4NO (г) + 6H2O (г) | ||
| 2H2S (г) + 3O2 (г) = 2SO2 (г) + 2H2O (г) | ||
| CO2 (г) + H2 (г) = CO (г) + H2O (г) | ||
| 2H2 (г) + O2 (г) = 2H2O (г) | -484 | |
| 2SO2 (г) + O2 (г) = 2SO3 (г) | -196 | |
| 2NO (г) + O2 (г) = 2NO2 (г) | -112 | |
| Fe3O4 + H2 (г) = 3FeO + H2O (г) | ||
| FeO + H2 (г) = Fe + H2O (г) | -272 | |
| C + H2O (г) = CO (г) + H2 (г) | ||
| CO (г) + H2O (г) = CO2 (г) + H2 (г) | -41 | |
| SO3 (г) + H2 (г) = SO2 (г) + H2O (г) | -144 | |
| H2 (г) + Cl2 (г) = 2HCl (г) | -184 | |
| FeO + CO (г) = Fe + CO2 (г) | -11 | |
| 2ZnS + 3O2 (г) = 2ZnO + 2SO2 (г) | -878 | |
| N2 (г) + 3H2 (г) = 2NH3 (г) | -92 | |
| CaCO3 = CaO + CO2 (г) | ||
| 2MgCl2 + 2O2 (г) = 2MgO + 2Cl2 (г) | ||
| Ca(OH)2 (т) = CaO (т) + H2O (г) | ||
| H2O (г) +CO (г) = CO2 (г) + H2 (г) | -41 |
4 Растворы электролитов
4.1 Концентрация растворов
Содержание растворенного вещества в растворе может быть выражено либо безразмерными единицами долями, либо величинами размерными – концентрациями. Наиболее часто употребляют следующие методы выражения концентрации растворов.
Массовая доля растворенного вещества (ω) – отношение массы растворенного вещества (mв) к общей массе раствора (mр):
mв
ω = ——
mр
Если отношение mв/mр: умножить на 100%, то концентрация раствора будет выражена в %.
Молярная концентрация (См или М) или молярность – число молей растворенного вещества (ν) в одном литре раствора:
См = 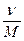 =
= 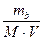 (моль/л)
(моль/л)
где mв – масса растворенного вещества, М - молярная масса растворенного вещества, г/моль,
V - объём раствора, л.
Эквивалентная концентрация (Сэ) – отношение массы растворенного вещества к произведению эквивалента данного вещества на объём раствора:
Сэ = 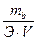 (моль/л)
(моль/л)
Пример 1. Вычислить массу хлорида натрия и воды, необходимых для приготовления 500 г раствора, в котором содержание хлорида натрия в массовых долях равно 0,05 (или 5 %)
Решение:
По определению массовой доли, выраженной в %.
ω = 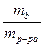 ∙100 %
∙100 %
Отсюда находим mв = 
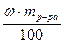 =
= 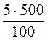 =25 г.
=25 г.
Учитывая, что масса раствора равна 500 г, масса воды будет равна: 500-25=475 г.
Пример 2. Определить молярную концентрацию 15 % раствора карбоната натрия с плотностью 1,18 г/мл.
Решение:
Воспользуемся формулой, связывающей процентную и молярную концентрацию:
См = 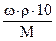 ,
,
где ρ – плотность раствора, г/мл
ω - массовая доля, %
М - молярная масса растворенного вещества, г/моль
В нашем случае: М =106
См = 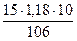 = 1,66 моль/л
= 1,66 моль/л
Задания к подразделу 4.1
Каждое задание содержит по 2 задачи (а, б)
61 а) К 500 мл раствора соляной кислоты (р = 1.10 г/мл) прибавили 2.5 л воды, после чего раствор стал 4% - ным. Определите процентное содержание растворенного вещества в исходном растворе. б) Определите молярную концентрацию 10% - ного раствора азотной кислоты (р=1,06 г/мл).
62 а) Определите молярную концентрацию раствора сульфата калия, в 200 мл которого содержится 1,74 г растворенного вещества. б) Определите процентное содержание растворенного вещества 1М раствора нитрата никеля (11), плотность которого 1,08 г/мл.
63 а) Определите молярную концентрацию 10%-ного раствора серной кислоты (р=1,07 г/мл). б) Сколько мл воды следует добавить к 100 мл 20%-го раствора серной кислоты (р=1,14 г/мл) для получения 5%-го раствора?
64 а) В каком объеме воды следует растворить 32,2 г, чтобы получить 5%-ный раствор сульфата натрия? б) Определите процентное содержание растворенного вещества 0,9М раствора (р=1,05 г/мл).
65 а) Сколько граммов медного купороса СиSО4 • 5Н2О и воды требуется для приготовления 150 г 8%-ного раствора в расчете на безводную соль? б) Определите молярную концентрацию 27%-ного раствора соляной кислоты (р=1,14 г/мл).
66 а) До какого объёма следует разбавить 1,5 л 20%-ного раствора хлорида аммония (р=1,06 г/мл), чтобы получить 10%-ный раствор (р=1,03 г/мл).
б) Сколько миллилитров 70%-ного раствора нитрата калия (р=1,16 г/мл) требуется для приготовления 0.5 л 0,2М раствора?
67 а) Сколько граммов кристаллической соды Na2СО3 •10Н2О надо взять для приготовления 2 л 0,2 М раствора Na2СО3? б) Сколько миллилитров 36% - ного раствора соляной кислоты (р = 1,18 г/мл) требуется для приготовления 4 л 0,5 М раствора?
68 а) К 1 л 20% - ного раствора гидроксида натрия (р = 1,22 г/мл) прибавили 10 л воды. Определите процентное содержание растворенного вещества в полученном растворе, б) Определите молярную концентрацию 8% - ного раствора сульфата натрия (р = 1,08 г/мл),
69 а) Сколько миллилитров 10%-ного раствора Na2СО3 (р ~ 1,10 г/мл), следует прибавить к 1 л 2% -ного раствора (р = 1,02 г/мл), чтобы получить 3% - ный раствор этой соли? б) Определите процентное содержание растворенного вещества в 2 М растворе гидроксида натрия (р = 1,08 г/мл).
70 а) Сколько миллилитров воды следует прибавить к 25 мл 40% - ного раствора КОН (р=1,40 г/мл), чтобы получить 2 % - ный раствор? б) Сколько миллилитров 96 % -ного раствора серной кислоты (р = 1,84 г/мл) требуется для приготовления 300 мл 0,5 М раствора?
71 а) Сколько граммов медного купороса СиSО4 • 5Н2О следует добавить к 150 мл воды, чтобы получить 5% -ный раствор СиSО4? б) Сколько миллилитров 30% - ного раствора азотной кислоты (р= 1,84 г/мл) требуется для приготовления 250 мл 0,5 М раствора?
72 а) Определите процентное содержание растворенного вещества в 0.25 М растворе гидрокскда натрия (р = 1,01 г/мл), б) Сколько миллилитров 0,1 М раствора НС1 можно приготовить из 20 мл 0,5 М раствора этой кислоты?
73 а) Определите молярную концентрацию 10% - ного раствора соляной кислоты (р = 1,05 г/мл), б) Сколько миллилитров 30% -ной азотной кислоты (р = 1.18 г/мл) требуется для приготовления 250 мл 11% - ного раствора (р = 1,07 г/мл)?
74 а) Сколько миллилитров 30% раствора КОН (р=1,29 г/мл) требуется для приготовления 300 мл 0.1 М раствора? б) К 760 мл 20% - ного раствора NаОН (р= 1,22 г/мл) прибавили 140 мл 10% - ного раствора NаОН (р=1,11 г/мл). Определите процентное содержание растворенного вещества.
75 а) К 50 мл 96% раствора серной кислоты (р=1,84 г/мл) прибавили 50 мл воды. Определите процентное содержание растворенного вещества в полученном растворе. б) Определите молярную концентрацию 72% раствора азотной кислоты (р = 1,43 г/мл).
76 а) Определите молярную концентрацию 6%-ного раствора фосфорной кислоты (р = 1,03 г/мл), б) Определите процентное содержание растворенного вещества раствора, полученного смешением 10 мл 96% -ного раствора азотной кислоты р=1,5 г/мл и 20 мл 48%-го раствора азотной кислоты р =1,3 г/мл.
77 а) До какого объема следует разбавить 500 мл 20% - кого раствора хлорида натрия (р ~ 1,15 г/мл), чтобы получить 4,5% - ный раствор (р ~ 1,03 г/мл)? б) Определите молярную концентрацию 50% раствора азотной кислоты (р =1,31 г/мл).
78 а) Определите молярную концентрацию 60%-ного раствора серной кислоты (р =1,5 г/мл). б) Сколько миллилитров 32% - ного раствора азотной кислоты (р =1,39 г/мл) необходимо для приготовления 300 мл 0,75М раствора?
79 а) Сколько миллилитров 0,2 М раствора азотной кислоты необходимо для нейтрализации 80 мл 0,6 М раствора NаОН? б) Определите процентное содержание растворенного вещества в 1,5 М растворе КОН (р = 1,07 г/мл).
80 а) Определите молярную концентрацию 10 % раствора карбоната натрия (р=1,10 г/мл). б) Сколько миллилитров 30% раствора (р=0,9 г/мл) требуется для получения 400 мл 2М его раствора?
4.2. Электролитическая диссоциация.
Ионно-молекулярные уравнения.
Электролитами называют вещества, растворы и расплавы которых проводят электрический ток. К электролитам относятся неорганические кислоты, основания, амфотерные гидроксиды и соли. Они распадаются в водных растворах и расплавах на катионы и анионы.
Процесс распада молекул электролитов на ионы в среде растворителя получил название электролитической диссоциации. Количественно диссоциация определяется степенью и константой диссоциации. Степень диссоциации – это число, показывающее какая часть молекул от общего их количества в растворе распадается на ионы:
a = 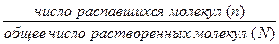
По степени диссоциации электролиты условно разделяют на сильные (a ≈ 1) и слабые(a < 1).
Сильные электролиты
К ним относятся минеральные кислоты: HNO3, H2SO4, HCl, HBr, HJ, HClO4; гидроксиды щелочных и щелочно-земельных металлов: LiOH, NaOH, KOH, Ba(OH)2 и др. ; соли – средние, кислые, основные – Fe2(SO4)3; NaHCO3; Al(OH)Cl2 и тп.
Сильные электролиты диссоциируют практически нацело:
Fe2(SO4)3 = 2Fe3+ + 3SO42-
HNO3 = H+ + NO3-
NaHCO3 = Na+ + HCO3-
Ba(OH)2 = Ba2+ + 2OH-
Слабые электролиты
К ним относятся кислоты: HNO2, H2CO3, H2S и др. а также все органические кислоты, в том числе уксусная CH3COOH; гидроксиды металлов основного характера Fe(OH)3, Cu(OH)2 и др. (кроме щелочных и щелочноземельных) и гидроксид аммония NH4OH, а также амфотерные гидроксиды Al(OH)3; Cr(OH)3; Zn(OH)2; Sn(OH)2 и др.
Для слабых электролитов диссоциация обратимый процесс, для которого справедливы общие законы равновесия. Например, для уксусной кислоты константа равновесия, называемая константой диссоциации имеет вид: CH3COOH ↔ CH3COO- + H+
Кд = 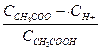
Многоосновные кислоты и многокислотные основания диссоциируют ступенчато, и каждую ступень равновесного состояния характеризует своя константа диссоциации (причем К 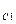 всегда больше К
всегда больше К 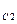 и т.д.), например, при
и т.д.), например, при
диссоциации Н2S: 1-я ступень Н2S ↔ Н+ + НS- К 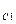 =
= 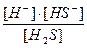 = 6∙10-8
= 6∙10-8
2- я ступень НS- ↔ Н+ + S2- К 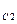 =
= 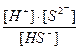 = 1∙10-14,
= 1∙10-14,
где [ ] - равновесные концентрации ионов и молекул.
Диссоциация Сu(ОН)2:
1-я ступень Си(ОН)2 ↔ Си(ОН)+ + ОН-
2-я ступень Си(ОН)+ ↔ Си2+ + ОН-
Амфотерные гидроксиды, например Рb(ОН)2 диссоциируют по основному типу: Рb(ОН)2 ↔ РbОН+ + ОН-
РbОH+ ↔ Pb2+ + ОН-
и кислотному:
Н2РbО2 ↔ Н+ + НРbО2-
HPbO2- ↔ H+ + PbO22-
В растворах электролитов реакции протекают между ионами. Для записи ионных реакций применяют ионные уравнения. При составлении ионных уравнений реакций все слабые электролиты, газы и труднорастворимые электролиты записывают в молекулярной форме, все сильные электролиты (кроме труднорастворимых солей) в ионной форме. Примеры составления ионных уравнений реакций:
а) образование труднорастворимых соединений:
Cu(NO3)2 + 2NaOH = Cu(OH)2¯ + 2NaNO3
Cu2+ + 2NO3- + 2Na+ + 2OH- = Cu(OH)2¯ + 2Na+ + 2NO3-
Cu2+ + 2OH- = Cu(OH)2¯
б) образование газообразных веществ:
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
2Na+ + CO32- + 2H+ + 2Cl- = 2Na+ + 2Cl- + H2O + CO2
CO32- + 2H+ = H2O + CO2
в) образование слабых электролитов:
CH3COONa + HNO3 = CH3COOH + NaNO3
CH3COO- + Na+ + H+ + NO3- = CH3COOH + Na+ + NO3-
CH3COO- + H+ = CH3COOH
Пример 1. Написать реакции для следующих превращений: KOH А® KHSO3 В® K2SO3
Решение:
А. KOH + H2SO3 = KHSO3 + H2O
K+ + OH- + H2SO3 = K+ + HSO3- + H2O
OH- + H2SO3 = HSO3- + H2O
В. KHSO3 + KOH = K2SO3 + H2O
K+ + HSO3- + K+ + OH- = 2K+ + SO32- + H2O
HSO3- + OH- = SO32- + H2O
Задания к разделу 4.2.
Задания 81-100. напишите для предложенных соединений уравнения диссоциации, а также в молекулярной и ионной формах уравнения возможных реакций взаимодействия их H2SO4 с и NaOH.
| 81. HCl; Cr(OH)3 | 91. Ca(OH)2; H3PO4 |
| 82. Cd(OH)2; H2S | 92. HNO3; Be(OH)2 |
| 83. Cu(OH)2; HBr | 93. H2Cr2O7; KOH |
| 84. H2SO3; Sn(OH)2 | 94. HCN; Ga(OH)3 |
| 85. H2SiO3; Pb(OH)2 | 95. KOH; H2CO3 |
| 86. CH3COOH; Fe(OH)3 | 96. HF; Be(OH)2 |
| 87. H2Se; Zn(OH)2 | 97. NH4OH; HClO4 |
| 88. Fe(OH)2; H3AsO3 | 98. Pb(OH)2; HNO2 |
| 89. LiOH; HJ | 99. Mg(OH)2; HClO |
| 90. H2Te; Al(OH)3 | 100. Ba(OH)2; HMnO4 |
Задания 101-120. Напишите в молекулярной и ионной формах уравнения реакций для следующих превращений:
101. Ni(OH)2 ® (NiOH)2SO4 ® NiSO4 ® Ni(OH)2
102. CuSO4 ® (CuOH)2SO4 ® Cu(OH)2 ® Cu(OH)NO3
103. Bi(NO3)3 ® Bi(OH)(NO3)2 ® Bi(OH)3 ® Bi2O3
104. Co(OH)2 ® Co(OH)Cl ® CoCl2 ® Co(NO3)2;
105. Pb(NO3)2 ® Pb(OH)NO3 ® Pb(OH)2 ® K2PbO2
106. NiCl2 ® Ni(OH)2 ® Ni(OH)Cl ® NiCl2
107. Cr(OH)Cl2 ® CrCl3 ® Cr(OH)3 ® Cr(OH)SO4
108. (SnOH)2SO4 ® SnSO4 ® Sn(OH)2 ® Na2SnO2;
109. NiBr2 ® Ni(OH)Br ® Ni(OH)2 ® NiSO4
110. CoSO4 ® Co(OH)2 ® (CoOH)2SO4 ® Co(NO3)2
111. Cr2(SO4)3 ® Cr(OH)SO4 ® Cr2(SO4)3 ® CrCl3;
112. NiSO4 ® (NiOH)2SO4 ® Ni(OH)2 ® NiBr2;
113. Fe(OH)SO4 ® Fe2(SO4)3 ® Fe(OH)3 ® FeCl3
114. Sn(OH)2 ® Sn(OH)Cl ® K2SnO2 ® Sn(OH)2
115. NiBr2 ® (NiOH)2 SO4 ®Ni(OH)2 ®NiBr2
116. Al(OH)3 ®Al(OH)2Cl ® AlCl3 ® Al(NO3)3;
117. CoCl2 ® Co(OH)2 ® (CoOH)2SO4 ® CoSO4,
118. Bi(OH)3 ® Bi(OH)2NO3 ®Bi(OH)3 ®Bi2O3
119. Cu(OH)2 ® Cu(OH)Cl ® CuCl2 ® Cu(NO3)2
120. CoSO4 ®(CoOH)2SO4 ®Co(OH)2 ®Co(NO3)2
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|