
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Гидролиз солей 2 страница
Электролиз с растворимым анодом если анод изготовлен из металла, способного растворяться в данном электролите, то происходит окисление металла и анод называют растворимым.
Пример 3. Электролиз водного раствора сульфата меди с медным
анодам.
| (-) катод Cu; H2O | (+) анод Cu; SO42-; H2O |
| EoCu2+/Cu = +0,34 В | EoCu2+/Cu = +0,34 В |
| Eo2H2О/H2 = -1,0 В | EoO2/2H2O = +1,8 B |
| Так как EoCu2+/Cu> Eo2H2О/H2 идет восстановление катионов меди: | Сульфат–ионы не разряжаются, так как EoCu2+/Cu < EoO2/2H2O |
| Cu2+ + 2ē ® Cu0 | Анод растворяется Cu0 -2ē ® Cu2+ |
Массу вещества, получаемого электролизом, определяют позаконам, открытым М. Фарадеем в 1834 г. Обобщенный закон Фарадея связывает массу вещества, образовавшегося при электролизе, со временем электролиза и силой тока:
M = 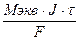 (г)
(г)
где m – масса образовавшегося вещества, г;
J – сила тока, А;
t – время электролиза, с;
F – константа Фарадея (96500 кул/моль)
Mэкв – молярная масса электрохимических эквивалентов вещества. Рассчитывается как частное от деления молярной массы вещества на число электронов, перемещаемых при окислении или восстановлении.
Пример 1. Ток силой 2, 5А, проходя через раствор электролита, за 30 мин выделяет из раствора 2,77 г металла. Найти молярную массу эквивалентов металла.
Решение:
Из закона Фарадея:
Mэкв = 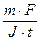 =
= 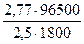 = 59,4 г/моль.
= 59,4 г/моль.
Задания к подразделу 5.4
Рассмотрите катодные и анодные процессы при электролизе водных растворов указанных веществ. Процессы на электродах обоснуйте значениями потенциалов (таблица 1). Составьте схемы электролиза с инертными электродами водных растворов предложенных соединений (отдельно два раствора). С инертными электродами, или растворимым анодом. Рассчитайте массу или объём (при н.у. для газов) продуктов, выделяющихся на электродах при пропускании через раствор в течении 1 часа тока силой 1А.
| LiBr; CoSO4 | NaCl; Al2(SO4)3 | ||
| K3PO4; Pb(NO3)2 | Co(NO3)2; KJ | ||
| Ba(NO3)2; Sn(NO3)2 | NiSO4; NaNO2 | ||
| Cr(NO3)3; CuCl2 (Cu -) | FeBr2; NaOH | ||
| Ca(NO3)2; NiSO4 | ZnCl2; CoBr2 | ||
| K2CO3; NiBr2 (Ni -) | NiSO4; MgCl2 | ||
| CoCl2; HNO3 | MgCl2; AgNO3 (Ag -) | ||
| AgNO3; Al2(SO4)3 | Ba(NO3)2; Na2CO3 | ||
| BaCl2; H2SO4 | NaNO3; NiCl2 | ||
| Pb(NO3)2; H2SO4 | KOH; ZnSO4 |
6. Варианты заданий
Номер варианта – последние две цифры зачётной книжки
| Номер варианта | Номера заданий |
| 1, 21, 41, 61, 81, 101, 121, 141, 161, 181, 201, 221 | |
| 2, 22, 42, 62, 82, 102, 122, 142, 162, 182, 202, 222 | |
| 3, 23, 43, 63, 83, 103, 123, 143, 163, 183, 203, 223 | |
| 4, 24, 44, 64, 84, 104, 124, 144, 164, 184, 204, 224 | |
| 5, 25, 45, 65, 85, 105, 125, 145, 165, 185, 205, 225 | |
| 6, 26, 46, 66, 86, 106, 126, 146, 166, 186, 206, 226 | |
| 7, 27, 47, 67, 87, 107, 127, 147, 167, 187, 207, 227 | |
| 8, 28, 48, 68, 88, 108, 128, 148, 168, 188, 208, 228 | |
| 9, 29, 49, 69, 89, 109, 129, 149, 169, 189, 209, 229 | |
| 10, 30, 50, 70, 90, 110, 130, 150, 170, 190, 210, 230 | |
| 11, 31, 51, 71, 91, 111, 131, 151, 171, 191, 211, 231 | |
| 12, 32, 52, 72, 92, 112, 132, 152, 172, 192, 212, 232 | |
| 13, 33, 53, 73, 93, 113, 133, 153, 173, 193, 213, 233 | |
| 14, 34, 54, 74, 94, 114, 134, 154, 174, 194, 214, 234 | |
| 15, 35, 55, 75, 95, 115, 135, 155, 175, 195, 215, 235 | |
| 16, 36, 56, 76, 96, 116, 136, 156, 176, 196, 216, 236 | |
| 17, 37, 57, 77, 97, 117, 137, 157, 177, 197, 217, 237 | |
| 18, 38, 58, 78, 98, 118, 138, 158, 178, 198, 218, 238 | |
| 19, 39, 59, 79, 99, 119, 139, 159, 179, 199, 219, 239 | |
| 20, 40, 60, 80, 100, 120, 140, 160, 180, 200, 220, 240 | |
| 1, 25, 44, 63, 85, 107, 132, 151, 172, 193, 211, 231 | |
| 2, 22, 46, 61, 82, 105, 134, 152, 173, 194, 208, 222 | |
| 3, 21, 41, 67, 84, 108, 127, 148, 169, 185, 207, 234 | |
| 4, 27, 42, 63, 83, 103, 131, 146, 165, 192, 205, 231 | |
| 5, 26, 47, 65, 87, 106, 129, 141, 172, 189, 212, 238 | |
| 6, 21, 43, 64, 89, 107, 122, 151, 169, 191, 209, 227 | |
| 7, 25, 49, 65, 86, 103, 125, 145, 162, 189, 212, 235 | |
| 8, 23, 47, 62, 83, 106, 124, 141, 162, 187, 207, 224 | |
| 9, 21, 42, 67, 85, 108, 125, 142, 163, 186, 208, 229 | |
| 10, 22, 47, 61, 79, 111, 126, 143, 171, 193, 209, 238 | |
| 11, 27, 41, 68, 81, 107, 125, 152, 175, 198, 209, 238 | |
| 12, 24, 55, 73, 82, 112, 131, 147, 168, 191, 213, 235 | |
| 13, 34, 56, 765, 91, 102, 126, 148, 170, 189, 204, 227 | |
| 14, 25, 44, 67, 87, 105, 134, 151, 169, 192, 207, 228 | |
| 15, 31, 47, 75, 95, 117, 137, 150, 173, 189, 212, 234 | |
| 16, 29, 41, 74, 93, 112, 134, 152, 171, 188, 211, 233 | |
| 17, 32, 43, 78,, 91, 101, 135, 153,172, 193, 210, 240 | |
| 18, 21, 42, 67, 85, 102, 126, 142, 164, 187, 208, 231 | |
| 19, 39, 45, 68, 84, 111, 127, 141, 163, 192, 207, 230 | |
| 20, 38, 44, 67, 88, 110, 131, 142, 161, 189, 211, 226 | |
| 11, 29, 40, 61, 90, 105, 128, 154, 168, 190, 209, 222 | |
| 12, 22, 45, 62, 92, 107, 130, 153, 167, 191, 210, 223 | |
| 13, 27, 46, 63, 93, 108, 131, 154, 162, 190, 205, 229 | |
| 14, 30, 43, 62, 94, 109, 132, 149, 170, 187, 212, 235 | |
| 15, 31, 47, 69, 87, 103, 133, 148, 169, 191, 211, 226 | |
| 16, 22, 48, 68, 86, 102, 132, 147, 168, 190, 204, 231 | |
| 17, 23, 42, 67,85, 115, 135, 151,161, 191, 205, 228 | |
| 18, 32, 55, 71, 91, 107, 134, 150, 167, 192, 206, 229 | |
| 19, 31, 54, 72, 92, 108, 129, 149, 172, 189, 210, 227 | |
| 10, 23, 47, 62, 93, 112, 136, 153, 171, 187, 208, 221 | |
| 11, 24, 48, 61, 87, 113, 131, 152, 167, 191, 212, 234 | |
| 12, 25, 41, 62, 88, 110, 130, 156, 168, 192, 206, 231 | |
| 13, 26, 42, 63, 89, 111, 131, 149, 161, 190, 209, 238 | |
| 14, 32, 49, 71, 87, 109, 132, 148, 170, 183, 205, 229 | |
| 15, 33, 43, 70, 35, 108, 133, 151, 163, 184, 204, 240 | |
| 16, 31, 48, 69, 84, 107, 135, 149, 161, 187, 202, 224 | |
| 17, 28, 42, 61, 35, 104, 129, 148,164, 189, 209, 222 | |
| 18, 21, 42, 67, 85, 102, 126, 142, 164, 187, 208, 231 | |
| 19, 29, 44, 62, 84, 105, 128, 147, 163, 185, 210, 223 | |
| 20, 32, 47, 68, 83, 109, 130, 152, 164, 187, 206, 225 | |
| 1, 31, 56, 78, 97, 117, 136, 156, 176, 195, 210, 234 | |
| 2, 29, 54, 76, 96, 112, 135, 154, 174, 198, 209, 233 | |
| 3,28, 53, 75, 94, 111, 134, 153, 173, 194, 208, 231 | |
| 4, 26, 51, 74, 93, 115, 132, 151, 172, 193, 207, 230 | |
| 5, 24, 55, 71, 92, 114, 134, 152, 171, 189, 204, 222 | |
| 6, 27, 51, 72, 91, 109, 140, 155, 165, 191, 205, 235 | |
| 7, 23, 44, 63, 85, 106, 139, 150,171, 192, 201, 226 | |
| 8, 34, 47, 62, 87, 104, 136, 156, 164, 189, 219, 227 | |
| 9, 29, 41, 61, 89, 108, 136, 156, 161, 187, 218, 231 | |
| 10, 21, 49, 67, 86, 105, 128, 147, 162, 188, 217, 236 | |
| 11, 22, 48, 69, 88, 110, 129, 148, 169, 185, 212, 235 | |
| 12, 32, 52, 64, 84, 112, 127, 151, 168, 186, 211, 232 | |
| 13, 29, 53, 75, 95, 116, 135, 154, 175, 193, 210, 234 | |
| 14, 28, 54, 77, 99, 115, 136, 153, 176, 194, 209, 233 | |
| 15, 37, 51, 76, 98, 114, 134, 151, 168, 191, 208, 231 | |
| 16, 36, 52, 71, 91, 112, 133, 152, 167, 192, 207, 229 | |
| 17, 31, 48, 70,, 92, 110, 130, 156,174, 199, 206, 228 | |
| 18, 30, 47, 72, 93, 112, 131, 155, 175, 198, 205, 230 | |
| 19, 32, 46, 75, 95, 110, 128, 154, 176, 197, 204, 223 | |
| 20, 33, 44, 78, 91, 111, 125, 153, 171, 196, 205, 224 | |
| 11, 34, 41, 79, 90, 117, 126, 149, 170, 190, 206, 225 | |
| 12, 29, 51, 78, 94, 106, 130, 147, 173, 189, 204, 226 | |
| 13, 26, 49, 77, 95, 108, 131, 146, 174, 191, 212, 230 | |
| 14, 28, 47, 74, 93, 107, 129, 145, 175, 195, 215, 235 | |
| 15, 27, 52, 69, 86, 104, 136, 154, 161, 188, 207, 236 | |
| 16, 30, 51, 68, 85, 105, 134, 156, 174, 189, 208, 237 | |
| 17, 29, 44, 61,, 89, 106, 135, 147,176, 191, 210, 223 | |
| 18, 31, 47, 62, 91, 110, 132, 152, 175, 192, 209, 224 | |
| 19, 32, 48, 63, 90, 109, 128, 156, 168, 194, 211, 240 | |
| 20, 34, 49, 67, 91, 112, 129, 153, 169, 199, 210, 239 | |
| 11, 35, 47, 71, 88, 107, 127, 156, 171, 189, 207, 225 | |
| 11, 36, 48, 72, 87, 106, 126, 155, 172, 188, 206, 226 | |
| 13, 29, 47, 73, 89, 108, 129, 158, 176, 187, 212, 227 | |
| 14, 33, 44, 78, 90, 105, 128, 157, 173, 186, 211, 226 | |
| 15, 31, 43, 77, 89, 104, 127, 156, 173, 194, 211, 222 | |
| 16, 30, 51, 76, 88, 105, 123, 155, 174, 195, 210, 232 | |
| 17, 28, 48, 72, 86, 103, 128, 151, 175, 187, 211, 235 | |
| 18, 27, 47, 73, 85, 102, 127, 149, 172, 186, 210, 228 | |
| 19, 26, 42, 71, 81, 109, 125, 152, 171, 189, 209, 235 | |
| 20, 24, 41, 75, 82, 110, 121, 148, 169, 190, 208, 227 |
Список литературы
1. Глинка Н.Л. Общая химия.:Учебник/под.рел. В.А.Попкова, А.В.Бабкова.- 18-е изд., перераб. и доп.-М.: Издательство Юрайт; ИД Юрайт, 2011,886с
2. Коровин Н.В. Общая химия Учебник/ 13-е изд., перераб. и доп.-М.: Издательский центр "Академия" 2011 .-496с
3, Глинка Н.Л. Задачи и упражнения по общей химии. Учебное пособие/ Изд.стер.- М.: КНОРУС. 2011. 240с.
4. Попова М.Н., Ишметова Р.И. Общая химия. Учебное пособие по самостоятельной работе для студентов заочного обучения всех специальностей. Издание УГГУ, Екатеринбург, 2010.-43 с.
5. Кузьменко Н.Е., Еремин В.В., Попков В.В. Начала химии: учебник – М.: Экзамен, 2004.-720 с.
8. Приложения
Таблица 1
|
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|