
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Гидролиз солей 1 страница
4.3. Гидролиз солей
Гидролиз солей – это процесс взаимодействия ионов соли с молекулами воды, приводящий к смещению ионного равновесия воды и изменению рН среды.
В зависимости от силы электролита, образовавшего соль, различают три случая гидролиза.
Гидролиз по катиону
Гидролиз по катиону протекает, если соль образована слабым основанием и сильной кислотой. В растворах таких солей возникает кислая реакция среды (рН<7). Например: для СuСl2 ионное уравнение гидролиза следующее:
Сu2+ + НОН = СuОН+ + H+, рН<7
молекулярное уравнение гидролиза: СuСl2 + НОН = СuОНСl + НСl.
Гидролиз по аниону
Гидролиз по аниону протекает, если соль образована слабой кислотой и сильным основанием. Растворы таких солей имеют щелочную реакцию среды (рН>7). Например, для Nа2СО3 ионное уравнение гидролиза:
СО32- + НОН == НСО3- + ОН- рН>7
Молекулярное уравнение: Na2CO3 + НОН = NaНСО3 + NаОН
Гидролиз по катиону и аниону
Гидролиз по катиону и аниону протекает, если соль образована и слабым основанием, и слабой кислотой. Реакция среды в растворе при этом остается близкой к нейтральной и определяется сравнительной силой слабых оснований и кислоты, образующих соль.
В случае гидролиза по катиону и аниону возможны два варианта протекания реакции.
1. Если соль растворима в воде, то гидролиз протекает при обычных условиях по первой ступени, т.е. одна молекула соли взаимодействует с одной молекулой воды. Ионное уравнение гидролиза:
NН4+ + СО32- + НОН = NH4OH + НСО3- рН~7.
Молекулярное уравнение гидролиза:
(NН4)2СО3 + НОН = NH4OH + NН4НСО3.
2. Если соль не существует в растворе (в таблице растворимости против такой соли стоит прочерк), то при соединении с водой такая соль полностью разлагается водой с образованием слабого труднорастворимого гидроксида, выпадающего в осадок, и слабой, часто летучей кислоты. Например: Al2S3 Ионное уравнение гидролиза:
2А13+3S2- + 6НОН = 2А1(ОН)3 + 3H2O
Молекулярное уравнение гидролиза:
А12S3 + 6НОН= 2А1(ОН)3 +3Н2S.
Задания к подразделу 4.3
Задания 121-140. Напишите в молекулярной и ионной формах уравнения реакций гидролиза солей, укажите значения рН растворов этих солей (больше или меньше семи).
| 121. NaNO2, Cu(NO3)2 | 131. Na2HPO4, Mg(NO3)2 |
| 122. AlCl3, NaHCO3 | 132. Al2(SO4)3, Na2SeO3 |
| 123. Na3PO4, ZnCl2 | 133. CuSO4, K3PO4 |
| 124. FeCl2, K2S | 134. Na2SO3, Fe2(SO4)3 |
| 125. K2SO3, ZnSO4 | 135. NaCN, FeSO4 |
| 126. NH4Cl, KClO | 136. Ba(CH3COO)2, CoSO4 |
| 127. Na2Se, MnCl2 | 137. NiSO4, NaF |
| 128. ZnSO4, BaS | 138. Pb(NO3)2, Ba(NO3)2 |
| 129. Ni(NO3)2, KNO2 | 139. Cr2(SO4)3, NaCH3COO |
| 130. NH4Br, Na2S | 140. KHS, MgSO4 |
Задания 141-160. Напишите в молекулярной и ионной формах уравнения реакций совместного гидролиза предложенных солей.
| 141. Fe2(SO4)3 + Na2CO3 | 151. CrCl3 + K2S |
| 142. Na2S + Al2(SO4)3 | 152. Na2CO3 + Cr(NO3)3 |
| 143. NH4Cl + Na2SiO3 | 153. K2SiO3 + Bi(NO3)3 |
| 144. Cr2(SO4)3 + K2S | 154. Na2SO3 + CrCl3 |
| 145. K2CO3 + Bi(NO3)3 | 155. NH4NO3 + Na2SiO3 |
| 146. Na2S + AlCl3 | 156. AlCl3 + Na2SO3 |
| 147. BeSO4 + K2S | 157. K2SO3 + CrCl3 |
| 148. Cr2(SO4)3 + Na2SO3 | 158. Na2S + Al2(SO4)3 |
| 149. K2SO3 + AlBr3 | 159. Fe(NO3)3 + K2CO3 |
| 150. Bi(NO3)3 + Na2CO3 | 160. Al(NO3)3 + Na2CO3 |
5. Окислительно-восстановительные процессы.
5.1 Окислительно-восстановительные реакции
Окислительно-восстановительными реакциями называют реакции, протекающие с изменением степени окисления (СО) элементов. Степень окисления – это тот условный заряд атома элемента, который вычисляют, исходя из предположения, что молекула состоит только из ионов (как правило, обозначают арабской цифрой, заряд ставят перед цифрой). СО рассчитывается на основании положения, что сумма СО всех атомов, входящих в молекулу равно нулю, а всех атомов , составляющих ион – заряду иона.
Ряд элементов имеют постоянную СО. Например:
Водород Н (за исключением гидридов, где, СО Н = - 1) +1
Щелочные металлы (Nа, К, Li и др.) +1
Металлы 2 группы периодической системы (Са, Zn и т. д.) +2
Металлы 3 группы периодической системы (А1) +3
Кислород О -2
(За исключением ОF2, где СО кислорода +1; перекисей Н2О2, Na2О2 и т.д., где СО кислорода – 1).
Составление уравнений окислительно-восстановительных реакций.
Прежде всего необходимо рассчитать степени окисления всех элементов реакции в левой и правой частях уравнения. Для нахождения коэффициентов при составлении окислительно-восстановительных реакций необходимо:
- соблюдение принципа электронного баланса (число электронов, отданных восстановителем (Red) , должно быть равно числу электронов, принятых окислителем (Ox), например:
Al + O2 ® Al2O3
Red Ox
4 Al - 3ē = Al3+()
3 O2 + 4ē = 2O2¯
 4Al + 3O2 = 2Al2O3
4Al + 3O2 = 2Al2O3
В реакциях, протекающих в водных растворах, следует использовать среду (кислую, щелочную, нейтральную). Например, в кислой среде:
K2Cr2O7 + KJ + H2SO4 ® Cr2(SO4)3 + J2 + H2O + K2SO4
3 2J- - 2ē = J2
1 Cr2O72- + 6ē + 14H+ = 2Cr+3 + 7H2O
Суммарное молекулярное уравнение реакции:
K2Cr2O7 + 6KJ + 7H2SO4 ® Cr2(SO4)3 + 3J2 + 7H2O + 4K2SO4
В щелочной среде:
KCrO2 + KClO4 + KOH → K2CrO4 + KCl + H2O
8 CrO2- - 3ē + 4OH- → CrO42- + 2H2O
3 ClO4- + 8ē + 4H2O → Cl- + 8OH-
Суммарное молекулярное уравнение реакции
8KCrO2 + 3KClO4 + 8KOH → 8K2CrO4 + 3KCl + 4H2O
Среда нейтральная:
KMnO4 + MnSO4 + H2O → MnO2 + K2SO4 + H2SO4
3 Mn - 2ē + 2H2O = MnO2 + 4H+
2 MnO4 + 3ē + 2H2O = MnO2 + 4OH-
6H2O + 4H2O → 12H+ + OH-
2H2O → 4H+
Суммарное молекулярное уравнение реакции:
2KMnO4 + 3MnSO4 + 2H2O = 5MnO2 + K2SO4 + 2H2SO4
Задания 161-180. Составьте электронно-ионные схемы и молекулярные уравнения реакций. Укажите окислитель и восстановитель. Для каждого задания по две реакции (а, б):
161. a) Na2SeO3 + KBrO + H2O ® Br2; SeO42-
б) HCl + HNO3 ® Cl2; NO
162. a) Cr2(SO4)3 + Cl2 + KOH ® CrO42-; Cl-
б) NaNO2 + KJ + H2SO4 ® NO; J2
163. a) NaCrO2 + NaClO + KOH ® CrO42-; Cl-
б) H2S + SO2 ® S; H2O
164. a) HNO3 + Ni0 ® N2O; Ni2+
б) SO2 + Br2 + H2O ® HBr; H2SO4
165. a) K2Cr2O7 + Na3AsO3 + H2SO4 ® AsO43-; Cr3+
б) KCrO2 + Cl2 + KOH ® CrO42-; Cl-
166. a) SO2 + NaClO3 + H2O ® SO42-; Cl-
б) K2Cr2O7 + HCl ® Cr3+; Cl2
167. a) KMnO4 + H2S + H2SO4 ® Mn2+; SO42-
б) J2 + Cl2 + H2O ® JO3-; Cl-
168. SnCl2 + KBrO3 + HCl ® Sn4+; Br-
б) KClO3 + KCrO2 + NaOH ® CrO42-; Cl-
169. Ni(OH)2 + NaClO + H2O ® Ni(OH)3; Cl-
б) KMnO4 + Na2SO3 + H2O ® MnO2; SO42-
170. a) MnSO4 + PbO2 + H2SO4 ® Pb2+; MnO4-
б) FeCl2 + KMnO4 + H2SO4 ® Fe+3; Mn+2
171. a) H3PO3 + KMnO4 + H2SO4 ® Mn+2; H3PO4
б) MnO2 + KClO2 + KOH ® MnO42-; Cl-
172. a) KMnO4 + NaNO2 + H2O ® NO3-; MnO2
б) S + HNO3 ® SO2; NO
173. a)H2S + K2Cr2O7 + H2SO4 ® S; Cr+3
б) KNO3 + Zn + KOH ® ZnO22-; NH3
174. a) Cr2O3 + KClO3 + KOH ® CrO42-; Cl-
б) FeCl2 + HNO3 + HCl ® Fe+3; N2O
175. a) KClO3 + MnO2 + KOH ® MnO42-; Cl-
б) Na3AsO3 + J2 + H2O ® AsO43-; J-
176. a) H2S + HNO3 ® SO42-; Cl-
б) J2 + Na2SO3 + H2O ® J-; SO42-
177. a) C + HNO3 ® CO2; NO2
б) H2S + Cl2 + H2O ® SO42-; Cl-
178. a) SnCl2 + Na3AsO3 + HCl ® As; Sn+4
б) KNO3 + Zn + NaOH ® ZnO22-; NH3
179. a) Cr2O3 + KClO3 + KOH ® CrO42-; Cl-
б) KMnO4 + Na2SO3 + H2SO4 ® Mn+2; SO42-
180. a) Mn(NO3)2 + NaBiO3 + HNO3 ® Bi+3; MnO4-
б) H2S + Br2 + H2O ® SO42-; Br-
5.2 гальванические элементы
Гальваническими элементами называют устройства, в которых энергия окислительно-восстановительных реакций преобразуется в электрическую энергию. В медно-цинковом гальваническом элементе электродвижущая сила (ЭДС) возникает за счёт разности потенциалов меди и цинка, опущенных в растворы своих солей: соответственно CuSO4 и ZnSO4. Если концентрации растворов составляют 1 моль/л, то расчет эдс производят следующим образом. Составляют схему гальванического элемента:
Zn │ZnSO4 ││ CuSO4 │Cu
Затем выписывают из таблицы стандартных электродных потенциалов значения потенциалов меди и цинка, соответственно
EoZn2+/Zn = -0,76 B ()
EoCu2+/Cu = +0,34 B ()
ЭДС можно рассчитать как разность потенциалов медного и цинкового электродов: ЭДС = Еox - Еred. Определяют окислитель и восстановитель, сравнивая значения потенциалов. Потенциал у цинка отрицательнее, следовательно, цинковый электрод будет играть роль восстановителя:
(-) Zn0 -2ē ® Zn2+ процесс окисления
и цинк будет отрицательным полюсом (анодом) в данном гальваническом элементе. Потенциал меди положительнее, поэтому медный электрод будет положительным полюсом (катодом), а процесс будет таким:
(+) Cu2+ + 2ē ® Cu0 процесс восстановления.
Направление движения электронов будет от цинка к меди (показано мостиком со стрелкой на электрохимической схеме гальванического элемента. ЭДС = +0,34 – (-0,78) = 1,1 В
Концентрационный гальванический элемент.
В таком элементе оба электрода из одного металла, но растворы солей, в которые погружены электроды, различной концентрации. Поэтому необходимо рассчитать потенциалы по уравнению Нернста:
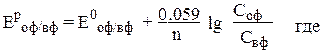
оф – окисленная форма элемента в потенциалопределяющей реакции,
вф – восстановленная форма элемента в этой реакции,
С – молярные концентрации соответствующих веществ,
n – количество электронов, перешедших от восстановителя к окислителю.
Пример 1. Рассчитать эдс гальванического элемента, состоящего из никелевых электродов, опущенных в растворы сульфата никеля с концентрацией 10-4 моль/л и 1 моль/л соответственно.
Решение:
Схема гальванического элемента:
Ni ½NiSO4, 0,0001 M ½½ NiSO4 1 M½Ni
Eo 2H+/H2 = -0,25 B
Определяем потенциал никеля по уравнению Нернста:
E Ni2+/Ni = Eo Ni2+/Ni + 0,059/2 lgCNi2+ = - 0,25 + 0,059/2lg10-4 = - 0,309 B
Направление движения электронов во внешней цепи от электрода с Е = -0,25 В к электроду с Е = -0,309В.
(-) Ni ½NiSO4, 0,0001 M ½½ NiSO4,1 M½Ni (+)
Уравнения электродных процессов:
(-) Ni0 -2ē → Ni2+ (процесс окисления)
(+) Ni2+ + 2ē → Ni0 (процесс восстановления)
Значение эдс составляет:
эдс = Еox - Еred = -0,25 – (-0,309) = 0,059 В.
Задания к подразделу 5.2
Для предложенных гальванических элементов рассчитайте электродные потенциалы и ЭДС. Если концентрация раствора не указана, потенциал считается стандартным из таблицы 1. Напишите уравнения анодного и катодного процессов, молекулярное уравнение токообразующей реакции, составьте схему и укажите направления движения электронов и ионов.
| Al ½Al2(SO4)3, 0,005 M ½½NiSO4, 0,01 M½ Ni | |
| Ni ½NiSO4, 0,1 M ½½H2SO4 ½H2(Pt) | |
| Sn ½SnSO4 ½½Cr2(SO4)3, 0,05 M ½Cr | |
| (Pt) H2 ½H2SO4 ½½Al2(SO4)3, 0,005 M½Al | |
| Cu ½CuSO4, 0,1 M ½½H2SO4½H2(Pt) | |
| Ag ½AgNO3, 0,01 M ½½H2SO4½H2(Pt) | |
| Co ½CoSO4, 0,01 M ½½CoSO4½Co | |
| Zn ½ZnSO4, 0,1 M ½½FeSO4, 0,01 M½Fe | |
| Ag ½AgNO3, 0,01 M ½½Zn(NO3)2½Zn | |
| (Pt) H2 ½ H2SO4½½ ZnSO4, 0,01 M½Zn | |
| Cd ½ Cd(NO3)2, 0,1 M ½½ Cd(NO3)2, 0,001 M½Cd | |
| Ni ½ NiSO4, 0,001 M ½½ NiSO4½Ni | |
| Fe ½ FeSO4 ½½ FeSO4, 0,01 M½Fe | |
| Cr ½ Cr2(SO4)3, 0,005 M ½½ ZnSO4½ Zn | |
| Zn ½ Zn(NO3)2, 0,001 M ½½ Zn(NO3)2½ Zn | |
| Ag ½ AgNO3 ½½ Cr(NO3)3, 0,005 M ½Cr | |
| Cd ½CdCl2, 0,1 M ½½ CuCl2, 0,1 M ½Cu | |
| Ti ½ Ti2(SO4)3, 0,5 M ½½CuSO4½Cu | |
| Sn ½SnSO4, 0,01 M ½½ Fe2(SO4)3½Fe | |
| Ag ½ AgNO3, 0,0001 M ½½ Pb(NO3)2, 0,1 M ½Pb |
5.3 Электрохимическая коррозия металлов
Коррозией металлов называют самопроизвольное разрушение металлов под действием различных окислителей из окружающей среды.
Механизм электрохимической коррозии аналогичен механизму процессов в короткозамкнутых гальванических элементах, в которых на участках с более отрицательным потенциалом идёт процесс окисления (разрушения металла), а на участках с более положительным потенциалом процесс восстановления окислителя (коррозионной среды).
Наиболее часто встречаются окислители:
- ионы водорода (коррозия с водородной деполяризацией)
2H+ + 2ē → H2 (кислой среде)
2H2O + 2ē → H2 + 2OH- (в нейтральной и щелочной среде)
- молекулы кислорода
O2 + 4ē +4H+ → 2H2O (в кислой среде)
O2 + 4ē + 2H2O → 4OH- (в нейтральной и щелочной среде)
Пример 1. Гальванопара алюминий – железо в воде (среда нейтральная). Учитываем, что в воде есть растворенный кислород.
Схема гальванопары:
Al ½H2O, O2 ½Fe
Выписываем потенциалы алюминия и железа из таблицы потенциалов:
EoAl3+/Al = -1,88 В EoFe(OH)2/Fe = -0,46 В
восстановитель - Al; окислитель – O2
4 (-) Al0 – 3ē → Al3+ - процесс окисления
3 (+) O2 + 4ē + 2H2O → 4OH- - процесс восстановления
4Al + 3O2 + 6H2O = 4Al(OH)3
Направление движения электронов от участка с меньшим потенциалом к участку с большим потенциалом. Подвергаться коррозии будет в первую очередь алюминий.
Пример 2. Определить процессы, протекающие при коррозии луженого железа в кислой среде.
Решение:
Схема гальванопары:
Fe ½H+ ½Sn
Потенциалы: EoFe2+/Fe =-0,44 В, EoSn2+/Fe = -0,136 В, Eo2H+/H2 = 0 В
Восстановитель – Fe; окислитель - H+
Fe (-) Fe0 – 2ē ® Fe2+ - процесс окисления
Sn (+) 2H+ + 2ē ® H2 - процесс восстановления
Fe + 2H+ ® Fe2+ + H2
Электроны движутся от участка с меньшим потенциалом к участку с большим потенциалом, т.е. от Fe к Sn.
Задания к подразделу 5.3
Рассмотрите коррозию гальванопары, используя потенциалы из таблицы 1, укажите анод и катод соответствующей гальванопары в различной коррозионной среде, напишите уравнения электродных процессов, молекулярное уравнение реакции коррозии, укажите направление перемещения электронов в системе.
| Номер задания | Коррозионная среда | ||
| а) H2O + O2 | б) NaOH + H2O | в) H2O + H+ | |
| Fe ½Zn | Zn ½Al | Pb ½Zn | |
| Fe ½Ni | Fe½Zn | Al ½Cu | |
| Pb ½Fe | Cd ½Cr | Al ½Ni | |
| Cu ½Zn | Al ½Cu | Sn ½Cu | |
| Zn ½Fe | Fe ½Cr | Co ½Al | |
| Zn ½Al | Pb ½Zn | Cr ½Ni | |
| Cr ½Cu | Pb ½Cr | Bi ½Ni | |
| Cu ½Al | Cr ½Zn | Fe ½Mg | |
| Zn ½Sn | Mg ½Cd | Cr ½Bi | |
| Co ½Mg | Zn ½Fe | Pb ½Al | |
| Pb ½Zn | Bi ½Ni | Cd ½Al | |
| Bi ½Ni | Cu ½Zn | Fe ½Ni | |
| Fe ½Mg | Co ½Sn | Ni ½Mn | |
| Sn ½Fe | Pb ½Zn | Cr ½Fe | |
| Cr ½Fe | Fe ½Mg | Co ½Cu | |
| Fe ½Cr | Ce ½Cu | Fe ½Cu | |
| Cr ½Cu | Cd½Zn | Zn ½Cu | |
| Cd½Zn | Ce ½Ni | Cr½Cd | |
| Mg ½Cu | Cr ½Cd | Zn ½Al | |
| Sn ½Cu | Bi ½Ni | Pb ½Cr | |
5.4 Электролиз растворов
Электролизом называется процесс, протекающий на электродах при пропускании через раствор или расплав электролита постоянного электрического тока. Электрод, на котором происходит восстановление, называется катодом. Он соединен с отрицательным полюсом источника постоянного тока. Электрод, на котором происходит окисление, называется анодом. Он соединен с положительным полюсом источника постоянного тока.
При электролизе водных растворов протекают процессы, связанные с электролизом воды.
Катодные процессы
На катоде возможно восстановление
- катионов металла Men+ + nē ® Me0
- катиона водорода (свободного или в составе молекул воды)
2H+ + 2ē ® H2 (в кислой среде)
2H2O + 2ē ® H2 + 2OH- (в нейтральной и щелочной среде)
Для выбора приоритетного процесса необходимо сравнить стандартные электродные потенциалы металла и водорода. Потенциал восстановления водорода следует использовать с учётом его перенапряжения Eo2H2О/H2 =1,0 В. Все металлы при электролизе водных растворов можно разделить на 3 группы:
1. активные металлы (Li - Al) на катоде не осаждаются, вместо них идёт восстановление ионов водорода:
2H2O + 2ē ® H2 + 2OH-
2. металлы средней активности (Mn; Zn; Fe; Sn) могут осаждаться на катоде с одновременным выделением водорода.
3. неактивные металлы (Ag; Cu; Au) из-за высокой окислительной способности их катионов осаждаются на катоде без выделения водорода:
Ag+ + 1ē ® Ag0
Aнодные процессы
На аноде возможны процессы окисления:
- материала анода: Me0 – nē ® Men+
- анионов солей: 2Cl- - 2ē ® Cl2
- молекул воды: 2H2O – 4ē ® O2 + 4H+
Анионы кислородсодержащих кислот, имеющие в своём составе атом элемента в высшей степени окисления (SO42-; NO3-; PO43- и др.) при электролизе на аноде не разряжаются.
С учетом перенапряжения величину потенциала кислорода нужно считать равной +1,8 В.
Пример 1. Электролиз водного раствора сульфата натрия с инертными электродами: Na2SO4 = 2Na+ + SO42-
| (-) катод Na+; H2O | (+) анод SO42-; H2O |
| EoNa+/Na = -2,71 В | EoO2/2H2O =1,8 В |
| Eo2H2О/H2 = -1,0 В | |
| Так как EoNa+/Na < Eo2H2О/H2, то происходит восстановление воды | 2H2O – 4ē ® O2 + 4H+ |
| 2H2O + 2ē ® H2 + 2OH- | |
| Na+ + OH- = NaOH | 2H+ + SO42- = H2SO4 |
| Среда щелочная | Среда кислая |
Пример 2. Электролиз водного раствора хлорида олова с инертными электродами
| (-) катод Sn; H2O | (+) анод Cl-; H2O |
| EoSn2+/Sn = -0,136 В | EoCl2/2Cl- =1,36 В |
| Eo2H2О/H2 = -1,0 В | EoO2/2H2O = 1,8 B |
| Так как EoSn2+/Sn > Eo2H2О/H2 идет процесс восстановления катионов олова | Так как EoCl2/2Cl- < EoO2/2H2O, идёт процесс окисления ионов хлора |
| Sn2+ + 2ē ® Sn0 | 2Cl- - 2ē ® Cl2 |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|