
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Катионы (мэкв/л) 4 страница
При поступлении в кровь ионов H+ (т.е. кислоты) ионы бикарбоната натрия взаимодействуют с ней и образуется угольная кислота:
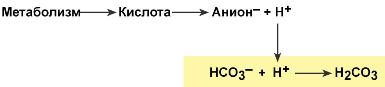
При работе бикарбонатной системы концентрация водородных ионов понижается, т.к. угольная кислота является очень слабой кислотой и плохо диссоциирует. При этом в крови не происходит параллельного значимого увеличения концентрации НСО3
Если в кровь поступают вещества с щелочными свойствами, то они реагируют с угольной кислотой и образуют ионы бикарбоната:
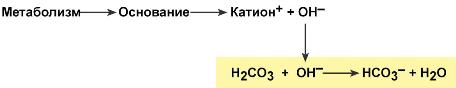
Работа бикарбонатного буфера неразрывно связана с дыхательной системой (с вентиляцией легких). В легочных артериях благодаря присутствию в эритроцитах фермента карбоангидразы, угольная кислота быстро расщепляется с образованием CO2, удаляемого с выдыхаемым воздухом:
Н2СО3→ Н2О + СО2↑
Кроме эритроцитов, значительная активность карбоангидразы отмечена в эпителии почечных канальцев, клетках слизистой оболочки желудка, коре надпочечников и клетках печени, в незначительных количествах – в центральной нервной системе, поджелудочной железе и других органах.
Гемоглобиновая буферная система
Высокой мощностью в крови обладает гемоглобиновый буфер, на него приходится до 28% всей буферной емкости крови. В качестве кислой части буфера выступает оксигенированный гемоглобин H‑HbO2. Он имеет выраженные кислотные свойства и в 80 раз легче отдает ионы водорода, чем восстановленный Н‑Нb, выступающий как основание. Гемоглобиновый буфер можно рассматривать как часть белкового, но его особенностью является работа в тесном контакте с бикарбонатной системой.
Изменение кислотности гемоглобина происходит в тканях и в легких и вызывается связыванием соответственно H+ или О2. Непосредственный механизм заключается в присоединении или отдаче иона H+ остатком гистидина в глобиновой части молекулы (см эффект Бора).
В тканях более кислый pH является результатом накопления минеральных (угольной, серной,соляной) и органических кислот (молочной). Ионы H+ присоединяются к пришедшему оксигемоглобину (HbО2) и превращают его в H‑HbО2. Это моментально вызывает отдачу оксигемоглобином кислорода (эффект Бора) и он превращается в восстановленный H‑Hb.
НbO2+ Н+ → [H-HbO2] → Н-Hb + O2
В результате снижается количество Н2СО3, продуцируются ионы НСО3‑ и тканевое пространство подщелачивается.
В легкихпосле удаления СО2 (угольной кислоты) происходит защелачивание крови. При этом присоединение О2 к дезоксигемоглобину H-Hb образует кислоту более сильную, чем угольная. Она отдает свои ионы Н+ в среду, предотвращая повышение рН:
Н-Hb + O2 → [H-HbO2] → НbO2 + Н+
Работу гемоглобинового буфера обычно рассматривают в связи с бикарбонатныым буфером:
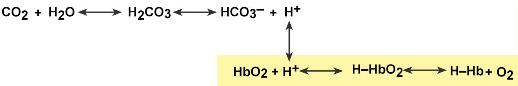
Эффективность гемоглобинового буфера напрямую зависит от активности дыхательной системы (Газобмен в легких и тканях).
Длительная стабилизация сдвигов рН
Медленная компенсация сдвигов величины pH обеспечивается физиологическими системами - регулируемо через легкие и почки, пассивно при участии костной ткани и печени.
Удаление кислоты через легкие
Газообмен в легких заключается в постоянном обмене кислородом и углекислым газом между двумя соприкасающимися компартментами – легочными альвеолами и кровеносными капиллярами. (см также Обмен кислорода и углекислого газа в легких)
Углекислый газ быстро диффундирует из плазмы и эритроцитов в альвеолярное пространство. В то же время в альвеолярном воздухе имеется высокая концентрация кислорода, который, проникая в эритроциты, вытесняет СО2 из комплекса с гемоглобином с образованием оксигемоглобина – более сильной кислоты, чем угольная. "Кислый" оксигемоглобин отдает ионы Н+ в ассоциацию с ионом HCO3–, образуется H2CO3, которая вступает в карбоангидразную реакцию с появлением СО2, удаляемого в плазму и далее в альвеолы.
Легочная вентиляция обеспечивает удаление H2CO3 и повышение уровня pH. Она эффективна только в тесном контакте с гемоглобиновой и бикарбонатной буферной системами.
Главным фактором для активации дыхательной системы является концентрацияионов Н+, влияющих на рецепторы в каротидных тельцах. Закисление крови уже через 1‑2 минуты вызывает стимуляцию дыхательного центра, повышая его активность в 4‑5 раз. Снижение кислотности крови понижает активность дыхательного центра в 2‑4 раза.
Чувствительные хеморецепторы для CO2 находятся в продолговатом мозге, аортальном и каротидных тельцах.
Сдвиги концентрации O2в крови не являются существенными для изменения легочной вентиляции. Но в случае хронической гиперкапнии (увеличении CO2) рецепторы дыхательного центра теряют чувствительность к CO2 (десенсибилизация) и низкое pO2 становится основным стимулом. Также избирательное снижение кислорода в артериальной крови на 40% от нормы стимулирует активность дыхательного центра.
Удаление кислоты через почки
Почки играют ведущую роль в регуляции уровня рН плазмы крови. Движущей силой в почечных влияниях на уровень pH являются потоки ионов Na+. Ионы Na+ перемещаются внутрь клеток по концентрационному градиенту, который создается при работе фермента Na+/К+‑АТФазы на базолатеральной мембране. Движение ионов Na+ внутрь клетки приводит к выходу через Na+/H+‑обменник в просвет канальца ионов H+.
Благодаря почкам регулируется концентрация ионов HCO3‑ в плазме крови и ионы Н+ удаляются в мочу. Благодаря работе почек рН мочи в состоянии снижаться до 4,5-5,2. Здесь активно протекают три процесса, связанных с уборкой кислых эквивалентов:
1. Реабсорбция бикарбонатных ионов HCO3-.
2. Ацидогенез – удаление ионов Н+ с титруемыми кислотами (в основном в составе дигидрофосфатов NaH+PO4).
3. Аммониегенез – удаление ионов Н+ в составе ионов аммония NH4+.
Реабсорбция бикарбонат-ионов
Ионы HCO3–, находящиеся в плазме крови, непрерывно фильтруются и оказываются в первичной моче. Одновременно в канальцевую жидкость при участии Na+/H+‑обменника из эпителиоцитов активно выводятся ионы H+ в обмен на ионы Na+.
Секретируемые ионы Н+ и ионы HCO3–, находящиеся в первичной моче, ассоциируют до угольной кислоты Н2СО3, которая распадается на СО2 и H2O. Используя возникающий градиент концентрации между просветом канальцев и цитозолем эпителиоцитов, СО2 диффундирует в клетки. Внутриклеточная карбоангидраза направляет входящий СО2 для образования угольной кислоты. После диссоциации кислоты ионы НСО3– выносятся в кровь, подщелачивая ее, ионы Н+ секретируются обратно в мочу. В итоге происходит обратное всасывание ионов НСО3–, при этом каждый добавляемый в плазму НСО3– соответствует экскреции одного иона Н+.
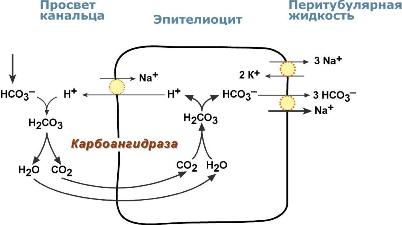
Реабсорбция бикарбонат-ионов
Пороговое значение реабсорбции бикарбонатов соответствует их нормальной концентрации в крови. Это значит, что при превышении нормального уровня бикарбонаты не будут реабсорбироваться и окажутся в моче.
В проксимальных канальцах реабсорбируется 80% профильтрованного НСО3–. В целом в почечных канальцах происходит реабсорбция более 99% от фильтруемого бикарбонат-иона.
Ацидогенез
Ацидогенез заключается во взаимодействии ионов H+, секретируемых из эпителиоцитов, с анионами HРO42–. В результате в первичной моче образуется дигидрофосфат H2РO4–.
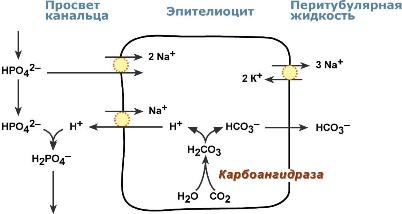
Реакции ацидогенеза
В процессе ацидогенеза в сутки выделяется 10-30 ммоль кислотных веществ, названных титруемыми кислотами. Фосфаты, являясь одной из этих кислот, играют роль буферной системы в моче. Роль ее состоит в экскреции кислых эквивалентов без потерь бикарбонат-ионов за счет дополнительного иона H+ в составе выводимого H2РO4– (по сравнению с HCO3):
HРO42– + Н2СО3 → H2РO4– + НСО3
Бикарбонат натрия в почечных канальцах реабсорбируется, а кислотно-основная реакция мочи зависит только от содержания дигидрофосфата. Хотя в крови соотношение HРO42–/ H2РO4– равно 4:1, начиная от клубочкового фильтрата к дистальным канальцам оно может достигать 50-кратного перевеса доли ионов H2РO4– (1:50).
Аммониегенез
Глутамин и глутаминовая кислота, попадая в клетки канальцев, быстро дезаминируются глутаминазой и глутаматдегидрогеназой с образованием аммиака. Являясь гидрофобным соединением, аммиак диффундирует в просвет канальца и связывает экскретируемые ионы Н+ с образованием иона NH4+ , который удаляется с мочой.
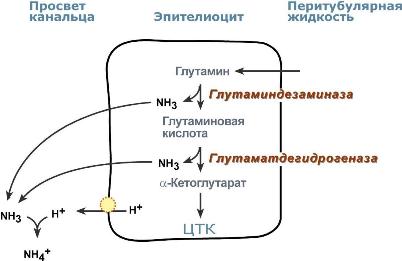
Реакции аммониегенеза
Аммониегенез происходит на протяжении всего почечного канальца, но более активно идет в дистальных отделах – дистальных канальцах и собирательных трубочках коркового и мозгового слоев. В этих сегментах секреция ионов Н+ происходит активно с участием Н+‑АТФазы, локализованной на апикальной мембране эпителиоцита.
Влияние костной ткани
Это наиболее медленнореагирующая система. Механизм ее участия в регуляции рН крови состоит в возможности обмениваться с плазмой крови ионами Са2+и Na+в обмен на протоны Н+. Происходит растворение гидроксиапатитных кальциевых солей костного матрикса, освобождение ионов Са2+ и HPO42–. В дальнейшем ионы HPO42– попадут в мочу и свяжутся с Н+ с образованием дигидрофосфата (ацидогенез), который и уходит с мочой.
8Н+ + Ca10(PO4)6(OH)2 → 2H2O + 10Ca2+ + 6HPO42–
Параллельно при снижении рН (закисление) происходит поступление ионов H+ внутрь остеоцитов, а ионов K+ – наружу.
Роль печени
Существенную, но пассивнуюроль в регуляции кислотно-основного состояния крови берет на себя печень, в которой происходит метаболизм низкомолекулярных органических кислот (молочная кислота и др). Кроме этого, кислые и щелочные эквиваленты выделяются с желчью.
Анионы крови связывают протоны
Буферные основания
Общим показателем, характеризующим КОС, является концентрация буферных оснований (buffer bases, ВВ), включающая сумму всех оснований крови, хотя большую часть этих оснований представляют анионы бикарбоната и белковые анионы.
Более узким показателем является концентрация бикарбонат-ионов. При дыхательных нарушениях количество бикарбонатов мало изменяется, т.к. угольная кислота, образуемая из CO2, очень плохо диссоциирует и изменение ее концентрации не влияет на содержание иона HCO3‑. Но, например, при накоплении в крови метаболических кислот (молочной кислоты) ион HCO3‑ будет активно расходоваться на их буферизацию, показатель снизится.
На практике главным и наиболее информативным показателем служит избыток буферных оснований (base excess, BE). Изменение величины BE отражает степень использования буферных оснований для удержания гомеостаза при смещении уровня ионов H+. При алкалозе использование буферных оснований не требуется, показатель возрастает. При закислении среды основания расходуются и показатель BE снижается, т.е. возникает дефицит оснований.
Остаточные анионы
Если посчитать сумму всех ионных зарядов в плазме крови, будет обнаружено, что количество положительных зарядов равно количеству отрицательных зарядов.
Катионы (мэкв/л)
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|