
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Катионы (мэкв/л) 3 страница
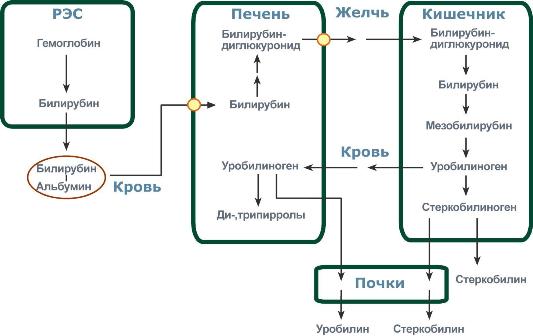
Этапы метаболизма билирубина в организме
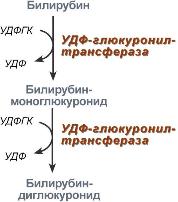
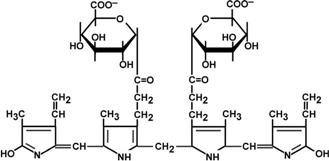
Из сосудистого русла в гепатоциты билирубин попадает с помощью белков-переносчиков. Далее при участии белка лигандина он транспортируется в ЭПР, где протекает реакция связывания билирубина с УДФ-глюкуроновой кислотой, при этом образуются моно- и диглюкурониды. Кроме глюкуроновой кислоты, в реакцию могут вступать сульфаты, фосфаты, глюкозиды. Билирубин-глюкуронид получил название связанный (конъюгированный) или прямой билирубин.
| 
|
| Реакции синтеза билирубин-диглюкуронида | Строение билирубин-диглюкуронида |
После образования билирубин-глюкурониды АТФ-зависимым переносчиком секретируются в желчные протоки и далее в кишечник, где при участии бактериальной β-глюкуронидазы превращаются в свободный билирубин.
Одновременно некоторое количество билирубин-глюкуронидов может попадать (особенно у взрослых) из желчи в кровь по межклеточным щелям.
Таким образом, в плазме крови в норме одновременно существуют две формы билирубина: свободный (непрямой), попадающий сюда из клеток РЭС (около 80% всего количества), и связанный (прямой), попадающий из желчных протоков (до 20%).
Термины "связанный", "конъюгированный", "свободный", "несвязанный" отражают взаимодействие билирубина и глюкуроновой кислоты (но не билирубина и альбумина!).
Термины "прямой" и "непрямой" введены, исходя из возможности химической реакции билирубина с диазореактивом.Эрлиха. Связанный билирубин реагирует с реактивом напрямую, без добавления дополнительных реагентов, т.к. является водорастворимым. Несвязанный (жирорастворимый) билирубин требует добавочных реактивов, реагирует не прямо.
Превращение в кишечнике
В кишечнике билирубин подвергается восстановлению под действием микрофлоры до мезобилирубина и мезобилиногена (уробилиногена). Часть последних всасывается и с током крови вновь попадает в печень, где окисляется до ди- и трипирролов. При этом в здоровом организме в общий круг кровообращения и в мочу мезобилирубин и уробилиноген не попадают, а полностью задерживаются гепатоцитами. Оставшаяся в кишечнике часть пигментов ферментами бактериальной флоры толстого кишечника восстанавливается до стеркобилиногена и выделяется из организма, окрашивая кал. Незначительное количество стеркобилиногена через геморроидальные вены попадает в большой круг кровообращения, отсюда в почки и выделяется с мочой. На воздухе стеркобилиноген и уробилиноген превращаются, соответственно, в стеркобилин и уробилин.
Токсичность билирубина состоит в его липофильности
Ситуации, при которых в крови накапливается билирубин, в зависимости от причины делятся на три вида:
1. Гемолитические – в результате гемолиза при избыточном превращении гемоглобина в билирубин,
2. Печеночно-клеточные – когда печень не в состоянии обезвредить билирубин,
3. Механические – если билирубин не может попасть из печени в кишечник из-за механического перекрытия желчевыводящих путей.
Так как в норме билирубин и его фракции находятся в крови в концентрации не более 20 мкмоль/л, то накопление билирубина в крови свыше 43 мкмоль/л ведет к связыванию его эластическими волокнами кожи и конъюнктивы, что проявляется в виде желтухи. Поскольку свободный билирубин липофилен, то он легко накапливается в подкожном жире и нервной ткани. Последнее очень опасно для детей, особенно для новорожденнных.
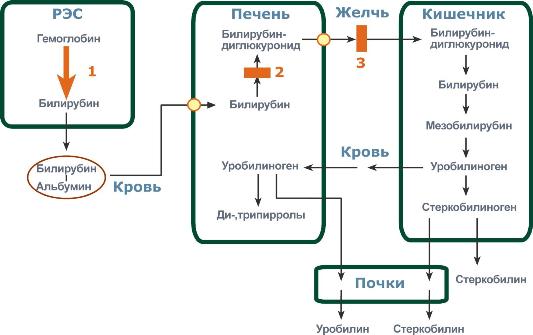
Причины основных нарушений обмена билирубина
Гемолитическая желтуха
Гемолитическаяили надпеченочнаяжелтуха – ускоренное образование билирубина в результате усиления внутрисосудистого гемолиза любого происхождения (сепсис, лучевое поражение, несовместимость крови, дефект глюкозо-6-фосфатдегидрогеназы). У новорожденных гемолитическая желтуха может развиться как симптом гемолитической болезни новорожденного. В данном случае гипербилирубинемияразвивается за счет фракции непрямого билирубина.
Гепатоциты усиленно переводят непрямой билирубин в связанную форму, секретируют его в желчь, в результате в кале увеличивается содержание стеркобилина, интенсивно его окрашивая. В моче возрастает содержание уробилина, билирубин отсутствует.
Механическая желтуха
Механическая или подпеченочнаяжелтуха развивается вследствие снижения оттока желчи при непроходимости желчного протока (закупорка желчного протока опухолями, желчными камнями). При этом происходит растяжение желчных капилляров, увеличивается проницаемость их стенок и не имеющий оттока в кишечник прямой билирубин поступает в кровь, развивается гипербилирубинемия.
В моче резко увеличен уровень билирубина(цвет темного пива) и снижено количество уробилина, практически отсутствует стеркобилинкала (серовато-белое окрашивание).
Паренхиматозная желтуха
Паренхиматозная(печеночно-клеточная) желтуха – причиной может быть нарушение на всех трех стадиях превращения билирубина в печени: извлечение билирубина из крови печеночными клетками, его конъюгирование и секреция в желчь. Наблюдается при различных формах гепатитов (вирусные, токсические) и иных поражениях печени.
Гипербилирубинемия развивается за счет обеих фракций. Их концентрация возрастает из-за одновременного нарушения секреции в желчь и увеличения проницаемости мембран клеток печени.
В моче определяется билирубин(цвет крепкого черного чая), умеренно увеличена концентрация уробилина, уровень стеркобилина кала в норме или снижен.
У младенцев вариантами паренхиматозной желтухи являются желтухи новорожденных и недоношенных: физиологическая желтуха, желтуха, вызываемая молоком матери и т.п.. Наследственные желтухи печеночного происхождения представляют собой синдромы Жильбера-Мейленграхта, Дубина-Джонсона, Криглера-Найяра.
Желтухи часто встречаются у новорожденных
Гемолитическая болезнь новорожденного
Причины
Несовместимость крови матери и плода по группе или по резус-фактору. Накопление гидрофобной формы билирубина в подкожном жире обуславливает желтушность кожи. Однако реальную опасность представляет накопление билирубина в сером веществе нервной ткани и ядрах ствола с развитием "ядерной желтухи" (билирубиновая энцефалопатия).
Клиническая диагностика
Проявляется сонливостью, плохим сосанием, умственной отсталостью, ригидностью затылочных мышц, тоническими судорогами, тремором конечностей, изменением рефлексов с возможным развитием глухоты и параличей.
Лабораторная диагностика
В крови выявляются выраженная анемия, ретикулоцитоз, эритро- и нормобластоз. Гипербилирубинемия за счет непрямой (свободной) фракции от 100 до 342 мкмоль/л, в дальнейшем присоединяется и прямая фракция. Уровень билирубина в крови быстро нарастает и к 3-5 дню жизни достигает максимума.
Основы лечения
· переливание крови,
· фенобарбитал, который стимулирует в гепатоцитах увеличение активности УДФ-глюкуронилтрансферазы и цитохрома Р450,
· аскорбиновая кислота.
Физиологическая (транзиторная) желтуха новорожденных
Причины
· относительное снижение активности УДФ-глюкуронилтрансферазы в первые дни жизни, связанное с повышенным распадом фетального гемоглобина,
· абсолютное снижение активности УДФ-глюкуронилтрансферазы в первые дни жизни (несинтез фермента),
· дефицит лигандина,
· слабая активность желчевыводящих путей.
Клиническая диагностика
· окрашивание кожи на 3-4 день после рождения,
· гемолиза и анемии нет.
Симптомы исчезают спустя1-2 недели после рождения.
Лабораторная диагностика
Увеличение концентрации свободного (непрямого) билирубина в сыворотке до 140-240 мкмоль/л.
Основы лечения
· фенобарбитал, который стимулирует в гепатоцитах увеличение активности УДФ-глюкуронилтрансферазы и цитохрома Р450,
· аскорбиновая кислота, глюкоза,
· желчегонные средства.
Желтуха недоношенных
Причины
· относительное снижение активностиУДФ-глюкуронилтрансферазы в первые дни жизни, связанное с повышенным распадом фетального гемоглобина,
· абсолютное снижение активностиУДФ-глюкуронилтрансферазы в первые дни жизни (несинтез фермента),
· дефицит лигандина,
· слабая активность желчевыводящих путей.
Клиническая диагностика
· окрашивание кожи,
· гемолиза и анемии нет.
Исчезает спустя3-4 недели после рождения.
Лабораторная диагностика
Увеличение концентрации свободного (непрямого) билирубина в сыворотке до максимума на 5-6 дни после рождения, более выражено по сравнению с физиологической желтухой.
Основы лечения
· фенобарбитал, который стимулирует в гепатоцитах увеличение активности УДФ-глюкуронилтрансферазы и цитохрома Р450,
· аскорбиновая кислота, глюкоза,
· желчегонные средства,
· фототерапия - под влиянием света происходит образование "люмирубина" - изомерной формы билирубина, легко выводимой с мочой и желчью.
Негемолитическая гипербилирубинемия новорожденных, вызываемая молоком матери
Встречается у 1% вскармливаемых грудью новорожденных.
Причины
Подавление активности УДФ-глюкуронилтрансферазы, предположительно, эстрогенами материнского молока.
Клиническая диагностика
Проявляется желтухой, иногда с явлениями поражения ЦНС.
Лабораторная диагностика
Увеличение концентрации свободного (непрямого) билирубина в сыворотке.
Встречаются наследственные печеночные желтухи
Синдром Жильбера-Мейленграхта
Причины
К причинам заболевания относятся аутосомно-доминантное нарушение элиминации билирубина из плазмы крови, понижение активности УДФ-глюкуронилтрансферазы.
Клиническая диагностика
Выявляется в юношеском возрасте и продолжается в течение многих лет, обычно всю жизнь. Наблюдается у 2-5% населения, мужчины страдают чаще женщин (соотношение 10:1).
· иктеричность склер (от лат. icterus - желтый),
· желтушное окрашивание кожи (только у отдельных больных), особенно лица, иногда наблюдается частичное окрашивание ладоней, стоп, подмышечных областей, носогубного треугольника.
· диспепсические жалобы отмечаются в 50% случаев, выражаются в тошноте, отсутствии аппетита, отрыжке, нарушении стула (запор или понос), метеоризме.
Лабораторная диагностика
Периодическое повышение содержание свободного (непрямого) билирубина плазмы, вызванное с провоцирующими факторами.
Синдром Дубина-Джонсона
Причины
Аутосомно-доминантная недостаточность выведения конъюгированного билирубина из гепатоцитов в желчные протоки.
Клиническая диагностика
Болезнь протекает длительно, с периодическими обострениями. Встречается чаще у мужчин, выявляется в молодом возрасте, реже после рождения. Характерны повышенная утомляемость, плохой аппетит, боли в правом подреберье, поносы, желтуха, сопровождающаяся кожным зудом. Иногда встречается увеличенная печень и селезенка.
Лабораторная диагностика
Увеличение содержания свободного (непрямого) и связанного (прямого) билирубина в плазме. Характерны билирубинурия, понижение содержания уробилина в кале и моче.
Основы лечения
Не разработано.
Синдром Криглера-Найяра
Тип I
Причины
Полное отсутствие активности УДФ-глюкуронилтрансферазы вследствие аутосомно-рецессивного генетического дефекта.
Клиническая диагностика
Симптомы поражения нервной системы: повышение мышечного тонуса, нистагм, опистотонус, атетоз, тонические и клонические судороги. Дети отстают в психическом и физическом развитии. Развитие ядерной желтухи и гибель ребенка.
Лабораторная диагностика
Гипербилирубинемия появляется в первые дни (часы) после рождения. Характерна интенсивная желтуха, в большинстве случаев сопровождающаяся ядерной желтухой. Непрерывное возрастание содержания свободного билирубина в плазме до 200-800 мкмоль/л (в 15-50 раз выше нормы). Отсутствие конъюгированного билирубина в желчи.
Основы лечения
· ограничение физических и нервных нагрузок,
· применяют фототерапию с использованием лампы дневного света или прямого солнечного света, что превращает билирубин в хорошо растворимый люмирубин,
· внутривенно вливают растворы альбумина,
· производят заменные переливания крови.
Тип II
Причины
При синдроме Криглера-Найяра II типа отмечается аутосомно-рецессивный тип наследования. Генетически обусловленное снижение активности УДФ-глюкуронилтрансферазы.
Клиническая диагностика
Желтуха менее интенсивна.
Лабораторная диагностика
Содержание непрямого билирубина в крови в 5-20 раз выше нормы. В желчи есть билирубинглюкуронид.
Основы лечения
· ограничение физических и нервных нагрузок,
· использование препаратов, индуцирующих активность глюкуронилтрансферазы – фенобарбитал, зиксорин.
Ацидозы и алкалозы
Величина рН формирует активность клеток
Кислотно-основное равновесие представляет собой активность физиологических и физико-химических процессов, составляющих функционально единую систему стабилизации концентрации ионов Н+.
Основной количественной характеристикой кислотности водных растворов. является водородный показатель (рН) – отрицательный десятичный логарифм концентрации водородных ионов в растворе, т.е. зависимость pH и [H+] не линейная!
pH=-lg [H+]).
Установленный диапазон концентраций ионов Н+, совместимый с жизнью 16-160 нмоль/л, что соответствует рН 6,8-7,8. В среднем в плазме крови концентрация ионов водорода [Н+] = 40 нмоль/л, нормальный диапазон рН 7,35-7,45.
Сдвиги концентрации ионов Н+ приводят к изменению активности внутриклеточных ферментов даже в пределах физиологических значений. Например, ферменты глюконеогенеза более активны при закислении цитоплазмы гепатоцитов кетоновыми телами или молочной кислотой, что имеет значение при голодании и физической нагрузке.
Закисление саркоплазмы в мышечной клетке при работе подавляет активность фермента 3-й реакции гликолиза фосфофруктокиназы и останавливает сокращение мышцы. Интересной оборотной стороной данного эффекта служит повышенная устойчивость плода и новорожденных к острой гипоксии благодаря наличию особой фосфофруктокиназы, нечувствительной к закислению среды, что позволяет продолжать окисление глюкозы и получать энергию при накоплении лактата.
Роль систем гомеостаза организма – обеспечить неизменность концентрации ионов водорода при жизнедеятельности, что создает условия для:
· сохранения активности ферментативныхи транспортныхбелков,
· неспецифическая защитакожного эпителия;
· отрицательный заряднаружной поверхности мембраны эритроцитов,
· растворимости неорганических и органических молекул (кальция и магния, щавелевой и мочевой кислот),
· формирования электро-химического градиента мембраны митохондрий на должном уровне и наработки АТФ в клетке.
Водородный показатель является главным при оценке кислотно-основного состояния и его значение определяет диагноз ацидоза(снижение pH) или алкалоза (повышение pH).
Источники атомов водорода в организме
1. В реакциях аэробного метаболизма глюкозы, аминокислот и жирных кислот постоянно образуются молекулы CO2. При участии фермента карбоангидразы он реагирует с водой и образует угольную кислоту, слабо диссоциирующую на ион Н+ и бикарбонат-ион НСО3 .
СО2 + Н2О → Н2СО3 → НСО3¯ + Н+
Данный способ продукции протонов характерен почти для всех клеток и протекает при аэробном метаболизме, когда активно идут реакции окислительного декарбоксилирования пирувата и цикл трикарбоновых кислот.
2. Еще одним источником кислотных эквивалентов является анаэробный метаболизм глюкозы, при котором появляется молочная кислота.
Глюкоза → Молочная кислота → Лактат¯ + Н+
Особенно ярко это проявляется при интенсивной мышечной работе. В клинической практике с накоплением молочной кислоты сталкиваются при недостаточном поступлении кислорода в клетки – при любых анемиях, шоке, тромбозах, сердечной и дыхательной недостаточности, повышении вязкости крови, обезвоживании. Также играет роль дефицит железа и меди в составе ферментов дыхательной цепи.
3. Метаболизм серосодержащих аминокислотприводит к появлению метаболических кислот: соляной, серной:
Метионин →Н2SО4 → SО42- + 2Н+
Цистеин → Н2SО4 → SО42- + 2Н+
4. В определенных условиях (голодание, сахарный диабет 1 типа) в кровь поступают кетоновые тела (ацетоуксусная и бета-гидроксимасляная кислоты):
Жирные кислоты → Ацетил-SКоА → Ацетоуксусная кислота → Ацетоацетат¯ + Н+
Жирные кислоты → Ацетил-SКоА → Гидроксимасляная кислота → Гидроксибутират¯ + Н+
5. При отравленияхорганическими соединениями источником ионов Н+ могут служить щавелевая и муравьная кислоты при метаболизме, соответственно, этиленгликоля и метанола
Газы крови влияют на pH
Несмотря на то, что исследование кислотно-основного состояния, строго говоря, подразумевает исследование только величиныpH (концентрации ионов H+), в реальности в него также включается исследование физиологически важных газов, присутствующих в крови – O2 и CO2. Анализ газов показывает эффективность газообмена по величинам парциальных давлений – pO2 и pCO2.
Величина парциального давления – это процентная доля газа в общем объеме.
Газы атмосферного воздуха поступают в кровь диффузно по градиенту концентрации через альвеолярную мембрану. Молекулы O2 поступают из альвеол в кровь, а молекулы CO2 из крови в альвеолы до тех пор пока парциальные давления не выровняются.
Углекислый газ
Концентрация СО2 в альволярном воздухе столь низка, а в крови столь высока, что диффузия этого газа в альвеолы чрезвычайно эффективна и скорость его удаления зависит только от альвеолярной вентиляции – общего объема воздуха, транспортируемого в минуту между альвеолами и атмосферой ("скорости выдувания").
Следовательно, при усиленной вентиляции легких углекислый газ выводится, и показатель pCO2в крови снижается. Это автоматически означает потерю организмом угольной кислоты (ионов H+), что является причиной защелачивания крови – алкалоза, называемого дыхательным или респираторным. Повышение концентрации СО2 в крови свидетельствует о недостаточной альвеолярной вентиляции; то есть, иными словами, повышение в крови показателя рСО2 является причиной дыхательного ацидоза.
Увеличенное pCO2 (гиперкапния) всегда свидетельствует о снижении альвеолярной вентиляции.
Кислород
Вопросы, связанные с оксигенацией крови и транспортом кислорода более сложны. Связано это с тем, что в виде свободных (растворенных) молекул O2 находится лишь небольшая доля общего кислорода крови. Поэтому показатель pO2 не отражает содержание кислорода в крови!
Основная часть кислорода связана с гемоглобином (оксигемоглобин, HbO2) и истинное содержание кислорода в крови зависит от двух дополнительных параметров – концентрации Hb и сатурации(насыщении) гемоглобина кислородом (HbOsat или SO2).
Оксигемоглобин
Оксигемоглобин (HbО2) – процентное содержание в крови, является отношением фракции оксигемоглобина (HbО2) к сумме всех фракций (общему гемоглобину).
Насыщение гемоглобина кислородом
Насыщение (сатурация) гемоглобина кислородом (HbOSAT, SО2), представляет собой отношение фракции оксигенированного гемоглобина к тому количеству гемоглобина в крови, который способен транспортировать О2.
Отличия между двумя показателями HbО2 и HbOSAT заключаются в том, что у пациентов возможно наличие в крови фракции такой формы гемоглобина, которая не способна акцептировать О2 (Hb‑CO, metHb, сульфоHb). Но так как большинство больных не имеют в крови повышенного содержания этих форм гемоглобина, значения HbО2 и SО2 обычно очень близки.
Например, если при отравлении нитритами количество metHb составляет 15%, тогда величина HbО2 никогда не сможет превысить 85%, но насыщение (HbOsat) может быть различно – от максимума (HbOsat=95-98%) при полном насыщении до низких величин при отсутствии кислорода.
Показатель насыщения кислородом показывает процент доступных мест связывания на гемоглобине.
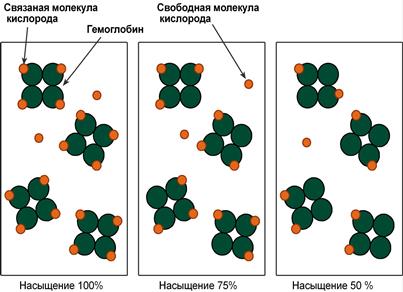
Схема вариантов насыщения гемоглобина
Парциальное давление O2 выступает как движущая сила, приводящая к насыщению гемоглобина кислородом. И хотя обычно чем выше pO2 тем выше HbOsat, эта зависимость не является линейной.
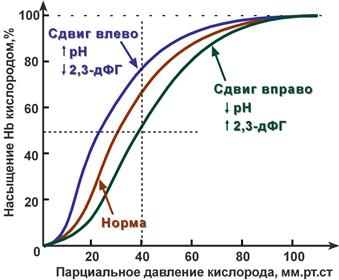
Кривая диссоциации гемоглобина в норме и
при изменении pH и концентрации 2,3-дифосфоглицерата
В центральной части кривой диссоциации малейшие сдвиги pO2 приводят к резким изменениям насыщения гемоглобина. И наоборот, при высоком pO2 (70-90 мм рт.ст) кривая становится плоской, насыщение гемоглобина практически не зависит от количества кислорода в плазме.
Сдвиг влево происходит при защелачивании и снижении концентрации 2,3-дифосфоглицерата и сигнализирует об увеличении сродства кислорода к гемоглобину (в легких). Сдвиг вправо - это снижение сродства кислорода к гемоглобину (в тканях), обеспечивается закислением среды и накоплением 2,3-дифосфоглицерата.
Хотя pO2 не показывает количество кислорода в крови, но это количество зависит от pO2 через показатель сатурации гемоглобина.
В свою очередь имеются факторы, влияющие на величину pO2:
1. Альвеолярная вентиляция. Хотя она влияет как на pO2 так и на pCO2, но доля кислорода в альвеолах при гипервентиляции может лишь слегка увеличиться, приближаясь к pO2 атмосферного воздуха, при гиповентиляции – стремительно падает, вытесняясь поступающим из крови CO2. В то же время доля CO2 в альвеолах быстро снижается при усиленной вентиляции.
2. Вентиляционно-перфузионное соотношение, определяется тем, что
· не вся кровь, притекающая к легким, соприкасается с хорошо вентилируемыми альвеолами (спадение альвеол, уплотнение стенки).
· не все хорошо вентилируемые альвеолы получают достаточно крови.
3. Концентрация кислорода во вдыхаемом воздухе (FiO2, fraction of inspired oxygen).
Как удаляются ионы водорода?
Метаболическая активность организма сопровождается непрерывным потреблением кислорода, поступлением в среду ионов водорода и углекислого газа. Все это может повлиять на активность гормональных сигналов, ферментативных и транспортных систем клетки.
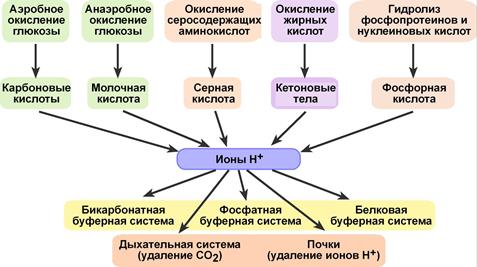
Источники и пути удаления ионов водорода
Для сохранения гомеостаза в организме необходимо наличие двух крупных систем:
1. Система химических реакций:
· действие вне- и внутриклеточных буферных систем (бикарбонатная, фосфатная, белковая, гемоглобиновая),
· действие внеклеточных и внутриклеточных буферных систем,
· интенсивность внутриклеточного образования ионов Н+ и НСО3–.
2. Система физиологических механизмов:
· легочная вентиляция и удаление СО2.
· почечная экскреция ионов Н+, реабсорбция и синтез НСО3–,
· пассивное, т.е. нерегулируемое влияние оказывают печень и костная ткань.
Быстрая компенсация сдвигов рН
Буферные системы
Буферные системы – это соединения, противодействующие резким изменениям концентрации ионов Н+. Любая буферная система - это кислотно-основная пара: слабое основание (анион, А–) и слабая кислота (Н-Анион, H-А). Они минимизируют сдвиги количества ионов Н+ за счет их связывания с анионом и включения в плохо диссоциирующее соединение – в слабую кислоту. Поэтому общее количество ионов Н+ изменяется не так заметно, как это могло бы быть.
Существует несколько буферных систем жидкостей организма – бикарбонатная, фосфатная, белковая, гемоглобиновая.Они вступают в действие моментально и через несколько минут их эффект достигает максимума возможного.
Фосфатная буферная система
Фосфатная буферная система составляет около 2% от всей буферной емкости крови и до 50% буферной емкости мочи. Она образована гидрофосфатом (HPO42–) и дигидрофосфатом (H2PO4–). Первое соединение слабо диссоциирует и ведет себя как слабая кислота, второе обладает щелочными свойствами. В норме отношение HРO42– к H2РO4– равно 4 : 1.
При взаимодействии кислот (ионов Н+) с двузамещенным фосфатом (HPO42‑) образуется дигидрофосфат (H2PO4–):
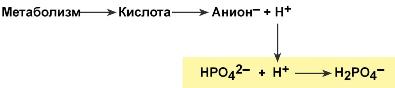
Удаление ионов H фосфатным буфером
В результате концентрация ионов Н+ понижается.
При поступлении в кровь оснований (избыток ОН–‑групп) они нейтрализуются поступающими в плазму от H2PO4–ионами Н+:
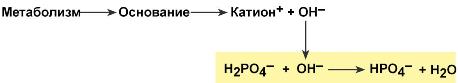
Удаление щелочных эквивалентов фосфатным буфером
Роль фосфатного буфера особенно высока во внутриклеточном пространстве и в просвете почечных канальцев. Кислотно-основная реакция мочи зависит только от содержания дигидрофосфата, т.к. бикарбонат натрия в почечных канальцах реабсорбируется.
Белковая буферная система
Белки плазмы, в первую очередь альбумин, играют роль буфера благодаря своим амфотерным свойствам. Их вклад в буферизацию плазмы крови около 5%.
В кислой среде подавляется диссоциация СООН‑групп аминокислотных радикалов (в аспарагиновой и глутаминовой кислотах), а группы NH2 (в аргинине и лизине) связывают избыток Н+. При этом белок заряжается положительно.
В щелочной среде усиливается диссоциация COOH‑групп, поступающие в плазму ионы Н+ связывают избыток ОН–‑ионов и pH сохраняется. Белки в данном случае выступают как кислоты и заряжаются отрицательно.
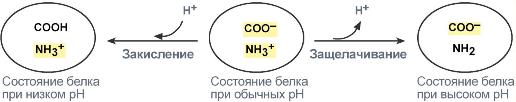
Изменение заряда буферных групп белка при различных рН
Бикарбонатная буферная система
Эта система самая мощная, на ее долю приходится 65% всей буферной системы. Она состоит из бикарбонат-иона (НСО3–) и угольной кислоты (Н2СО3). В норме отношение HCO3– к H2CO3 равно 20/1.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|