
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Катионы (мэкв/л) 1 страница
http://biokhimija.ru/azot-krovi/biohimija-krovi.html
Кровь отражает состояние и состав клеток
Кровь является жидкостью, состоящей из двух основных компонентов: плазмаи клетки (форменные элементы).
Форменные элементы представлены тремя видами клеток - эритроциты, лейкоциты, тромбоциты.
Плазма крови является раствором белков, электролитов, моносахаридов, низкомолекулярных азотсодержащих соединений, липопротеинов.
К азотсодержащим веществам крови относятся любые растворенные в плазме белки и такие небелковые вещества как мочевина, аминокислоты, креатин, креатинин, нуклеотиды и др.
При свертывании крови часть белков, отвечающих за этот процесс, теряет растворимость и вместе с форменными элементами образует сгусток. Жидкая часть крови, лишенная свертывающих белков, называется сыворотка.
Белки крови выполняют серьезные задачи
Функции белков плазмы крови
Многообразие белков крови приводит к тому, что они обладают многочисленными функциями:
· поддерживают постоянство коллоидно-осмотического давления крови – в первую очередь, альбумины,;
· участвуют в поддержании кислотно-основного состояния – альбумины, гемоглобин,
· удерживают в связанном состоянии и транспортируют ионы кальция, магния, железа, меди и другие ионы, препятствуя их потере с мочой – альбумины и специфические транспортные белки,
· связываюти транспортируют органические вещества (углеводы, липиды, гормоны, лекарства, витамины, токсины) – альбумины и другие белки,
· определяют вязкость крови и сохраняют устойчивость эритроцитов и лейкоцитов в кровотоке, обеспечивают нормальный кровоток в капиллярах (реологические свойства крови) – белки свертывающей системы,
· специализированные белки, участвующие в свертывании крови (фибриноген, протромбин, антигемофильный глобулин и др.),
· обеспечивают иммунную защиту организма – иммуноглобулины, факторы системы комплемента, трансферрин и пропердин,
· обеспечивают неспецифическую защиту организма при повреждении тканей – белки острой фазы.
В крови пять фракций белков
Плазма крови человека в норме содержит более 100 видов белков. Примерно 90% всего белка крови составляют альбумины, иммуноглобулины, липопротеины, фибриноген, трансферрин; другие белки присутствуют в плазме в небольших количествах.
Синтез белков плазмы крови осуществляют:
· печень – полностью синтезирует фибриноген и альбумины крови, большую часть α- и β-глобулинов,
· клетки ретикулоэндотелиальной системы (РЭС) костного мозга и лимфатических узлов – часть β-глобулинов и γ-глобулины (иммуноглобулины).
Существует довольно много различных методов разделения белков в зависимости от их некоторых качеств. Наиболее распространенным методом фракционирования белков крови является электрофорез..
Электрофорез белков
Ацетатцеллюлозная пленка, гель, специальная бумага (носитель) помещается на рамку, при этом противоположные края носителя свисают в кюветы с буферным раствором. На линию старта наносится сыворотка крови. Метод заключается в движении заряженых молекул белка по поверхности носителя под влиянием электрического поля. Молекулы с наибольшим отрицательным зарядом и наименьшим размером, т.е. альбумины, двигаются быстрее остальных. Наиболее крупные и нейтральные (γ-глобулины) оказываются последними.
На ход электрофореза влияет подвижность разделяемых веществ, находящаяся в зависимости от ряда факторов: заряд белков, величина электрического поля, состав растворителя (буферной смеси), тип носителя (бумага, пленка, гель).
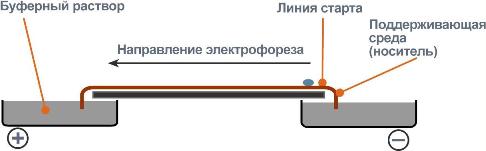
Общий вид электрофореза
Количество выделяемых фракций определяется условиями проведения электрофореза. При электрофорезе на бумаге и пленках ацетата целлюлозы в клинико-диагностических лабораториях выделяют 5 фракций (альбумины, α1-, α2-, β- и γ-глобулины), в то время как в полиакриламидном геле – до 20 и более фракций. При использовании более совершенных методов (радиальная иммунодиффузия, иммуноэлектрофорез и других) в составе глобулиновых фракций выявляются многочисленные индивидуальные белки.
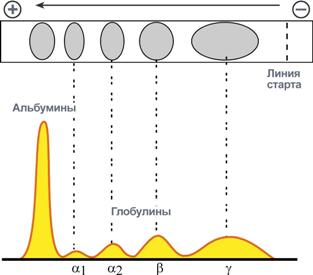
Электрофореграмма (вверху) и графический результат ее обработки (внизу)
На вид протеинограммы оказывают влияние только те белки, концентрация которых достаточно высока.
Нормальные величины белковых фракций плазмы крови
Нормальные величины фракций белков в ликворе и моче можно посмотреть здесь. 
Особенности содержания белков в крови у детей
У новорожденных содержание общего белка в сыворотке крови значительно ниже, чем у взрослых, и становится минимальным к концу первого месяца жизни (до 48 г/л). Ко второму-третьему годам жизни общий белок повышается до уровня взрослых.
В течение первых месяцев жизни концентрация глобулиновых фракций низка, что приводит к относительной гиперальбуминемии до 66-76%. В периоде между 2-м и 12-м месяцами концентрация α2-глобулинов временно превышает взрослый уровень.
Количество фибриногена при рождении гораздо ниже, чем у взрослых (около 2,0 г/л), но к концу первого месяца достигает обычной нормы (4,0 г/л).
Типы протеинограмм
В клинической практике для сыворотки выделяют 10 типов электрофореграмм (протеинограмм), соответствующих различным патологическим состояниям.
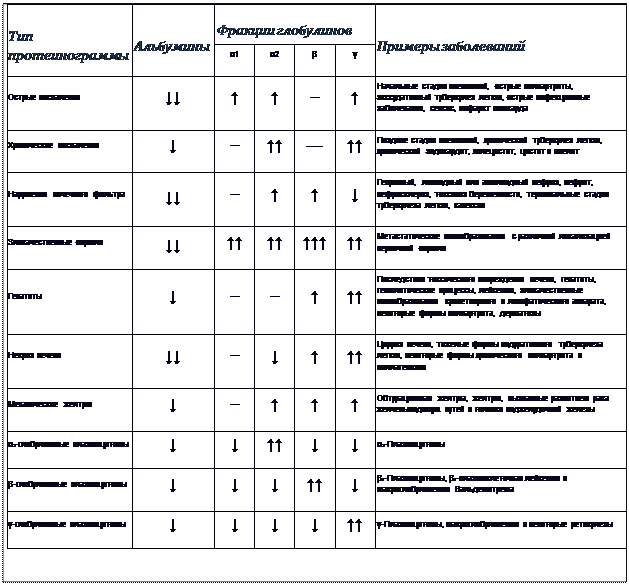
Белки острой фазы - быстро реагирующие белки
Белки острой фазы – большая группа белков сыворотки крови (в основном α-глобулинов) с молекулярной массой от 12 кДа до 340 кДа и различными функциями, объединенных по общему признаку – быстрое и значительное увеличение концентрации при бактериальной, вирусной, паразитарной инфекции, физической или химической травме, токсической или аутоиммунной реакции, злокачественных новообразованиях. Смысл данного увеличения заключается в повышении резистентности организма к свободно-радикальным реакциям, в ограничении повреждения тканей, в подавлении скорости размножения бактерий.
Синтезбелков острой фазы осуществляется печенью, моноцитами, лимфоцитами, нейтрофилами. Их концентрация зависят от стадии заболевания и/или от масштабов повреждений. Синтез белков включается и регулируется рядом медиаторов, среди которых цитокины, анафилотоксины и глюкокортикоиды.
К белкам острой фазы относят
·
o С-реактивный белок,
o сывороточный амилоид А,
o гаптоглобин,
o α2-макроглобулин,
o церулоплазмин,
o α1-гликопротеин,
o α1-антитрипсин,
o орозомукоид,
o компоненты комплемента С1-С4, С9.
Трансферрин также относят к белкам острой фазы, но его концентрация при воспалениях снижается – его называют негативным белком острой фазы.
Альбумин - белок плазмы крови
Белок синтезируется почти исключительно в печени. Хотя по классификации его относят к простым белкам, отмечается широкая микрогетерогенность молекул альбумина, что связано с количеством и качеством агрегированных с альбумином молекул.
Значение альбумина в крови заключается:
1. В поддержании коллоидно-осмотического давления;
2. Он является богатым и быстро реализуемым резервом белка;
3. Транспортная– альбумин переносит
· длинноцепочечные жирные кислоты – основная физиологическая функция сывороточного альбумина.
· пигменты (билирубин),
· катионы(например, Ca2+ и Mg2+), анионы (Cl–),
· желчные кислоты,
· витамины,
· гормоны (альдостерон, прогестерон, гидрокортизон),
· органические красители,
· лекарственные вещества (дигоксин, барбитураты, пенициллин, ацетилсалициловая кислота, сердечные гликозиды).
Изменения количества белка в крови могут иметь как абсолютный (истинный), так и относительныйхарактер. Сдвиги абсолютного характера являются следствием колебаний содержания белка в крови. В свою очередь, относительные изменения зависят от объема крови, т.е. наблюдаются при обезвоживании или гипергидратации.
Гиперальбуминемия
Истинноеповышение концентрации белка в крови обычно не наблюдается.
Относительная гиперальбуминемия вызывается потерями внутрисосудистой жидкости в результате профузных поносов (например, холере), усиленном потоотделении, неукротимой рвоте, несахарном диабете, при тяжелых и обширных ожогах и генерализованных перитонитах.
Гипоальбуминемия
Истинная (абсолютная) гипоальбуминемия связана:
· с недостаточным потреблением белка с пищей – заболевания желудочно-кишечного тракта, сужение пищевода при опухолях, частичное или полное голодание;
· со снижением синтеза белка в печени – несбалансированный аминокислотный состав пищи, хронические паренхиматозные гепатиты, интоксикации, злокачественные новообразования, лечение кортикостероидами;
· с усиленным распадом белка – кахексия, тяжелые инфекции, длительные воспалительные процессы, лихорадочные состояния, тиреотоксикозы;
· с потерей белка – нарушения проницаемости капиллярных стенок, кровоизлияния, ожоги, острые и хронические кровотечения, нефротический синдром.
Относительная гипоальбуминемия связана с нарушением водного баланса – гипергидратация при гиперальдостеронизме, при почечной недостаточности со снижением экскреции солей, при использовании для питья морской воды, при неадекватных инфузиях солевых растворов.
Альфа1-глобулины включают большинство белков острой фазы
Во фракции глобулинов наиболее исследованными являются α1-антитрипсин, α1-липопротеин и α1-гликопротеин, α1-фетопротеин, α1-антихимотрипсин. Другими белками фракции являются транскортин, протромбин, антиплазмин, витамин В12-связывающий белок.
Более подробно представители α1-глобулинов описаны здесь.
1. α1-Антитрипсин (α1-протеиназный ингибитор) является преобладающим белком данной фракции, образуется в печени, белок острой фазы. Белок является ингибитором многих протеиназ плазмы крови и обуславливает 92-94% от общей антипротеолитической функции крови.
2. α1-Антихимотрипсин (ранее α1-гликопротеин Шульца) является одним из реагирующих первыми белков острой фазы, представляет собой специфический ингибитор химотрипсина и слабо активен по отношению и к другим протеазам.
3. Орозомукоид (кислый α1-гликопротеин) является белком острой фазы, синтезируется в печени. Функцией является связывание стероидов (прогестерон, тестостерон) и лекарств (пропранолол и лидокаин).
4. α1-Фетопротеин – синтезируется в печени и желудочно-кишечном тракте плода. Функцией белка является поддержание осмотического давления крови, связывание материнских эстрогенов и предохранение плода от ее иммунной системы, участие в развитии печени. Диагностическое значение имеет, в первую очередь, для оценки правильного развития плода и срока беременности.
5. α-Липопротеины, также называемые липопротеинами высокой плотности (ЛПВП), в целом переносят холестерол от тканей к печени.
Альфа2-глобулины содержат протеазы и транспортные белки
Во фракции α2-глобулинов наиболее важными для диагностики являются α2-макроглобулин, гаптоглобин, церулоплазмин. Также к этой фракции относятся ангиотензиноген, α2-гликопротеин связанный с беременностью, α2-HS-гликопротеин, α2-антиплазмин, белок A связанный с беременностью.
Более подробно о белках α2-фракции можно посмотреть здесь.
1. α2-Макроглобулин – цинксодержащий белок острой фазы. Белок синтезируется в печени и в иммунокомпетентных клетках/ Контролирует развитие инфекций и воспалительных процессов, является ингибитором протеиназ крови – плазмина, пепсина, трипсина, химотрипсина, эндопептидаз, катепсина D, тромбина, калликреина.
2. Гаптоглобин – типичный представитель белков острой фазы, синтезируется в печени и в низких концентрациях присутствует во многих жидкостях организма – ликворе, лимфе, синовиальной жидкости, желчи.
Белок связывает a- и b-димеры гемоглобина плазмы и переносит данный комплекс в клетки РЭС и печени, что предохраняет организм от потери железа. Также он выполняет неспецифическую защитную функцию, комплексируясь с белковыми и небелковыми веществами, появляющимися при распаде клеток. Гаптоглобин также участвует в транспорте витамина В12.
3. Церулоплазмин (ферроксидаза), содержит 8 атомов меди (90% всей меди плазмы). Это белок острой фазы, способствует взаимодействию железа и апотрансферрина, участвует в обмене биогенных аминов (адреналина, норадреналина, серотонина) и аскорбиновой кислоты, регулирует уровень симпатических медиаторов мозга, является сывороточным антиоксидантом, восстанавливает О2 до воды и предотвращает окисление ненасыщенных жирных кислот. Отчасти церулоплазмин транспортирует ионы меди из печени в другие органы.
Бета-глобулины - это чаще транспортные белки
Фракция β-глобулинов содержит трансферрин, гемопексин, компоненты комплемента. В свежей сыворотке эта фракция часто разделена, меньшая β2-фракция в основном обусловлена β-липопротеинами (ЛПНП). Более подробно белки данной фракции описаны здесь.
1. Трансферрин – гликопротеин плазмы, имеет два центра связывания железа, присоединяет только трехвалентное железо вместе с анионом гидрокарбоната, синтезируется в печени и ретикуло-эндотелиальной системой. Функции белка заключаются в связывании железа, превращении его в деионизированную форму и транспорте между тканями, в основном, между печенью и костным мозгом.
2. Гемопексин – гемсвязывающий гликопротеин, синтезируется в гепатоцитах, также связывает порфирин, гемсодержащие хромопротеины (гемоглобин, миоглобин, каталазу), доставляя их в печень, где происходит распад гема и связывание железа с ферритином.
3. Стероид-связывающий β-глобулин синтезируется в печени, связывает половые гормоны тестостерон, эстрадиол, другие 17-β-гидроксистероиды, что регулирует долю свободной (активной) фракции гормонов. Синтез белка стимулируется эстрадиолом, подавляется андрогенами.
В эту фракцию белков также входят липидпереносящие белки: β-липопротеины (липопротеины низкой плотности) и преβ-липопротеины (липопротеины очень низкой плотности).
Гамма-глобулины - защитные белки
Данная фракция белков содержит иммуноглобулины G, A, M, Е, D. Иммуноглобулины часто упрощенно называют антителами.
Иммуноглобулины G – основные иммуноглобулины сыворотки, осуществляют гуморальную защиту организма от бактерий и вирусов и их растворимых токсинов (антигенов). Активно транспортируются через плаценту. У детей должная концентрация достигается только к 1,5-2 годам.
Иммуноглобулины А осуществляют местный иммунитет на слизистых поверхностях дыхательных путей (носовой и бронхиальный секрет) и кишечного тракта. Они присутствуют в женском молозиве, слезе, слюне. После рождения количество секреторного IgA (на слизистых) достигает уровня взрослых уже на 2-3 неделе жизни, сывороточного IgA – только к 14-15 годам.
Иммуноглобулины М появляются в процессе формирования иммунного ответа, являясь первичными антителами. Вскоре после рождения их уровень нарастает, достигает максимума к 9 месяцу жизни, после чего снижается и восстанавливается только к 20-30 годам.
Иммуноглобулины Е вырабатываются плазматическими клетками и участвуют в аллергических реакциях организма.
Иммуноглобулины D не имеют четкой сформированной функции. Предполагается, что они регулируют активность других иммуноглобулинов.
Многие белки крови являются ферментами
Изменения в специфических ферментативных процессах могут быть причиной или следствием различных патологических состояний. Большинство ферментативных процессов локализованы внутри клеток, но определение активности ферментов внеклеточной среды (сыворотка, плазма, слюна, моча) имеет диагностическое значение и носит название энзимодиагностика.
Для правильной трактовки результатов врачу необходимо знать основы энзимодиагностики, иметь информацию о тканевой локализации фермента, его активности в различных компартментах клетки, влиянии на активность фермента принимаемых пациентом лекарств, устойчивости фермента при хранении, наличия изоферментых форм и т.п.
Причины изменения активности ферментов в крови
Степень изменения активности ферментов клеточного метаболизма в сыворотке крови зависит от массыпораженного органа, распределения ферментов между тканями, локализацииферментов во внутриклеточных органеллах. При воспалительных процессах из клетки в первую очередь выходят цитоплазматические ферменты, при прогрессировании заболевания наблюдается некроз клеток и происходит разрушение органелл. В плазме обнаруживаются ферменты митохондрий и лизосом. Например, аланинаминотрансфераза(АЛТ, АлАТ) локализована в цитоплазме, а аспартатаминотрансфераза (АСТ, АсАТ) и в цитоплазме, и в митохондриях, глутаматдегидрогеназа– митохондриальный фермент.
Повышение активности в сыворотке крови может быть результатом ускорения процессов:
· синтеза – щелочная фосфатаза при рахите, гепатите,
· некроза клеток – АлАТ, АсАТ, ЛДГ, КК при инфаркте миокарда, кислая фосфатаза при аденоме простаты, липаза, амилаза при панкреатитах,
· понижения выведения – щелочная фосфатаза при желчнокаменной болезни,
· повышения проницаемости клеточных мембран – АлАТ, АсАТ, ЛДГ при гепатите.
Снижение активности вызывается:
· уменьшением числа клеток, секретирующих фермент (холинэстераза при циррозе печени),
· недостаточностью синтеза,
· увеличением выведения фермента,
· торможением активности в результате действия протеиназ.
В ряде случаев определенное диагностическое значение имеет установление взаимоотношений между изменением активности отдельных ферментов и получение своеобразных ферментных спектров крови. При этом удается установить достоверные ферментные симптомы отдельных заболеваний.
Например,
· острые гепатиты характеризуются резким увеличением активности аланин- и аспартатаминотрансфераз и альдолазы,
· инфаркт миокарда сопровождается увеличением активности лактатдегидрогеназы, креатинкиназы, аспартатаминотрансферазы,
· при механических желтухах характерным является нарастание содержания щелочной фосфатазы без большого увеличения активности аминотрансфераз и альдолазы.
Ферменты сыворотки крови
I. Ферменты, секретируемые в плазму, и выполняющие в ней специфические функции – истинноплазменные ферменты. В плазме их активность много больше, чем в органах (церулоплазмин, псевдохолинэстераза, липопротеинлипаза, белковые факторы систем свертывания крови, фибринолизаи кининогенеза, ренин).
Снижение активности этих ферментов в плазме будет свидетельствовать о снижении синтетической способности клеток или о накоплении ингибиторов в плазме крови.
II. Ферменты, не характерные для плазмы – органоспецифичные. Именно определение активности этих ферментов чаще всего используют для верификации диагноза и контроля лечения. Выделяют две группы органоспецифичных ферментов:
1.Ферменты клеточного метаболизма (индикаторные) – их активность резко повышается в плазме крови в случае нарушения проницаемости клеточных мембран или их альтерации:
Например,
· при изменениях со стороны сердечной мышцы происходит повышение активности сердечного изофермента креатинкиназы(КК-MB), изоферментов лактатдегидрогеназы1 и 2 (ЛДГ-1 и ЛДГ-2), аспартатаминотрансферазы,
· нарушения скелетных мышц – мышечного изофермента креатинкиназы(КК-MM), алкогольдегидрогеназы,
· костной ткани – щелочной фосфатазы (ЩФ), альдолазы(АЛД),
· предстательной железы – кислой фосфатазы,
· гепатоцитов – аланинаминотрансферазы, глутаматдегидрогеназы, холинэстеразы, сорбитолдегидрогеназы,
· желчевыводящих путей – щелочной фосфатазы, γ-глутамилтранспептидазы (γ-ГТП).
2. Ферменты, экскретируемые в выводные протоки желчных путей, панкреатические и слюнные протоки. В норме активность таких ферментов в плазме намного ниже, чем в клетках и имеет постоянное значение (α-амилаза, липазаподжелудочной железы). Изучение активности этих ферментов позволяет судить о функционировании соответствующего органа.
Единицы измерения активности ферментов
Активность ферментов выражают в каталах (1 катал = 1 моль/с), в единицах активности (1 Е = мкмоль/мин или 1 U, 1 unit - стандартная международная единица фермента), в производных от других единиц измерения (моль/с×л, мкмоль/с×л, мкмоль/ч×мл, мг/ч×мл, в мккат/л).
Не весь азот крови находится в белках
Низкомолекулярные азотистые вещества в крови представлены, главным образом, продуктами обмена белков и нуклеиновых кислот. Эти вещества остаются в надосадочной жидкости или фильтрате после осаждения крупномолекулярных белков и составляют остаточный азот крови.
Увеличение остаточного азота (азотемия) по своему характеру может быть абсолютным, связанным с действительным накоплением азотистых компонентов в крови, и относительным, связанным с дегидратацией. В свою очередь, абсолютная азотемия может быть ретенционная (почечного происхождения) и продукционная. Ретенционная возникает в результате задержки выведения и различается на азотемии почечного происхождения (заболевания клубочков – нефриты, туберкулез почек, нефросклероз и т.д.) и внепочечногопроисхождения. Внепочечные в свою очередь подразделяются на надпочечные(результат нарушений гемодинамики и падения фильтрационного давления при сердечно-сосудистой недостаточности, снижении артериального давления) и подпочечные(при гипертрофии или аденоме простаты, почечнокаменной болезни). Продукционная азотемия выявляется при всех состояниях, связанных с увеличением распада белка, от ретенционной ее отличает повышение содержания аминокислот в крови, а также одновременное накопление азотистых компонентов в крови и моче.
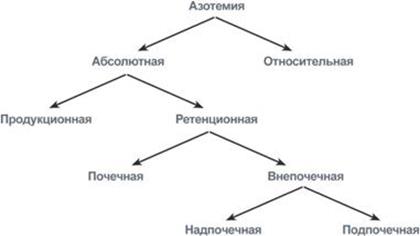
Происхождение и типы азотемий
Фракции остаточного азота
Раньше в лабораториях широко использовалось определение общего содержания остаточного азота. Так как показатель включает различные низкомолекулярные азотсодержащие вещества, более информативным является определение отдельных фракций остаточного азота. К фракциям остаточного азота относится мочевина (перейти) (около 50%), аминокислоты (около 25%), эрготионеин (строение) (около 8%), креатин и креатинин (до 7,5%) (перейти), пептиды, нуклеотиды и азотистые основания (около 5%) (перейти), мочевая кислота (до 4%) (перейти), аммиак и индикан (0,5%).
Метаболизм железа
Для абсорбции железа нужны особые системы
Суточная потребность
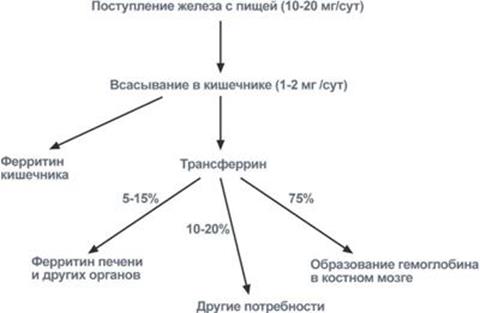
С пищей в сутки должно поступать для мужчин 10 мг, для женщин детородного возраста в связи с регулярной кровопотерей – 20 мг, у женщин при беременности – 40-50 мг и при лактации – 30-40 мг.
Пищевые источники

Всасывание
При попадании в желудок под действием HCl желудочного сока железо высвобождается из элементов пищи.
Всасывание происходит в проксимальном отделе тонкого кишечника в количестве около 1,0-2,0 мг/день (10-15% пищевого железа). При этом железо должно быть в виде двухвалентногоиона, в то же время с пищей поступает преимущественно трехвалентноежелезо. Для восстановления Fe3+ в Fe2+ используется аскорбиновая кислота и соляная кислота. Только железо мясных продуктов находится в двухвалентной гемовой форме, и поэтому хорошо всасывается.
Обнаружены три способа перемещения железа из просвета кишечника в энтероциты:
1. Негемовое железо (III) захватывается интегрином и при помощи мобилферрина перемещается в цитозоль.
2. Негемовое железо (III) восстанавливается до Fe (II) при помощи аскорбиновой кислоты, соляной кислоты или при участии ферроредуктазы (DcytB, дуоденального цитохрома B) и далее переносится внутрь белком DMT-1 (divalent metal ion transporter-1).
3. Гемовое железо связывается с белком НСР1 (heme carrier protein 1), и в цитозоле высво-бождается из гема при действии гемоксигеназы.
После всасывания формируется пул внутриклеточного железа. В зависимости от насыщенности железом трансферрина оно может:
· остаться в клетке в составе ферритина (Fe3+),
·выходить из клетки при помощи ферропортина, окисляться феррооксидазой (гефестином) и связываться с трансферрином (Fe3+).
· и связываться с трансферрином (Fe3+).связываться с трансферрином (Fe3+).
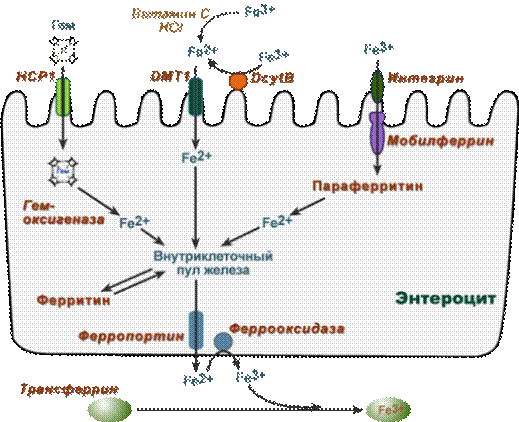
Три пути всасывания железа в кишечнике
Железо мясных продуктов усваивается на 20-30%, из яиц и рыбы – на 10-15%, из растительных продуктов – на 1-5%.
Наличие в пище фитиновойкислоты (сухие завтраки, растительные продукты), кофеинаи танина(чай, кофе, напитки), фосфатов, оксалатов (растительные продукты) ухудшает всасывание железа, т.к. образуются нерастворимые комплексы.
Железо входит в состав белков
Железо в организме находится в составе:
· примерно 25% всего железа в запасной форме (в комплексе с белком ферритином) в селезенке, костном мозге, печени,
· в составе гемоглобина – около 2/3 всего количества,
· в миоглобине и других внутриклеточных гемопротеинах (каталаза, цитохромы и др.),
· только 0,1% железа находится в плазме крови.
Железосодержащие белки
К железосодержащим белкам относятся:
1. Гемопротеины– гемоглобин, миоглобин, цитохромы, цитохромоксидаза, гомогентизатоксидаза, пероксидаза, миелопероксидаза, каталаза, тиреопероксидаза.
2. Железофлавопротеины– цитохром-с-редуктаза, сукцинатдегидрогеназа, НАДФ-оксидаза (в гранулоцитах), ацил-S-КоА-дегидрогеназа, ксантиноксидаза, пролил-гидроксилаза и др.
3. Железосвязывающие белки – трансферрин, ферритин, гемосидерин, мобилферрин, лактоферрин и др.
Метаболизм железа
После всасывания железо либо откладывается в клетках кишечника в составе ферритина, либо сразу попадает в кровоток и в комплексе с трансферрином переносится в клетки печени, костного мозга или других тканей. Нагруженный железом трансферрин взаимодействует со своим специфическим мембранным рецептором.
рецептором.
Пути поступления и использования ионов железа
После образованиятройного комплекса (железо, трансферрин, рецептор) он перемещается в цитоплазму через инвагинацию мембраны и образование эндосом. На мембране эндосомы присутствует H+-АТФаза, создающая кислый рН внутри эндосом. В результате железо диссоциирует из комплекса и составляет свободный пул. Далее оно может доставляться мобилферрином в митохондрии и встраиваться в порфириновое кольцо гема, включаться в железопротеины или депонироваться с ферритином. Запасы железа в организме находятся в основном в гепатоцитахи макрофагах. Большая часть железа, необходимого организму, непрерывно поступает из макрофагов при его рециркуляции после утилизации стареющих эритроцитов или других клеток.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|