
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
24.Максвеллдің газ молекулаларының жылдамдықтары бойынша таралу заңы.
22. Заттардың қ асиеттерін статистикалық жә не термодинамикалық зерттеу ә дістері. молекула-кинетикалық теорияның негізгі қ ағ идалары. Идеал газ. Идеал газдың МКТ негізгі тең деуі. Температура ұ ғ ымын МКТ тұ рғ ысынан тү сіндіру.
МКТ ның негіздері (МКТ)статистикалық тә сілі арқ ылы газдың физикалық қ асиеттерін зерттейтін теория. Молекула кинетикалық теорияның негізі: 1. жү йедегі бө лшектер ү шін импульстың, импульс моменттінің, энергиясының, зарядтың сақ талу заң дары орындалады жә не бө лшектер саны тұ рақ ты. 2. бө лшектердің бір бірінен айыра аламыз. 3. жү йеде ө тетін физикалық процестер кең істік жә не уақ ыт бойынша ү здіксіз мә ндерге ие болады. 4. кез келген бө лшек басқ а бө лшектерге тә уелсіз координата мен жылдамдық мә ндеріне ие болады.
МКТ-нын негізгі тең деуігаз кү йін сипаттайтын параметрлер мен олекулалардың ілгерілемелі кинетикалық энергиясының арасындағ ы байланыс.
Қ андай да бір дененің жылу сыйымдылығ ы деп оның температурасын бір градусқ а кө теру ү шін керекті жылу мө лшеріне тең шаманы айтады. Егер де денеге берілген dQ жылу мө лшері оның температурасын dТ шамасына арттыратын болса, анық тама бойынша жылу сыйымдылық 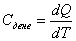 . (8. 15) болады. (8. 15) шамасының ө лшем бірлігі Дж/K. Заттың бірлік массасының жылу сыйымдылығ ы меншікті жылу сыйымдылық деп аталады. Оны біз с ә рпімен белгілейтін боламыз жә не ө лшем бірлігі Дж/К· кг.
. (8. 15) болады. (8. 15) шамасының ө лшем бірлігі Дж/K. Заттың бірлік массасының жылу сыйымдылығ ы меншікті жылу сыйымдылық деп аталады. Оны біз с ә рпімен белгілейтін боламыз жә не ө лшем бірлігі Дж/К· кг.  . (8. 16)
. (8. 16)
Заттың киломолінің жылу сыйымдылығ ын с ә рпімен белгілейміз. с-нің ө лшем бірлігі Дж/К·моль. 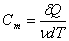 , (8. 17) мұ ндағ ы
, (8. 17) мұ ндағ ы 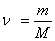 - зат мө лшері.
- зат мө лшері.
Заттың киломолінің жылу сыйымдылығ ы мен осы заттың меншікті сыйымдылығ ының арасындағ ы байланыс: 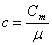 . (8. 18)
. (8. 18)
23. Еркіндік дә режелері бойынша энергияның біркелкі бө ліну заң ы. Идеал газдың жылулық қ озғ алысының орташа кинетикалық энергиясы. Идеал газдың ішкі энергиясы.
Еркіндік дә режесі бойынша энергияның біркелкі таралу заң ы - классикалық жү йелерге қ олданатын статистиканың негізгі заң дарының бірі. Механикалық жү йенің еркіндік дә режелері саны деп жү йенің орнын анық тауда мү мкіндік беретін тә уелсіз координаталардың жиынтығ ын айтады. Материалдық нү ктенің кең істіктегі орны оның ү ш координаттарының мә ндерімен анық талады. Газдардың жылу сыйымдылығ ын ө лшегенде атомдарды материалдық нү ктелер деп есептеуге болады. Олай болса, бір атомды молекулалар ү ш ілгерілемелі еркіндік дә режеге, екі атомды молекулалар – ү ш ілгерілемелі, жә не екі айналмалы, кө п атомды молекулалар жә не абсолютті қ атты дене – ү ш ілгерілемелі жә не ү ш айналмалы еркіндік дә режесіне ие болады. Жылулық тепе-тең дік жағ дайында молекуланың ә р еркіндік дә режесіне 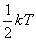 тең орташа бірдей кинетикалық энергиядан келеді. Мұ ндағ ы,
тең орташа бірдей кинетикалық энергиядан келеді. Мұ ндағ ы, 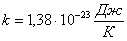 - Больцман тұ рақ тысы. Екі немесе кө п атомды молекулалар айналмалы жә не тербелмелі қ озғ алыстар жасайды. Тербелмелі қ озғ алыстың болуы кинетикалық энергияның потенциалдық энергияғ а ауысуынан жә не керісінше болуымен байланысты. Молекуладағ ы атомның тербеліс энергиясын ескерсек, орташа кинетикалық жә не орташа потенциалдық энергиясын қ арастыруымыз қ ажет. Молекуланың толық энергиясы
- Больцман тұ рақ тысы. Екі немесе кө п атомды молекулалар айналмалы жә не тербелмелі қ озғ алыстар жасайды. Тербелмелі қ озғ алыстың болуы кинетикалық энергияның потенциалдық энергияғ а ауысуынан жә не керісінше болуымен байланысты. Молекуладағ ы атомның тербеліс энергиясын ескерсек, орташа кинетикалық жә не орташа потенциалдық энергиясын қ арастыруымыз қ ажет. Молекуланың толық энергиясы 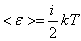 , (8. 11) мұ ндағ ы i – ілгерілемелі, айналмалы жә не екі еселенген тербелмелі еркіндік дә режелері сандарының қ осындысы:
, (8. 11) мұ ндағ ы i – ілгерілемелі, айналмалы жә не екі еселенген тербелмелі еркіндік дә режелері сандарының қ осындысы: 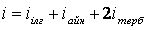 . (8. 12)
. (8. 12)
Атомдардың арасында қ атаң байланысы бар молекула ү шін i молекуланың еркіндік дә режелерінің санына тең болады.
Массасы m газдың ішкі энергиясы газдың бір молінің энергиясын m массадағ ы киломольдердің санына кө бейткенге тең болады: 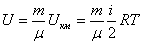 . (8. 14)
. (8. 14)
Сонымен (8. 14) ө рнектен берілген газдың массасы ү шін ішкі энергия газ молекуласының еркіндік дә реже кө рсеткіші ө згермейтін болса, оның абсолют температурасына тура пропорционал екендігі кө рінеді.
Идеал газ молекулалары қ ашық тық тан ә рекеттеспейтін болғ андық тан, мұ ндай газдың ішкі энергиясы жеке молекулалардың энергияларының қ осындысынан тұ рады. Демек, идеал газдың бір киломолінің ішкі энергиясы Авагадро санын бір молекуланың орташа энергиясына кө бейткенге тең болады: 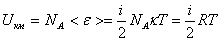 . (8. 13)
. (8. 13)
Массасы m газдың ішкі энергиясы газдың бір молінің энергиясын m массадағ ы киломольдердің санына кө бейткенге тең болады: 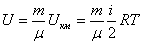 . (8. 14)
. (8. 14)
Сонымен (8. 14) ө рнектен берілген газдың массасы ү шін ішкі энергия газ молекуласының еркіндік дә реже кө рсеткіші ө згермейтін болса, оның абсолют температурасына тура пропорционал екендігі кө рінеді.
24. Максвеллдің газ молекулаларының жылдамдық тары бойынша таралу заң ы.
Газ молекулалары ретсіз, хаосты қ озғ алады. Қ озғ алыс бағ ытының ық тималдылығ ы бірдей, олардың қ айсысының да басқ аларынан ешбір артық шылығ ы жоқ. Сондық тан, молекулалардың бағ ыттары бойынша таралуы бір қ алыпты болады.
Жылдамдық тары белгілі, мысалы, 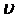 1 жә не
1 жә не 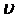 2 жылдамдық тардың аралығ ында жататын молекулалардың саны туралы айтуғ а болады. Жылдамдық тар бойынша таралып бө лінуі туралы заң ды бірінші рет Дж. Максвелл қ орытып шығ арды. Максвелл ық тималдық теориясын пайдаланып,
2 жылдамдық тардың аралығ ында жататын молекулалардың саны туралы айтуғ а болады. Жылдамдық тар бойынша таралып бө лінуі туралы заң ды бірінші рет Дж. Максвелл қ орытып шығ арды. Максвелл ық тималдық теориясын пайдаланып, 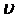 мен
мен 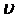 +
+ 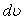 жылдамдық тарының арасына жататын молекулалардың dN санынесептеп шығ арғ ан
жылдамдық тарының арасына жататын молекулалардың dN санынесептеп шығ арғ ан 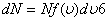 , (8. 2)
, (8. 2) 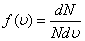 . (8. 3)
. (8. 3)
Осылайша анық талғ ан  функциясы газ молекулаларының жылдамдық тар бойынша бө лінуін сипаттайды да бө ліну функциясы деп аталады. Оның мә ні мынада:
функциясы газ молекулаларының жылдамдық тар бойынша бө лінуін сипаттайды да бө ліну функциясы деп аталады. Оның мә ні мынада:  функциясы жылдамдық тары жылдамдық тың
функциясы жылдамдық тары жылдамдық тың 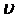 берілген мә нінен бірлік интервалда жататын молекулалардың ү лесін анық тайды.
берілген мә нінен бірлік интервалда жататын молекулалардың ү лесін анық тайды.  функциясы нормалау шартын
функциясы нормалау шартын 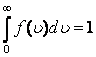 қ анағ аттандырады.
қ анағ аттандырады.
Максвелдің бө ліну функциясы 8. 1 Суретінде кө рсетілген жә не келесі формуламен ө рнектеледі
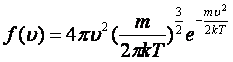 . (8. 4)
. (8. 4)
8. 4 формуласынан кө ретініміз, бұ л функцияның тү рі газдың тегіне (молекула массасына ) жә не кү й параметріне (Т температурадан) тә уелді екенін кө реміз. Кез келген таң дап алынғ ан молекуланың жылдамдығ ының 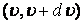 интервалында жату ық тималдылығ ы
интервалында жату ық тималдылығ ы 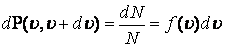 тең.
тең.
Орташа арифметикалық жылдамдық 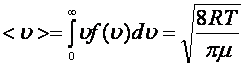 . (8. 6)
. (8. 6)
Орташа квадраттық жылдамдық 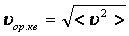 ;
; 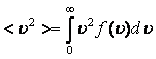 ;
; 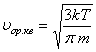 . (8. 7)
. (8. 7)
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|