
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Дәріс 15. Физика-химиялық анализ әдістері.
1. Спектроскопиялық ә дістер. Ерітінділердің абсорбционды фотометриясы. Жарық сің ірілудің заң дары (Бугер-Ламберт-Бер). Оптикалық тығ ыздық, жырық сің ірудің молярлы коэффициенті.
2. Спектрофотометрия жә не колориметрия. Заттың концентрациясын анық тау тә сілдері – есептеу жә не графикалық.
3. Хроматографиялық ә дістердің жіктелуі. Хроматографияның қ олданылуы.
4. Потенциометрия. Потенциометриялық титрлеу. Ионоселективті электродтар. Агрохимиялық анализдерде потенциометрияның қ олданылуы.
5. Кондуктометрия. Кондуктометрия агрономияда жә не топрақ тануда қ олданылуы.
1. Спектроскопиялық ә дістер. Ерітінділердің абсорбционды фотометриясы. Жарық сің ірілудің заң дары (Бугер-Ламберт-Бер). Оптикалық тығ ыздық, жырық сің ірудің молярлы коэффициенты.
Атомды – эмиссиондық спектроскопия ә дісі бос атомдардың немесе бір атомды иондардың термиялық қ оздыруғ а жә не қ оздырылғ ан атомдардың шығ ару оптикалық спектрін тізімге алуғ а негізделген. Бірақ сә улеленудің интенсивтілігі қ оздырылғ ан бө лшектердің санына тура пропорционал.
Атомдардың қ оздырылуы табиғ аты термиялық болғ андық тан, қ оздырылғ ан жә не қ оздырылмағ ан атомдар ө зара термодинамикалық тепе-тең дікте болады, оның жағ дайын Больцман таралу заң ы бейнелейді:
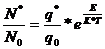
мұ ндағ ы N0- қ оздырылмағ ан атомдар саны
q, q0- қ оздырылғ ан жә не қ оздырылмағ ан жағ дайдың статикалық
салмағ ы
Е – қ озу энергиясы
К – Больцман тұ рақ тысы
Т – абсолютті температура
УК- жә не кө рінетін аудандағ ы абсорбциялық спектроскопия.
Спектрдің УК жә не кө рінетін аудандағ ы молекулярдық абсорбциондық спектроскопия ә дісін – спектрофотометрия деп атайды. Спектрофотометриялық ө лшеудің объектісі ерітінді болып табылады. Фотометрлейтін ерітіндіні бір – біріне паралель, жазық жақ тардан тұ ратын ыдыс, яғ ни кюветағ а қ ұ яды. Спектрофотометриялық ә діс абсорбциялық болғ андық тан, жарық тың сің ірлуін ө лшеуге негізделген. Оны кө бінесе ү лгіге жарық интенсивтілігі мен ө ткен жарық интенсивтілігін салыстыру жолымен ө лшейді. Ү лгі арқ ылы жарық ө ткенде интенсивтілігінің ө згерісін тек анық талатын заттың жарық сің іруі тудырмайды, сондай – ақ ү лгідегі басқ а компоненттерде жә не шағ ылысу мен шашырауда тудыруы мү мкін. Ал жарық шашырауының ә серін болдырмас ү шін фотометрленетін ерітінді мө лдір болуы керек. Ал басқ а эффектілерді салыстырмалы ерітіндіні қ олдану арқ ылы жоюғ а болады.
Жарық сің ірілудің маң ызды заң дары. Бугер-Ламберт-Бер заң ы. Біркелкі ортасы бар қ алың дығ ы dI қ абат концентрациясы с жарық сің іретін заты бар. Интенсивтілігімен монохроматты жарық тың интенсивтілігі I+dI-ге тең, dI< 0. Эксперимент жү зінде жарық тың сің ірілу ү лесі – dI/ I қ абаттың қ алың дығ ына жә не сің ірілетін жарық тың концентрациясына тура пропорционал.
–dI/I=k’cdl
Осы ө рнекті интегралдап:
– lnI=k’lc+const аламыз.
Ү лгіге тү сіп тұ рғ ан жарық ағ ынының интенсивтілігі (яғ ни l=0) I0 деп белгілесек. (2) тең деуге l0=0, I=I0 деп const=-lnI0 табамыз. Осы мағ наны (2) тең деуге қ ойып жә не натурал логорифді оның лограифмге ауыстырып, сің ірілу заң ының негізгі тең деуін табамыз.
lg x I0/I=klc (k=2. 3k’)
I/I0 шамасын ө ткізу деп атайды жә не Т деп белгілейді. (0≤ Т≤ 1) A=lg x I0/I=-lgT шамны оптикалық тығ ыздың деп атайды. Егер A=0, T=1 болады. К сің іру коэфициенті да. Бұ л заң универсальді. Тек спектрофотометрияда емес, сондай-ақ басқ а абсорбциондық спектроскопиялық ә дістерде қ олданады. Концентрация жә не оптикалық тығ ыздың аралығ ындағ ы байланыс тура пропорционал. Сондық тан барлық мү мкін сің ірілуді сипаттайтын шамаларының ішінде оптикалық тығ ыздық пен қ олдануғ а спектроскопияда аналитикалық сигнал ретінде ө те қ олайлы. Егер сің ірілетін бө лшеутердің концентрациясы моль/л берілсе, ал қ абат қ алың дығ ы – см-мен онда сің ірілу коэффициентін Е деп белгілесек, молярлық сің ірілукоэффициенті деп атайды. Спектрофотометрияда жарық сің ірілудің негізгі заң ының жазылуы былай: А=ε lc.
Оптикалық тығ ыздық тардың аудитивтілік заң ы:
Егер ерітіндіде бірнеше сің ірілетін заттар болса, онда ерітіндінің оптикалық тығ ыздығ ы ә рбір компоненттерінің қ осындысына тең.
А=ε 1lc1 +ε 2lc2 +. . .
А-ның С-ғ а тә уелділігінің сызық ты сипаты жиі бұ зылады. Ә сіресе концентрацияның жолғ ары аудандарында немесе оптикалық тығ ыздық ты А мә ндерінде.
Жарық сің ірілу негізгі заң ының ауытқ у себебі:
1. Жарық кө зінің монохроматтағ ы емес жә не шашырағ ан жарық тың ә серінен.
Жарық сің ірілудің негзгі заң ын қ орытындылағ анда жарық кө зі монохроматты деп алынғ ан. Ал шын мә нінде, шығ ару спектрле толқ ын ұ зындығ ы ә ртү рлі фотондар болады. Концентрация жоғ ары болғ ан сайын Еын орташа мә ні ε =A/lc заң бойынша тө мендейді. Сә уле кө зінің монохроматты емес теріс (жағ ымсыз) ауытқ уғ а ә келеді.
2. Химиялық процестер.
Жарық сің ірілудің негізгі заң ының ө рнегінде С шама анық талатын сорттың сің ірілу бө лшектерінің тепе-тең дің концентрациясын кө рсетейік. Аның Сге тә уелділік графигінің турғ ызғ анда еріген заттың жалпы концентрациясының сә йкес болмағ андығ ы жарық сің ірілудің негізгі заң ы бұ зылады. Сызық ты тә уелділік бұ зылмайды, егер химиялық реакцияның терең жү руіне оның концентрациясы ә сер етеді. Бұ л ассоциация – диссоцияция процестері.
Мысалы: CrO4-2 – Cr2O7-2 жү йесін қ арастырайық, мұ нда тепе-тең дік болады: 2Cr2O42+Н2О= Cr2O7-2+2H+
рН – const болғ анда тепе – тең дік оң ғ а қ арай жылжиді.
CrO4-2 иондарының мө лшері азаяды, ал Cr2O7-2 иондарының мө лшері кобейеді.
Электромагнитті толқ ынның сызбасы.
2. Спектрофотометрия жә не колориметрия. Заттың концентрациясын анық тау тә сілдері – есептеу жә не графикалық.
Спектроскопиялық ә діс заттың электромагниттік сә улемен ә рекеттесуіне негізделген. Мұ ндай ә рекеттесу нә тижесінде жарық А сің іріледі. Б шығ арылады. В шашырайды. Сонда тү зілген сигналдар сапалық та, сандық та млімет береді. Сапалық мә ліметті сигналдың жиілігі береді, ол зат табигатына тә уелді. Сандық мә ліметті сигналдың интенсивтілігі береді, ол зат мө лшеріне тә уелді. Электр жә не магнит кү штрінен тү зілетін электромагниттік ө ріс. Бұ л материяның бір тү рі. Материяның негізгі қ асиеті қ озғ алыс, ө лшемі энергия. Электромагниттік ө рістің тербелмелі қ озғ алысы энергия. Оны электромагнитті сә уле жә не жарық деп аталады. Электромагнитті ө рісә жақ ты қ асиетте болады: толқ ындық жә не корпускулалық.
Толқ ындық қ асиет – электромагниттік толқ ынның келесі сипаттамалары болады:
1. Жиілік ν см1- - 1 секунд ішіндегі тербеліс саны.
2. Толқ ын ұ зындығ ы λ нм – екі максимум ара қ ашық тығ ы
3. Толқ ындық сан V – 1 см толқ ын саны
4. Амплитуда α – электромагниттік ө ріс векторының максимум шамасы.
5. Жылдамдық с – белгілі ортада жарық тың таралу жылдамдығ ы. Вакуумда 300000 км/сек тең.
Корпускулалық қ асиет. Сә уле жарық кванты жә не фотон деп аталатын диспертті бө лшектер ағ ынынан тұ рады. Олар жарық жылдамдығ ымен қ озғ алады. Ә рбң р фотон энергиясы
Е = mс2 = hν
h- планк тұ рақ тысы 6, 62 ∙ 10-34Дж∙ сек
mс2 = h∙ с/ λ mс = h/ λ
λ = h/ mс немесе λ = h/ mv
яғ ни бө лшек немесе дене ү шін m жә не v байланысты толқ ындық немесе корпускулалық қ асиет басым болады.
Электромагнит сә улелерінің барлық жиіліктерінің немесе толқ ын ұ зындық тарының жиыны электромагниттік спектр деп аталады. Толқ ын ұ зындық тарын аймақ тарғ а бө ліп қ арастырады.
Жиіліктері бірдей фотондар ағ ынын монохроматты жарық деп, ал жиіліктері ә р тү рлі фотондар ағ ынын полихроматты жарық деп атайды. Хромос тү с деген мағ ына береді. Электрон бұ лтын тү зеді. Ә р электронның атомдағ ы кү йін 4 квант саны сипаттайды. Атомдағ ы ә р бір электрон 4 квант санымен сипатталады: n, l, m, s.
Атом - ө лшемі 10-8 см болатын дискретті бө лшек. Ө лшемі 10-12см болатын ядродан жә не айналып қ озғ алып жү ретін электрондардан тұ рады. Электрон жылдамдығ ы ө те ү лкен, сондық тан атомда оның толқ ындық қ асиеттері басым болады. Электрон атомның ішінде толқ ын тү рінде жағ ылғ ан, демек, ядроның айналасындағ ы бір нү ктеде орналаспайды десе де болады. Зарядтар тығ ыздығ ы максимал болатын аймақ ты электрондық орбиталь деп атайды.
Электронның бір квант санының ө згерісінен атом энергиясын жоғ алтады немесе сің іреді.
Сырттан ә сер болмағ ан жағ дайда атом негізгі яғ ни тыныштық кү йде болады, бұ л кезде атомның энергиясы ең аз мө лшерде болады.
Атом энергияны сырттан алғ ан жағ дайда қ озғ ан кү йге, яғ ни жоғ ары энергетикалық кү йге кө шеді.
Зерттелетін затты электромагнитті ө ріске енгізіп, яғ ни жарық ағ ынының жолына қ ою арқ ылы абсорбциялық спектрді алады;
Атомдарды кез келген энергия кө зін пайдалану қ озғ ан кү йге ауыстырып, 10-9-10-7 сек уақ ыттан соң сә уле шығ ара негізгі кү йіне қ айтарады. Шығ арылатын немесе сің ірілетін сә уле жиілігі электрон орбитальдарының энергия айырмашылығ ымен анық талады (Δ Е).
Ең мү мкін болатын бірінші қ озғ ан кү йден негізгі кү йге ауысу жә не керісінше Е1 ↔ Е0. осы ауысуларғ а резонасты спектр сызығ ы сә йкес келеді. Сыртқ ы оң ай қ озатын электрон оптикалық электрондар деп аталады. Олардың ауысуы оптиалық ауысу тү зеді.
Сің іру кезінде спектрді абсорбциялық деп, ал шығ арғ ан кезде эмиссиялық дейді. Сің ірілген жә не шығ арылғ ан жарық жиілігі мына формуламен анық талады. ν = Δ Ε / h
Егер атомғ а жоғ арғ ы энергия берсе онда оның ішкі электрондарының қ озуы мү мкін. Босағ ан орынғ а басқ а электрон келеді. Энергия рентген сә улесі ретінде шығ ады. Рентген спертрін тү зеді.
Барлық электрондық ауысуларды аналитикалық химияда пайдалануғ а болады.
3. Хроматографиялық ә дістердің жіктелуі. Ауылшаруашылық анализінде хроматографияның қ олданылуы.
Хроматографиялық ә дістердің жіктелуінің негізінде келесі белгілер жатыр: тұ рақ сыз жә не тұ рақ ты фазаның агрегатты кү йі,
сорбент – сорбат ә рекеттесу механизмі,
сорбент қ абатының формасы (орындау техникасы),
Хроматографиялау мақ саты.
Фазалардың агрегатты кү йі бойынша хроматографияны мына топтарғ а бө леді: газды жә не сұ йық тық.
1. Газды хроматография: газсұ йық тық жә не газқ аттыфазалы.
2. Сұ йық тық хроматография: сұ йық - сұ йық ты, сұ йық – қ атты фазалы, сұ йық - газды.
Ә діс атауының бірінші сө зі жылжымалы фазаның , ал екіншісі – тұ рақ ты фазаның агрегатты кү йін сипаттайды.
Сорбент – сорбатә рекеттесу механизмі бойынша хроматография бірнеше тү рге бө лінеді.
А: Таралу хроматография, тұ рақ ты фазада (газсұ йық тық хроматография) бө лінетін заттардың ерігіштігінің ә ртү рлі болуына немесе заттардың сұ йық тұ рақ ты жә не жылжымалы фазасында ерігіштігі ә ртү рлі болуына негізделген;
В: Ионалмасу хроматография, заттардың иондық алмасы қ абілеті ә ртірлі болуына негізделген;
С: Адсорбциялық хроматография, қ атты сорбентпен заттардың адсорбциялануы ә ртү рлі болуына негізделген;
Д: Эксклюзионная хроматография, бө лінетін заттардың молекулаларының ө лшемдері мен формалары ә ртү рлі болуына негізделген;
Е: Аффинды хроматография, бірқ атар биологиялық жә не биохимиялық процестерге тә н спецификалық ә рекеттесулеріге негізделген;
Ж: Тұ нбалы хроматография, бө лінетін заттардың сорбентпен тү зілетін тұ нбалардың ерігіштігі ә ртү рлі болуына негізделген;
З: Адсорбционная хроматография – комплекстү зушы хроматография, фазада немесе сорбент бетінде тұ рақ тылығ ы ә ртү рлі координационды қ осылыстар тү зілуіне негізделген.
Есте болуы керек, механизмі бойынша жіктелу шартты тү рде, жиі бө лу процесі бірден бірнеше механизмі бойынша жү реді.
Орындау техникасы бойынша
Бө лу арнайы колонкаларда жү ргізілетін болса колонкалы хроматография деп, жә не бө лу арнайы қ ағ аздарда (қ ағ азды хроматография) немесе сорбенттің жұ қ а қ абатында (жұ қ а қ абатты) жү ргізілетін болса жазық тық хроматография деп ажыратады.
Хроматографиялау мақ саты
Аналитикалық хроматография (сапалық жә не сандық анализ); препаратты хроматография (заттарды таза кү йінде алу, микроқ оспаларды концентрлеу жә не бө ліп шығ ару ү шін); ө неркә сібті (ө ндірістік) хроматография, процестерді автоматты тү рде бақ ылау ү шін (бұ л жағ дайда мақ сатқ а сә йкес ө нім колонкадан датчикке барып тү седі.
4. Потенциометрия. Потенциометриялық титрлеу. Ионселективті электродтар. Агрохимиялық анализдерде потенциометрияның қ олданылуы.
Бір- бірімен байланысқ ан тотық тырғ ыш пен тотық сыздандырғ ыш тотығ у – тотық сыздану жұ бын тү зеді. Мысалы:
MnOˉ 4 +8H+ + 5 e → Mn2+ + 4 H2O
Тотық қ ан тү рі - MnOˉ 4
Тотық сызданғ ан тү рі – Mn2+
Жеке редокс жұ птың потенциалын тікелей ө лшеуге болмайды. Оны тек екіншісімен салыстырмалы тү рде ө лшей аламыз. Жұ птардың салыстырмалы сипатамасын электродтар потенциалын – шартты тү рде стандарт деп алынғ ан бір элементпен қ айта-қ айта қ иыстырып салыстыру арқ ылы алады.
Мұ ндай электродтардың бірі - стандартты сутек электроды. Ол 1, 013·10 Па (1 атм) қ ысымда газ тә різді сутек ү збей жіберіліп тұ ратын жә не сутек ионының активтілігі 1-ге тең қ ышқ ыл ерітіндісіне батырылғ ан платиналанғ ан платинадан тұ ратын жү йе. Платиналанғ ан платина сутекті сің іріп, редокс жұ бы бар электрод ретінде жұ мыс істейді.
Н2 (газ) = 2 Н+ + 2е
Мұ ндай электродтың потенциалы барлық температурада нө лге тең деп қ абылданғ ан. Сондық тан ө лшенетін электрод потенциалы – бұ л элементтің ЭҚ К, ол берілген жә не стандартты сутек электродынан (ССЭ) қ ұ ралады.
Электродтарды индикаторлы жә не салыстырмалы деп 2 тү рге бө леді. Индикаторлы электрод потенциалы ерітіндідегі ион концентрациясына қ айтымды тә уелді болады. Салыстырмалы электрод потенциалы ерітінді концентрациясына тә уелсіз, тұ рақ ты жә не белгілі болады.
Электрод потенциалы (Е) электрод процесіне қ атысатын заттардың активтілігі немесе концентрациямен байланысты. Ол тә уелділік Нернст тең деуімен кө рсетіледі:
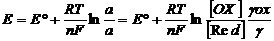
Е˚ - редокс жү йенің стандартты потенциалы;
R – универсал газ тұ рақ тысы, 8, 312 (Дж/моль/К)
Т – абсолютті температура, К.
F – Фарадей тұ рақ тысы, 96500 (Кл/моль).
n – электродтық реакцияғ а қ атысқ ан электрон саны.
aох, ared – редокс жү йедегі тотық қ ан жә не тотық сызданғ ан формалардың активтілігі.
[Ох], [Rеd] – олардың молярлы концентрациясы.
γ ох, γ red - активтілік коэффиценттері.
Мысалы: Zn2+ + 2e- → Zn
Электрод потенциалы Нернст тең деуі бойынша табылады:
EZn2+/Zn = E°Zn2+/Zn + 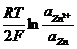
Бос металл активтілігі тұ рақ ты болады, сонда потенциал тек Zn2+ ионының концентрациясына тә уелді болады.
Потенциометриялық ә діс электр қ озғ аушы кү шін ө лшеуге негізделген
Е = Е1 – Е2
Е – ЭҚ К
Е1 жә не Е2 – электрод потенциалы.
Потенциометриялық анализ ә дісі тура потенциометрия (ионометрия) жә не потенциометриялыќ титрлеу болып екіге бө лінеді. Тура потенциометрия ә дісі зерттелетін ерітіндіге батырылғ ан индикаторлы электрод потенциалын ө лшеп, Нернст тең деуі бойынша ион концентрация-сын есептеуге негізделген.
Индикаторлық электродтың тепе-тең діктік потенциалы ерітінді қ ұ рамына тә уелді. Тә уелділік Нернст тең деуіне бағ ынады. Индикаторлық электрод потенциалын анализденетін ерітіндіге титранттың ә рбір порциясын қ осқ аннан кейін ө лшеп отырады. Эквиваленттік нү кте маң айында потенциал кү рт ө згереді (секірме). Потенциометриялық титрлеу нә тижесін есептеу ү шін титранттың эквивалентті кө лемін табу қ ажет. Эквиваленттік нү ктені кө бінесе графиктік ә діспен, яғ ни титрлеу қ исығ ынан табады.
Титрлеу қ исық тарының 4 тү рі болады:
1. Интегралдық қ исық: Е – V координатасында салынады.
2. Дифференциалдық қ исық: Δ E/Δ V - V.
3. ІІ туынды бойынша дифференциалдық қ исық: Δ 2 E/Δ V2 - V.
4. Гран қ исығ ы: Δ V/ Δ E – V.
Эквиваленттік нү ктені дифференциалдық қ исық тан тапқ ан дұ рыс.
Қ олданылатын реакция тү ріне байланысты потенциометриялық титрлеудің келесі ә дістері болады: қ ышқ ылдық -негіздік, тұ ндыру, тотығ у-тотық сыздану, комплекс тү зу титрлеу ә дістері. Тұ ндыру ә дісінде потенциал секірмесі тү зілетін тұ нба ерігіштігі кеміген сайын артады. Эквиваленттік нү ктедегі потенциал шамасы тұ нба ү стіндегі қ анық қ ан ерітінді концентрациясына тә уелді. Индикаторлық электрод ретінде металл электроды (катионы ерітіндіде болатын металдан жасалғ ан), ерітіндіде бар ионғ а сезімтал мембраналық электродтар пайдйланады. Комплексометрия комплекс тү зу реакциясына негізделген. Тү зілетін комплекстің тұ рақ сыздық константасы кеміген сайын потенциал секірмесі артады. Индикаторлық электрод ретінді платина, кү міс, сынап пайдаланады. Қ ышқ ылдық негіздік титрлеуді лайлы жә не тү сті ерітінділерді титрлеуде пайдаланады. Қ осылғ ан титрант кө леміне байланысты ерітінді рН-ын ө лшейді. Кө бінесе шыны электроды пайдаланады. Тотығ у-тотық сыздану ә дісімен титрлеу кезінде тотық қ ан жә не тотық сызданғ ан формалар концентрацияларының қ атынасы ө згеру себебінен ред-окс-жү йе потенциалы ө згереді. Титрант тотық тырғ ыш немесе тотық сыздандырғ ыш болады. Титрлеу қ исық тары билогарифмдік болады, себебі потенциал ө згерісі формалар концентрациясының қ атынасына тә уелді. Потенциал секірмесі жү ретін ТТР э. қ. к. шамасы артқ ан сайын жә не бастапқ ы концентрациялар артқ ан сайын артады.
Салыстырмалы электрод потенциалы нолге тең болғ ан кезде индикаторлы жә не стандартты сутекті салыстырмалы электродынан тұ ратын гальваникалық элементінің электрлік қ озғ ауш кү ші (ЭҚ К) индикаторлы электрдының потенциалына тең болады:
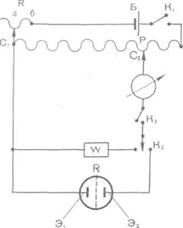
Сур. ЭҚ К ө лшеу ү шін қ олданатын потенциометрдің
принципиалды схемасы:
а — ү здіксіз ток кө зі; Р— кернеу бө луші; R — ауыспалы
кедергі; Clt С2 — жылжымалы контакты; К1; К2; Кз -кілттер.
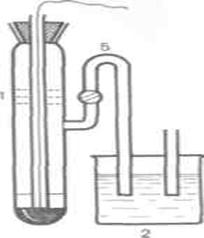
Сур. Иондар концентрациясын анық тайтын элемент:
1— каломельды электрод; 2— КС1 ерітіндісі;
3 — зерттейтін ерітіндісі; 4 — электрод; 5 — тұ зды кө пр
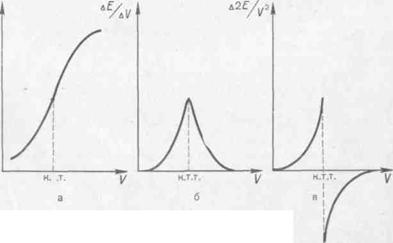
Суретте кө рсетілген ЭҚ К –ң стандартты ерітіндінің кө леміне (V) тә уелділік қ исығ ы — интегральды қ исық. Қ йсық та кө рсетілген сыну нү ктесі титрлеудің соң ғ ы нү ктесін кө рсетеді. Бірінші туындысының (AE/AV) қ осылғ ан стандартты ерітіндінің кө леміне (V) тә уелділік қ йсығ ы —дифференциальды қ йсығ ы. Қ йсық ү шкір тә різді форма болып келеді, ондағ ы максимум нуктесі титрлеудің соң ғ ы нү ктесі болып табылады.
5. Кондуктометрия. Кондуктометрия қ олданылуы.
Электр ө рісінде аниондар анодқ а, катиондар катодқ а тартылады. Ерітіндінің электр ө ткізгіштігі деп уақ ыт бірлігі ішінде ертінді арқ ылы ө ткен электр мө лшерін атайды:
І=L-E
І – тоқ кү ші;
L – электрө ткізгіштік;
Е – кернеу.
Сонымен, электрө ткізгіштік кедергінің кері шамасы. Меншікті кедергі:
R=ρ ·L/S ρ -меншікті кедергі.
S- ө ткізгіштіктің ауданы
L-ө ткізгіш ұ зындығ ы
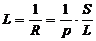
χ - меншікті электрө ткізгіштік.
Аудандағ ы 1см2 ө зара 1 см арақ ашық тық та орналасқ ан екі электрод арасында орналаскан электролит электрө ткізгіштігін меншікті электрө ткізгіштік χ деп атайды. Ө лшем бірлігі, См/ см.
Аналитикалык химияда кө бінесе эквиваленттік электр ө ткізгіштік λ пайдаланады. Эквиваленттік электрө ткізгіштік -арақ ашық тығ ы 1см екі электрод арасында орналасқ ан қ ұ рамында 1 эквивалент зат бар электролит ертіндісінің электрө ткізгіштігі. Ө лшем бірлігі См * см2/моль-экв
λ = χ ·1000
Сн
Ерітіндінісұ йылту кезінде λ артады. Шексіз сұ йылту кезінде максимальды шамасына жете ді λ ∞. Кольрауш заң ы немесе аддитивтілік заң ы: Электролиттің шекті сұ йылту кезіндегі эквиваленттік электрµткізгіштігі катион мен анионның қ озғ алғ ыштық тарының қ осындысына тең болады.
λ ∞ =λ к + λ а
λ кcl = λ kً + λ clˉ
Иондар қ озғ алғ ыштығ ы таблицаларда беріледі. Ол ионның зарядына жә не радиусына тә уелді. Қ озғ алғ ыштыќ ионның абсолюттік жылдамдығ ын Фарадей т±раќтысына кµбейткенге тењ. Эквивалент ретінде 1 заряты бө лшек алынады. Naً ; Clˉ
λ BaCl 2 = λ Ba2++λ Clˉ
ең жоғ арғ ы қ озғ алғ ыш иондар - сутек, гидроксид. 25°С –та λ н+ = 350
λ онˉ = 199
Қ алғ ан иондар қ озғ алғ ыштығ ы 30-70 аралығ ында.
2. Электрө ткізгіштікке келесі факторлар ә сер етеді:
1. электролит табиғ аты
2. электролит концентрациясы
3. температура
4. еріткіш табиғ аты
Электролит жә не концентрацияның ә сері. Орташа концентрацияда конценртация кеміген сайын λ артады. Ө те сұ йытылғ ан концентрация ү шін ≤ 0, 001 М λ = λ ∞ - а√ с
а – электролит табиғ атына байланысты шама.
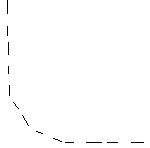

а) Кү шті электролит ү шін λ біртіндеп кемиді, себебі екі қ ұ былыс байқ алады:
1. Релаксация эффектісі;
2. Электрофорезді эффект;
ә ) Ә лсіз электролит ү шін осы екі эффект те болады, бірақ тө мендеу дә режеде. Сұ йылтқ анда ә лсіз электролиттің диссоциациялану дә режесі ά артады, сол себептен сұ йылту нә тижесінде электрө ткізгіштік кө п есе артады.
б)Температура артқ ан сайын электрµткізгіштік артады. Температураны 1 ° С арттырса, электрµткізгіштік 2-2, 5 % артады.
Электрө ткізгіштік кондуктрометр аспабымен ө лшенеді. Оның схемасының негізінде Уитсон кө піршесі жатыр, ол кедергі ө лшеу қ ұ рылғ ысы.
Ерітіндінің электрө ткізгішін ө лшеуге негізделген екі кондуктометриялық ә діс бар:
а) тура кондуктометрия
в) кондуктометриялық титрлеу
а) тура кондуктометрия аналитикалық химияда сирек пайдаланады, себебі электрө ткізгіш тік - аддитивті шама. Ол иондардың жалпы концентрациясын ғ ана кө рсетеді. Тура кондуктометрия келесі мақ саттарда пайдаланады:
1. Ә лсіз электролиттердің диссоциациялану дә режесін ά жә не диссоциациялану константасын анық талу ү шін ά = λ / λ ∞ . Кдис = Сά ².
2. Тұ нбалар ерігіштігін анық тау ү шін. Қ ұ рамы 1: 1 қ атынасындай тұ нбалар ерігіштішін келесі формуламен есптейді:
 Ѕ= χ · 1000
Ѕ= χ · 1000
λ ∞
3. Қ озғ алғ ыштығ ы жуық иондардың ерітіндідегі жалпы концентрациясын табу ү шін.
4. Ә р тү рлі ішімдіктердің сапасын қ адағ алау ү шін.
б) Кондуктометриялыќ титрлеу ә дісі жиі пайдаланады. Ерітіндіні қ олайлы титрантпен титрлеп, χ ө лшеп отырады. Эквиваленттік нү ктені осы χ ө згерісі арқ ылы анық тайды. Қ ышқ ылдық -негіздік, тұ ндыру, комплекс тү зу реакциялары пайдаланады. Тотығ у-тотық сыздану реакциялары сирек пайдаланады, себебі оларда электрө ткізгіштік аз ө згереді.
3. Ерітінді электроө ткізгіштікті кондуктометрмен ө лшейді. Негізін Уистон копіршесі қ ұ райды.
Тұ рақ ты тоқ пайда болмайды себебі электролиз журіп кетеді.
Rx=Rm*R2/R1=Rm-l2/l1
R2, R1 –реохорд иық тарынын ұ зындығ ы.
Ерітінді электроө ткізгіштікті ө лшеуге негізделген анализ ә дісі кондуктометриялық анализ деп аталады. Оның екі ә дісі бар: а) тура кондуктометрия; б) кондутомерияны титрлеу.
а) Тура кондутометрия- аналитикалық химияда сирек пайда болады себебі электроө ткізгіштік аддитивті шама ол лондардың жалпы концентрациясына ғ ана белгілейді жә не келесі мақ саттарда пайдаланады:
1) Ә лсіз электролиттік дисперсиялық дә режесін жә не консистенциясын анық тау ушін: α =П/П∞ К=С* α 2
2) Нашар еритін қ осылыстардың ерігіштігін анық тау:
S=ǣ қ анық қ ан*1000/λ ∞
3) Ерітінді иондардың қ осынды мө лшерін анық тайды.
4) Сү ттін, судың, ішімдіктердің сапасын пайдалану ү шін:
б) Жиі пайдаланылатын ерітіндіні қ олайлы титрантпен ө лшеп ǣ ө лшейді. Эквиваленттік нү кте ǣ ө згерісі бойынша аныкталады. Ү ш тү рлі реакция пайдаланылады: 1-қ ышқ ылдық -негіздік
2-ТТР
3-комплекс тү зу
Артық шылығ ы:
1. Орындауы қ арапайым.
2. Лайлы, тү сті ертінділерді титрлеуге болады.
3. Кейде ерітіндідегі қ оспаны бө лмей титрлеуге болады.
4. Дә лдігі біршама жоғ ары - 2-4 %, ал термостаттау пайдаланса - 0, 2%.
5. Тө мен концентрацияларды (10ˉ ³ моль/л) титрлеуге болады.
6. Судың жалпы кермектігін анық тауғ а болады.
7. Органикалық жә не сулы-органикалық ертінділерді титрлеуге болады.
Кемшілігі:
Талғ амдығ ы тө мен.
Тура кондуктометриялық ө лшеулер қ оспаларғ а сезімтал болады.
Ө зін-ө зі тексеру сұ рақ тары немесе тестер
1. Хроматографиялық ә дістерінің жіктелуі.
2. Э. Д. С -ты компенсациялық ө лшеудегі потенциометрияның принципты схемасы?
3. Потенциометриялық ө лшеулерде қ андай шама қ олданады?
4. Cпекрофотометриялық неге негізделген?
5. Оптикалық тығ ыздық тың аддитивтілік заң ы?
6. Жалынды эмиссионды фотометрия деп қ андай ә дісті атайды?
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|