
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Дәріс 12. Комплексті қосылыстар
Мазмұ ны:
1. Комплексті қ осылыстардың қ ұ рлысы
2. Комплексті қ осылыстардың жіктелуі жә не номенклатурасы
3. Комплексті қ осылыстардың диссоциациясы
1. Коваленттік не иондық байланыс арқ ылы атомдардан молекулалық қ осылыс тү зілсе, олар бірінші ретті деп аталады. Бірінші ретті қ осылыстардың электронейтрал молекулаларының ө зара ә рекеттесуінен тү зілген кө птеген қ осылыстар болады. Оларды жоғ ары ретті молекулалар немесе комплексті қ осылыстар деп атайды: NH3 + HCl → NH3•HCl → NH4Cl
Комплекс қ осылыстағ ы химиялық байланыстың тү зілу механизмін қ арастырып, комплекс қ осылысқ а анық тама беруге болады. Мысалы: NH4Cl молекуласы қ алай тү зіледі
Барлық комплекс қ осылыстарда донорлы-акцепторлы (д. -а. ) байланыс болады. Комплексті қ осылыстар дегеніміз донорлы-акцепторлы байланыс арқ ылы тү зілетін жоғ арғ ы ретті қ осылыстар.
Комплексті қ осылыстарда:
Комплекс тү зуші, олар кө бінесе оң зарядталғ ан металл иондары болады, кө бінесе d-элементтері жатады.
Комплекс тү зушінің маң айында лигандтар орналасады, олар теріс зарядталғ ан аниондар немесе электронейтрал молекулалар.
Лигандтар саны координациялық сан деп аталады.
Комплекс тү зуші мен лигандтар комплексті қ осылыстарының ішкі сферасын тү зеді, ол квадрат жақ шағ а алынады.
Ішкі сферағ а кірмеген иондар сыртқ ы сфераны қ ұ райды.
2. Катионды комплексті қ осылысты атағ анда, алдымен катионның, одан соң анионның атын атайды. Ішкі сферада лигандалар тү рінде электронейтрал молекулалар болса, олардың аттарын ө згеріссіз атайды. Мысалы: С6Н6- бензол, С2Н4- этилен, N2Н4- гидразин, Н2О- аква, NН3-аммин. Саны бірнешеу болса, олардың санын грек тілінде кө рсетеді: 2-ди, 3-три, 4-тетра, 5-пента, 6гекса, 7-гепта, 8-окта. Ішкі сферағ а кіретін анион- лигандтарының аттары атау ү шін олардың ә рқ айсысының аттарына «О» жұ рнағ ы қ осылып ай-тылады. Мысалы, бромо-Br-, О2—оксо, N3—нитридо, ОН—гидроксо, СN—циано, СО32—карбонато, РО43—фосфато, S2O32--тиосульфато, С2О42—оксалато т. б.
Осыдан кейін комплекс тү зушінің атын ілік септігінде атап, оның атынан кейін рим сандарымен жақ ша ішінде комплекс тү зушінің зарядын кө рсетеді. Ең соң ында сыртқ ы сфераның анионның атына «ы» деген жалғ ау қ осып айтылады.
[Ag(NH3)2]Cl- диаммин кү міс (І) хлориді;
[Cu(H2O)4]SO4∙ H2O- тетрааква мыс (ІІ) сульфат гидраты;
[Pt(H2O)(NH3)2OH]NO3- гидроксодиамминаква платина (ІҮ ) нитраты;
[Ru(SO2)(NH3)4Cl]Cl- хлоротетраммин кү кірт диоксид рутений (ІІ) хлориді.
Қ ұ рамында комплексті анионы болатын қ осылысты былай атайды: алдымен сыртқ ы сферасының катионының атын ілік септікте айтады. Бұ дан соң жоғ арғ ы айтылғ ан ретімен лигандтардың атын атайды. Комплекс тү зушінің латын атына «аты» деген жұ рнақ қ осады.
K[Ag(CN)2]- калий дицианоаргентаты (ІІ);
Na3[Co(NO2)6]- натрий гексанитрокобальтаты (ІІ);
K3[Ni(NO)2(S2O3)2]- калий дитиосульфатодинитрозилникеляты (ІІ).
Сыртқ ы сферасы жоқ нейтрал комплекстерінің аттарын атау ү шін алдымен лигандтардың аты, онан кейін атау септігіндегі комплекс тү зушінің қ азақ ша аты келтіріледі де, оның тотығ у дә режесі кө рсетілмейді.
[Co(NH3)3Cl]- трихлоротриаммин кобальт;
[Ru(H2O)(NH3)4SO3]- сульфиттетраамминаква рутений.
3. Комплексті қ осылыстардың диссоциациясы. Комплексті қ осылыстардың сыртқ ы жә не ішкі сфераларының арасындағ ы байланыстар иондық болғ андық тан, суда еріткенде, олар комплексті ион мен қ арапайым сыртқ ы сфераның иондарына ыдырайды:
[Ag(NH3)2]Cl→ [Ag(NH3)2]+ + Cl-
K[Ag(CN)2] → K+ + [Ag(CN)2]-
Тү зілген комплексті иондар ө те аз мө лшерде ө здерінің қ ұ рамына кіретін бө лшектерге (иондарғ а, молекулаларғ а) ыдырайды.
[Ag(NH3)2]+ ↔ Ag+ + 2NH3
[Ag(CN)2]- ↔ Ag+ + 2CN-
Комплексті иондардың диссоциациясы аз мө лшерде жү ретін қ айтымды процесс болғ андық тан оларғ а массалар ә серлесу заң ын қ олдануғ а болады жә не процестер сан жағ ынан диссоциация константасы арқ ылы анық талады:
Кт. з. = ([Ag+]∙ [NH3]2)/[Ag(NH3)2]+ =6, 8∙ 10-8
Кт. з. = ([Ag+]∙ [CN-]2)/[Ag(CN)2]- =1, 0∙ 10-21
Келтірілген комплекс иондарының диссоциациялану константаларын тұ рақ сыздық константасы Кт. з. деп атайды. Тұ рақ сыздық константаларының сандық мә ндері комплексті иондардың тұ рақ тылығ ын немесе беріктігін кө рсетеді. Кт. з. пайдаланып, комплексті қ осылыстың арасындағ ы реакция қ ай бағ ытта жү ретінін анық тауғ а болады..
Ө зін ө зі бақ ылауғ а арналғ ан сұ рақ тар:
1. Комплекс тү зуші заттың тотығ у дә режесі мен координациялық санын кө рсетің дер. Комплекс қ осылыстарды атаң дар: K[AuBr4], K2[Cd(CN)4], [Pt(NH3)2Cl2], K[Cr(SO4)2], Na3[Ag(S2O3)2]. Комплекс қ осылыстың диссоциацияларын жазың дар.
2. Комплекс қ осылыстар жазып, оларды атаң дар: PtCl4∙ 6NH3, PtCl4∙ 5NH3, PtCl4∙ 4NH3, Co(NO3)3∙ 6NH3, Co(NO2)3∙ KNO2∙ 2NH3.
3. Қ ай негіз кү штірек: [Cu(NH3)4](OH)2 не Cu(OH)2 ме?
4. Қ ай комплекс ион тұ рақ тырақ: [Zn(NH3)4]2+ не [Cd(NH3)4]2+?
[Co(NH3)4]2+ не [Co(NH3)4]3+?
Ұ сынылғ ан ә дебиеттер:
1. Омаров Т. Т., Танашева М. Р. Бейорганикалық химия (таң дамалы тараулар) Алматы, 2008ж, -543 б 2. Шоқ ыбаев Ж. Ә. Бейорганикалық жә не аналитикалық химия. Алматы, «Білім» 2004 ж, -316 б. 3. Ділманов Б. М., Ділманова З. Б. Жалпы химияның теориялық негіздері. Аматы, 2009ж, -194 б. 4. Яшкарова М. Г., Омарова Н. М., Кабдулкаримова К. К., Мусабаева Б. Х. Бейорганикалық хмиядан зертханалық жұ мыстар. Семей, 2007, -79б. 5. Шоқ ыбаев Ж. Ә., Ө нербаева З. О. т. б. Бейорганикалық химия практикумы. Алматы, 2004 ж, -164 б. 6. Бишімбаева Г. Қ. Жалпы химия. Студенттердің ө здік жұ мыстарына арналғ ан оқ у-ә дістемелік қ ұ рал. Алматы, 2007 ж, -39 б. 7. Кабдулкаримова К. К., Омарова Н. М. Студенттің ө здігінен орындауына арналғ ан ә дістемелік қ ұ рал. Семей, 2007, -39 б. 8. Д. Шрайвер., П. Эткинс. Неорганическая химия. 1, 2 том. Москва«Мир» 2009г 9. Р. А. Лидин., В. А. Молочко., Л. Л. Андреева. Химические свойства неорганических веществ. Москва, 2000 г. -479 с.
Дә ріс 13. Бейметалдар химиясы. ІҮ топтың р-элементтері.
Мазмұ ны:
1. Периодтық жү йенің ІҮ топтың р-элементтері. Жартылай ө ткізгіштер.
2. Физикалық қ асиеттері, қ осылыстары, қ олданылуы.
3. Химиялық қ асиеттері.
1. ІУ-топтың р-элементтері. Жартылай ө ткізгіштер химиясы.
+6 С +14 Si +32 Ge +50 Sn +82 Pb
2s22p2 3s23p2 4s24p2 5s25p2 6s26p2
_____электр ө ткізгіштігі артады _________ ___________________________________________________________
│ │ │ │
диэлектрик жартылай ө ткізгіш ө ткізгіш
Германий жартылай ө ткізгіш ретінде техникада пайдаланылады. Одан фотоэлементтер, диодтар, детекторлар т. б. жасалады.
Периодтық жү йенің ІҮ топтың р-элементтері (кө міртегі, қ алайы, қ орғ асын) С, Sn, Pb- микроэлементтер, олардың ағ задағ ы мө лшері 0, 002- 1∙ 10-5мг. Тамақ ө неркә сібінде Sn-дан консервілік банкалар, қ ақ пақ тар жасайды. Қ орғ асын улы зат, ол шынының, қ ағ аз жә не полиэтилен қ апшық тардың қ ұ рамына кіреді.
Тірі ағ зада 6 элемент (кө міртегі, сутегі, оттегі, азот, фосфор, кү кірт) ағ за массасының 97, 4% алады. Оларды органогендер деп атайды. Органоген №1 кө міртегі. Себебі кө міртегі майдың, кө мірсулардың, витаминдердің, органикалық қ ышқ ылдардың қ ұ рамына кіреді. Бірақ бос кө міртегі жә не оның монооксиді адам ү шін ө те улы. Натрий гидрокарбонаты, ағ зада ө тте майдың гидролизіне ә сер етеді.
SiO2- кремнезем, оның кристалды тү рі – кварц, алты қ ырлы кварц кристалын тау хрусталі деп атайды, оптикалық аспаптар жасуда, радиотехникада пайдаланылады.
Кристалды кремнеземның балқ у температурасы -17550С суытқ анда кварц шынысы тү зіледі. Ол берік, қ ыздыру мен суытуғ а тө зім-ді, ультра кү лгін сә улені жақ сы ө ткізеді. Одан химиялық ыдыстар, аспап-тар, кварц шамы жасалады. Кварц кристалы электр ө рісінде деформация-ланады. Осы қ асиетіне байланысты дыбыс жазу ісінде қ олданылады.
Аморфты кремний –трепел кеуекті, қ уысты, сондық тан катализаторды жақ сы ұ стайды. Оғ ан нитроглицеринді сің іріп жарылғ ыш зат – динамит жасайды. Кремний қ осылыстарыныың кө пшілігі улы: SiH4 – cилан ө здігінен жанатын, улы зат, SiF4 – тү ссіз ұ намсыз. улы газ. Гексафторкремний қ ышқ ылының тұ здары-кремнефторидтер ө те улы заттар: Na SiF6 - натрийкремнефториді, Ва SiF6 - барийкремнефториді – интектицидтер. H2SiO3 – кремний қ ышқ ылы, тұ здары силикаттар – жай. кү делі, жасанды болып жіктеледі.
Алюмосиликаттар - шпаттар: K2О∙ AI2O3∙ 6SiO2 немесе К2AI2Si6O16 - ортоглаз
Na2О∙ AI2O3∙ 6SiO2 немесе Na2AI2Si6O16 - альбит CaO∙ AI2O3∙ 2SiO2 немесе CaAI2Si2O3 - анортит 2Э2О∙ 2Н2О∙ 3AI2O3∙ 6SiO2 «Э= Na, К » - слюда 4Э2О∙ 4AI2O3∙ 9 SiO2 - нефелин AI2O3∙ 2SiO2 ∙ 2Н2О немесе Н4AI2Si2O9 - каолин, ақ тү сті саз, фарфор жасауда колданады.
Жасанды силикаттарғ а шыны ө ндірісі ө німдері – шыны, керамика, фарфор, фаянс жатады.
Шыны қ ұ рамы: CaСO3+ SiO2 = CaSiO3+ СO2 Na2СО3+ SiO2 = CaSiO3+ СO2 Терезе шынысы: Na2О∙ CaO∙ 6SiO2 Балқ ығ ан шыныны фильяраның кө зінен ө ткізіп ө те жің ішке диаметрі 2-10 микрон талшық жіп алады, оны шыны талшық деп атайды. Одан жасалғ ан мата электр тогын, жылуды ө ткізбейді, дыбысты нашар ө ткізеді, химиялық турақ ты, техникада жә не электротехникада қ олданылады.
Шыны талшық пен тү рлі шайырларды араластырып, конструкциялық материал – шыны пластик жасалады. Ол болаттан 3-4 есе жең іл, бірақ ө те берік, сондық тан машина жасау ө ндірісінде, қ ұ рылыста қ олданылады.
Қ алайы Sn кү міс тү сті ақ, жұ мысақ металл, тө менгі температурада сұ р ұ нтақ тү рінде болады., тұ тқ ыр, сумен жә не аммиак ерітіндісімен ә рекеттеспейді. Қ алайы- баббит- баспахана қ ұ ймасын, подшипниктер жасауғ а қ олданылады, таттанбайды, сумен ә рекеттеспейді.
Қ орғ асын Рв сұ р, кө гілдір тү сті, жұ мысақ, пластикалық металл, баспахана қ ұ ймасын жә не аккумулятор жасауда қ олданылады, радиоактивті жә не гамма-сә улелерін жақ сы сің іреді, сондық тан радиоактивті сә улелерден қ орғ ану ү шін қ олданылады.
3. Химиялық қ асиеттері.


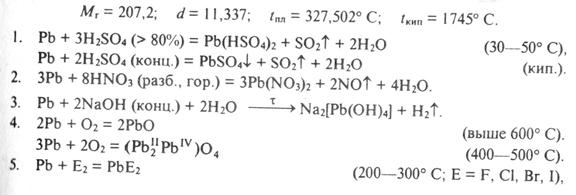
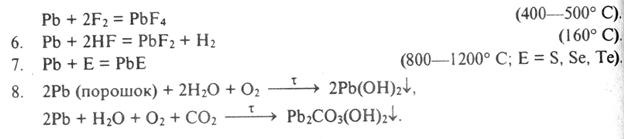
Ө зін ө зі бақ ылауғ а арналғ ан сұ рақ тар:
1. Кө міртегі, қ орғ асынның жә не қ алайының электрондық конфигурациясын жазың дар. Қ ай электрондар мен орбитальдар валенттілікті кө рсетеді?
2. Қ алайы мен қ орғ асын қ ұ ймаларының қ олданылуы.
3. Мына қ атардағ ы элементтердің Ge – Sn – Pb металдық қ аситетінің кү шейетінін кө рсететін реакция тең деулерін жазың дар.
4. Қ алайы жә не қ орғ асын тұ з қ ышқ ылы, азот жә не кү кірт қ ышқ ылдарымен (сұ йытылғ ан жә не концентрлі) қ алай ә рекеттеседі? Реакциялар тең деулерін жазың дар. Қ ай қ ышқ ылда қ орғ асын толық ериді.
5. Мына қ атардағ ы иондардың Sn2+, Pb2+ тотық сыздандырғ ыш қ асиеті мына қ атардағ ы иондардың Sn4+, Pb2+ тотық тырғ ыш қ асиеттері қ алай ө згереді? Ә лсіз тотық сыздандырғ ыш пен кү шті тотық тырғ ышты кө рсетің дер. Тотығ у-тотық сыздану реакциялар тең деулерін жазың дар.
6. Германий топшасының элементтерінің а)негіздік қ асиеттері жоғ ары; б)қ ышқ ылдық қ асиеттері жоғ ары гидроксидтерін жазың дар.
7. Суда ерімейтін PbCl2 жә не Pb(OH)2 не себептен концентрлі тұ з қ ышқ ылы мен сілті ерітіндісінің артық мө лшерінде ериді?
Ұ сынылғ ан ә дебиеттер:
1. Омаров Т. Т., Танашева М. Р. Бейорганикалық химия (таң дамалы тараулар) Алматы, 2008ж, -543 б 2. Шоқ ыбаев Ж. Ә. Бейорганикалық жә не аналитикалық химия. Алматы, «Білім» 2004 ж, -316 б. 3. Ділманов Б. М., Ділманова З. Б. Жалпы химияның теориялық негіздері. Аматы, 2009ж, -194 б. 4. Яшкарова М. Г., Омарова Н. М., Кабдулкаримова К. К., Мусабаева Б. Х. Бейорганикалық хмиядан зертханалық жұ мыстар. Семей, 2007, -79б. 5. Шоқ ыбаев Ж. Ә., Ө нербаева З. О. т. б. Бейорганикалық химия практикумы. Алматы, 2004 ж, -164 б. 6. Бишімбаева Г. Қ. Жалпы химия. Студенттердің ө здік жұ мыстарына арналғ ан оқ у-ә дістемелік қ ұ рал. Алматы, 2007 ж, -39 б. 7. Кабдулкаримова К. К., Омарова Н. М. Студенттің ө здігінен орындауына арналғ ан ә дістемелік қ ұ рал. Семей, 2007, -39 б. 8. Д. Шрайвер., П. Эткинс. Неорганическая химия. 1, 2 том. Москва«Мир» 2009г 9. Р. А. Лидин., В. А. Молочко., Л. Л. Андреева. Химические свойства неорганических веществ. Москва, 2000 г. -479 с.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|