
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Тропонин,тропомиозин.. Бұлшық еттің жиырылуы.
Тропонин, тропомиозин.
Жуан талшық ты миозин кө лденең кө пірлерінің кө мегімен ө зінің алғ ашқ ы қ озғ алысын жү зеге асыру ү шін, миозиннің соң ы актин жіпшесінде орналасқ ан белсенді орталық пен ә рекеттесуі қ ажет. Бұ лшық тың босаң сығ ан кү йінде ол тропомиозин молекуласымен жабылғ ан. Тропомиозин молекуласын жан-жағ ынан актин жіпшесі ширатыла, белсенді орталық тарын жауып орналасқ ан. Ал ол орталық тар ө з кезегінде миозиннің қ атысуымен қ ысқ аруғ а тү седі.
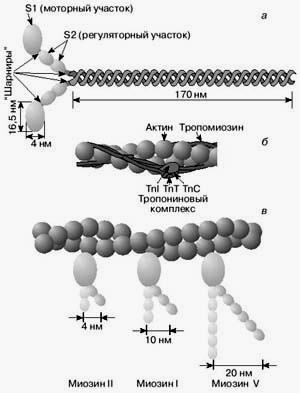
Сурет 4. Миозин молекуласының қ ұ рылысы (а) жә не жің ішке талшық (б). Босаң сығ ан кү йде тропомиозин миозин мен актиннің байланысына кедергі болады (б). Тө менде (в) ү ш типті миозин молекуласының сипаттамасы берілген.
Актин, миозин, тромиозиннен басқ а кө лденең жолақ ты бұ лшық еттерде аса маң ызды регуляторлы ақ уыз тропонин (Сурет 4б). бар. Ол белсенді актинді филамент пен тропомиозинді жіпшемен байланысқ ан. Тропонинді комплекс қ ұ ратын суббірлік Са2+ ионымен байланыса алады. Осындай байланыс пайда болғ анда тропонин тропомиозинге ә сер етеді; тропомиозин актинді филаментте миозин ү шін белсенді орталық ты босатады (Сурет 4 в). Мұ ндай процесте бұ лшық ет қ ысқ ара бастайды.



Бұ лшық еттің жиырылуы.
Кальций иондары F- белсенді актинді орталық тарынан блокаданы бұ зғ аннан соң миозинді бастар олармен ә рекеттеседі – олар саркомер орталығ ына қ арай жылжиды. Миозин актинді жіпшеге бекітіліп, ө з талшығ ының бойына иіледі (сур 4), актинді жіпше бойында миозинді жіпше бір қ адамғ а ығ ысады (шамамен 10н. м-ге). Актин ө з кезегінде АТФаза ретінде миозиннің АТФ гидролиздеу қ ызметін белсендіреді. Демек, миозин молекуласының бастары жуан жіпшелер мен жің ішке жіпшелерді байланыстырып қ оймай, АТФ гидролизіне қ атысады. Актин жіпшесінің бойындағ ы миозин бастарының соң ында миозин молекуласына жаң а АТФ молекуласы қ осылады. Келесі АТФ гидролизінде миозин молекуласының алғ ашқ ы конформациясына қ айтуы байқ алады, бұ л оның актин жіпшесіне қ айта қ осылуына мү мкіндік береді, бірақ алғ ашқ ы ә рекеттесуге қ арағ анда саркомер орталық қ а жақ ын орналасады.
Ә рбір жуан филаментте 500 миозин бастарына жуық филамент қ ұ ралады.
Бұ лшық ет жиырылуы кезінде 1 секунд ішінде 5 циклдік секіріс жасайды (кө лденең кө пірлердің байлануы жә не босауы). Кө пірлер бірдей бір мезетте жұ мыс істемейді: біреулері актин жіпшелерінде байланады, басқ алары бұ л мезгілде олардан бө лектенеді. М. В. Волькенштейн айтуы бойынша миозинді кө пір 5*10-12 шартты қ алыптастыруы керек. Мысалы: адам бицепсіне келетін бір аудан кө леміндегі барлық миозинді кө пірлерлер 2*105 Па кернеуге сә йкес келеді, бұ л бұ лшық еттің (1, 8*105 Па) кернеуіне жақ ын келеді.
Бір ретті миозин басының актин филаментіне байлануы саркомердің алғ ашқ ы ұ зындығ ын 1℅ қ ысқ артады жә не шамамен 20℅ ПЭК-тің 3-5 пиконьютон кү ш жетілдіреді. Табиғ и қ алыпта бұ лшық ет жиырылуы кезінде болатын кө п ретті актин-миозин ә серлесулер ә рбір саркомер барлық бұ лшық тың қ ысқ аруына пропорционалді қ ысқ арады. Бұ лшық еттің жиырылуы жуан жә не жің ішке жіпшелердің ө здік ұ зындық тарының ө згерісіне ә келмейді. Олар тек ө з ө лшемдері мен оларды қ ұ райтын суббірліктердің сипаттамасын сақ тап, бір-біріне қ атысты бағ ыттарда жылжиды.
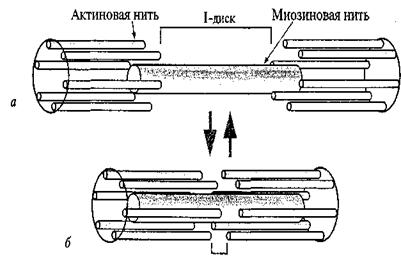 |
Сур. 8. Актин жіпшесінің миозин жіпшелерімен қ оршалуына байланысты жылжуы: а- босаң су; 6 – жиырылу.
1950-жылдың басында Эндрю жә не Хью Хаксли, Р. Нидергерк пен Ж. Хэнсон, бұ лшық етті рентгенқ ұ рылымды талдау, оптикалық жә не электронды микроскоппен зерттеулер жү ргізіп, бір-бірінен тә уелсіз « Жылжығ ан жіптер моделін ұ сынды ».
Жарты ғ асыр ішінде бұ лшық ет жиырылуының механизмдері туралы тү сінік ө згеріске ұ шырағ ан жоқ: бұ лшық еттің максимальді жиырылу кү ші жуан жә не жің ішке жіпшелердің ө зара жабу дә режесіне пропорционалды болып келеді. Саркомер ұ зындығ ы қ ысқ арғ анда тек I-дисктер ғ ана қ ысқ арады, ал А-дисктері болса ө з ө лшемдерін ө згертпейді.
 Саркомердің максимальді жиырылуы ү шін миозин кө пірлері шамамен 50 қ ағ ыс жасауы тиіс. Жылжу процессінің дискреттілігі жиырылу дә режесінің мө лшерлігін қ амтамасыз етеді. Жылжу процессінің дискреттілігі бір мезетте жұ мылдырылғ ан кө лденең кө пірлерге байланысты, ал жылдамдығ ы жұ мылдандырылу жиілігіне тең. Қ аң қ а бұ лшық етінің миоциттері ү шін қ ысқ ару жылдамдығ ы 10-20 мкм*С-1-ге тең, ал кардиомиоциттер мә ні бір реттілікке тө мен. Айтылып кеткендей саркомер 3, 6-3, 8 мкм-ге дейін созылуы мү мкін. Сондық тан бұ лшық етте ешқ андай кернеу туындамайды. Бұ лшық еттің қ алыпты жиырылуы кезінде саркомер ұ зындығ ы 2, 5 мкм жуық шамағ а тең болады. Саркомер 2, 0-2, 2 мкм-ге қ ысқ арғ анда бұ лшық ет максимальді кү ш жетілдіреді. Алайда оның ұ зындығ ы 1, 5-1, 6 мкм дейін тө мендеуі мү мкін. Бұ л жағ дайда бұ лшық ет кернеуі бә сең дейді, себебі миозинді филаменттер ұ штары Z-жолақ қ а тіреледі (актин-десминді тор), сондық тан, миозин кө пірлерінің қ алпы актин филаменттеріне қ атысты ө згеріп, кү штің ә лсіреуіне ә келеді.
Саркомердің максимальді жиырылуы ү шін миозин кө пірлері шамамен 50 қ ағ ыс жасауы тиіс. Жылжу процессінің дискреттілігі жиырылу дә режесінің мө лшерлігін қ амтамасыз етеді. Жылжу процессінің дискреттілігі бір мезетте жұ мылдырылғ ан кө лденең кө пірлерге байланысты, ал жылдамдығ ы жұ мылдандырылу жиілігіне тең. Қ аң қ а бұ лшық етінің миоциттері ү шін қ ысқ ару жылдамдығ ы 10-20 мкм*С-1-ге тең, ал кардиомиоциттер мә ні бір реттілікке тө мен. Айтылып кеткендей саркомер 3, 6-3, 8 мкм-ге дейін созылуы мү мкін. Сондық тан бұ лшық етте ешқ андай кернеу туындамайды. Бұ лшық еттің қ алыпты жиырылуы кезінде саркомер ұ зындығ ы 2, 5 мкм жуық шамағ а тең болады. Саркомер 2, 0-2, 2 мкм-ге қ ысқ арғ анда бұ лшық ет максимальді кү ш жетілдіреді. Алайда оның ұ зындығ ы 1, 5-1, 6 мкм дейін тө мендеуі мү мкін. Бұ л жағ дайда бұ лшық ет кернеуі бә сең дейді, себебі миозинді филаменттер ұ штары Z-жолақ қ а тіреледі (актин-десминді тор), сондық тан, миозин кө пірлерінің қ алпы актин филаменттеріне қ атысты ө згеріп, кү штің ә лсіреуіне ә келеді.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|