
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Степень электролитической диссоциации.
Степень электролитической диссоциации.
Отношение числа диссоциированных молекул к общему числу молекул, находящихся в растворе, называют степенью диссоциации.
Степень диссоциации(α –греческая буква альфа) - это отношение числа молекул, распавшихся на ионы (n), к общему числу растворенных молекул (N):
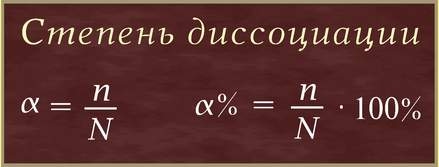
Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если α = 0, то диссоциация отсутствует, а если α = 1 или 100%, то электролит полностью распадается на ионы. Если же α = 20%, то это означает, что из 100 молекул данного электролита 20 распалось на ионы.
Степень диссоциации зависит от природы электролита и растворителя, от концентрации электролита, температуры.
1. Зависимость степени диссоциации от природы: чем полярнее химическая связь в молекуле электролита и растворителя, тем сильнее выражен процесс диссоциации электролита на ионы и тем выше значение степени диссоциации.
2. Зависимость степени диссоциации от концентрации электролита: с уменьшением концентрации электролита, т.е. при разбавлении его водой, степень диссоциации всегда увеличивается.
3. Зависимость степени диссоциации от температуры: степень диссоциации возрастает при повышении температуры (повышение температуры приводит к увеличению кинетической энергии растворённых частиц, что способствует распаду молекул на ионы).
Сильные и слабые электролиты
В зависимости от степени диссоциации различают электролиты сильные и слабые. Электролиты со степенью диссоциации больше 30% обычно называют сильными, со степенью диссоциации от 3 до 30% — средними, менее 3% — слабыми электролитами.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|