
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Электролиты и неэлектролиты. Понятие об электролитической диссоциации. Диссоциация кислот, оснований и солей в водных растворах. Катионы и анионы. Понятие о качественных реакциях. Качественные реакции на ионы Н+ и ОН⎺ в водных растворах. Лабораторны
| Дата: | УРОК № | ||
| Тема | |||
Электролиты и неэлектролиты. Понятие об электролитической диссоциации. Диссоциация кислот, оснований и солей в водных растворах. Катионы и анионы. Понятие о качественных реакциях. Качественные реакции на ионы Н+ и ОН⎺ в водных растворах. Лабораторные опыты: 1) качественные реакции на ионы Н+ и ОН⎺ в водных растворах. Степень диссоциации.
образовательные: - сформировать понятия об электролитах и неэлектролитах; поведении веществ в растворах; об электролитической диссоциации; - использовать межпредметные связи курсов физики и химии для более осознанного и глубокого изучения этих явлений; - на основе повторения материала, закрепить знания об ионной и ковалентной связях..
развивающие: - совершенствовать умение сравнивать и анализировать, классифицировать, - выдвигать гипотезы, наблюдать, делать выводы;- развивать внимание, память обучающихся, образное мышление;
-раскрыть мировоззренческие идеи о взаимосвязи состава, строения и свойств веществ.
воспитательные: - воспитывать бережное отношение к окружающей среде; - воспитывать самостоятельность, культуру речи.
Урок усвоения новых знаний
словесные
Ход урока:
I Организационный этап
Приветствие.
II Изучение нового материала
Очень важным в химии воды и водных растворов является ион гидроксония Н3О+. Вода очень слабый электролит, и ее молекулы в крайне незначительной степени распадаются на ионы водорода Н+ и гидроксид-ионы ОН–, т. е. диссоциируют:
Н2О = Н+ + ОН–.
Однако существование «голого» (без электрона) маленького заряженного протона в воде совершенно невероятно, и он, если и образуется, сразу соединяется с молекулой воды:
Н2О + Н+ = Н3О+
поэтому правильнее записывать уравнение диссоциации воды в таком виде:
Н2О + Н2О = Н3О+ + ОН–
В растворах кислот также нет свободных ионов водорода, а существуют только ионы гидроксония. Впрочем, и сами ионы гидроксония окружены оболочками молекул воды, и их нельзя считать свободными. В воде и растворах щелочей нет и свободных гидроксид-ионов ОН–. Они соединены с молекулами воды. В связи с этим представление о свободных ионах применимо только к газовому состоянию вещества.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы в одну стадию (как NaCl), а другие - ступенчато.
Рассмотрим диссоциацию ксилот.
Кислоты– это электролиты, при диссоциации которых образуются катионы водорода и анионы кислотного остатка.
Сильные кислоты диссоциируют полностью по одной ступени:
HCl = H+ + Cl-
HNO3 = H+ + NO3-
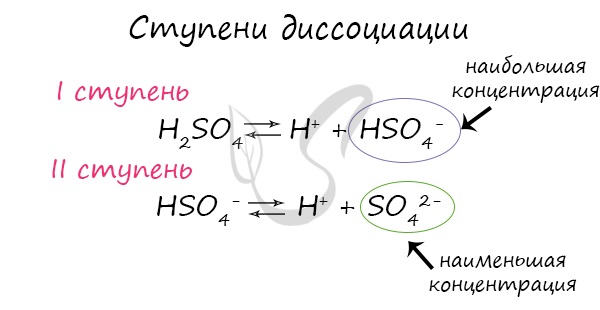
H2SO4 = 2H+ + SO42-
При диссоциации сильных кислот ставится знак равенства, а при диссоциации слабых кислот вместо знака равенства ставится знак обратимости.
HNO2 ⇆ H+ + NO2-
Многоосновные слабые кислоты диссоциируют ступенчато. На каждой стадии отщепляется ион водорода. Например, диссоциация фосфорной кислоты идет в 3 ступени:
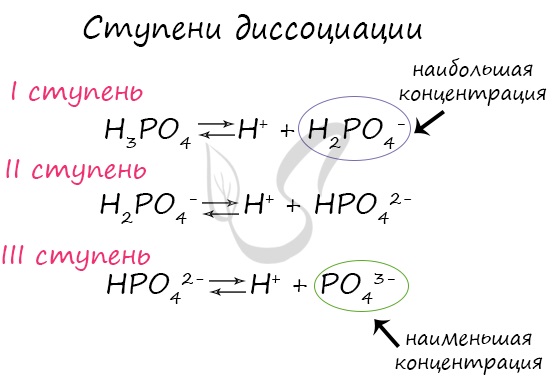
Следует учитывать, что диссоциация, в данном случае, по второй ступени протекает намного слабее, чем по первой, а диссоциация по третьей ступени при обычных условиях почти не происходит.
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Как видно, все кислоты при диссоциации образуют катионы водорода, поэтому они имеют кислый вкус и изменяют окраску индикаторов: лакмус и метилоранж становятся красными.
Основания – это электролиты, при диссоциации которых образуются катионы металла и в качестве анионов гидроксид-ионы.