
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Задачи про калорийность продуктов.
7. Задачи про калорийность продуктов.
Пример:

Есть два типа задач, с пропорцией...
 И два, с формулой.
И два, с формулой.
Как с этим бороться:
Задачи про калорийность бывают двух видов. Первый, где надо считать массу по калорийности или наоборот. Второй, где надо считать калорийность по % содержанию белков, жиров и углеводов. Оба вида лёгкие, но занудные.
1) Для задач первого типа имеет смысл создать пропорцию:
Калорийность (КДж/г) – 1 грамм
Энергетическая ценность – масса
В эту пропорцию вставим то, что в задаче есть. Внимательно читайте условия, там длинные неприятные слова, но разобраться можно. В примере даны калорийность и энергетическая ценность, 1 грамм – это всегда 1 грамм, а массу просят найти. Решать пропорции вы вроде умеете, а если нет, то напоминаю, перемножаем крест-накрест и приравниваем. В виде формулы это будет выглядеть вот так:

Или, если нужна масса

Вставить цифры, рассчитать недостающее. В примере ответ 10 грамм.
2) Проще, но зануднее. Калорийность рассчитывается по формуле:

В примере будем иметь феерический расчет. Если хотите проверить себя, то энергетическая ценность = 400*0,03*17,1+400*0,25*38,8+400*0,04*17,1 = 4 358,8 ≈ 4359 до целых. Обратите внимание, у белков и углеводов правда одинаковая калорийность, это не баг. Внимательно проверяйте все цифры. Рекомендую использоват PhotoMath - идеален для таких рсчётов.
8. Задачи про стандартную энтальпию и массу/объём.
Пример:
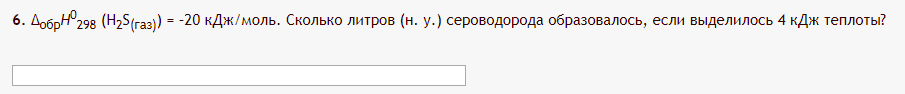
А вот и про объем.

И про массу.
Как с этим бороться:
Как вы уже знаете, дорогие друзья, решение задач представляет собой нетривиальную проблему. Уже даже прочтение условий может вызвать заклинивание мозга.
Используем формулу
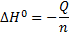
Где ΔH0 – стандартная энтальпия
Q – количество выделившейся теплоты
n- количество моль прореагировавшего вещества. Формула используется в паре со школьными формулами, где масса или объём.
В 1 примере даны ΔH0 и Q, а надо найти объём. Сначала находим n
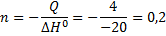
А затем найдем и объём
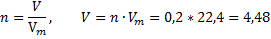
Во втором примере нам даны m и Q, а найти надо ΔH0.
Ничего сложного: находим
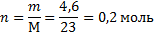
И теперь можем и ΔH0:
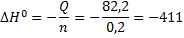
Внимание! Потеря ебучего минуса из формулы – ошибка!
Дальше людям со слабыми нервами лучше не читать. В задачах такого типа нам попались подводные грабли:

Тут ответ не -90,4, как может показаться, а 180,8. Во-первых, по знаку: минус не нужен, потому что тепло не «выделится», а «будет затрачено» - эта фраза отменяет минус. Во-вторых, число. Кажется что n = 1, и значит Q = ΔH0, но это не так. Дело в том, что стандартная энтальпия образования NO соответствует реакции 0,5 N2 + 0,5 О2 = NО (если не поняли что это, посмотрите 5 вопрос). Стандартная энтальпия образования NO относится к 0,5 моля N2, значит на 1 моль N2 тепла понадобится вдвое больше = 180,8 КДж. Сколько там ещё такого говна – Бог весть…
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|