
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
gl] № 1 дәріс. Термодинамиканың негізгі түсініктері мен анықтамасы [:]
[gl] № 1 дәріс. Термодинамиканың негізгі түсініктері мен анықтамасы [:]
Дәрістің мақсаты:Термодинамика пәнімен оның зерттеу әдістерін түсіндіру.
Дәріс жоспары:
1. Техникалық термодинамика пәні, оны зерттеу әдістері.
2. Термодинамикалық жүйе. Тепе теңдік, тепе теңсіздік күй.
3. Термодинамикалық процесстер. Циклдар.
4. Жылу сыйымдылық. Массалық, көлемдік және молярлық жылу сыйымдылықтары.
Кілттік сөздер:Термодинамика, жылу беру, жылу қабылдау.
1.Термодинамика–жылу беру немесе жылу қабылдау процесі бойынша жүретін заттың жылуалмасу заңдылықтары туралы физиканың бөлімі.
Ғылым ретінде жылулық двигателдердің дамуы мен пайда болуына байланысты термодинамика 19 ғасырдың басында туды. Термодинамика маероскопиялық жүйелерде іске асырылатын және жылу эффектілерімен (жылу беру, жылу қабылдау) шығарып салынатын әртүрлі процестерде энергияның түрлену заңдарын зерттейді. Өте көп кішкентай бөлшектерден тұратын материалдық объект макроскопиялық жүйе деп аталынады. Макроскопиялық жүйелердің өлшемдері молекулалар мен атомдардың өлшемдерімен салыстырғанда өте үлкен.
Зерттеу мақсаттарына байланысты техникалық, химиялық термодинамиканы, жүйедердің биологиялық термодинамикасын және тағы басқалары қарастырылады. Техникалық термодинамика жылу энергиясы мен механикалық энергияның бір-біріне түрлену заңдылықтарын және осы түрленуге қатысатын денелердің қасиеттерін зерттейді. Термодинамика мен жылуалмасу теориясы жылу техникасының негізі болып саналады.
Оның негізгі ережелеріне сүйеніп жылу қозғалтқыштарды (іштен жанатын қозғалтқыштар, бумен немесе жылумен күш беретін қондырғылар, газ трубиналы қондырғылар және т.б.) және әртүрлі технологиялық жабдықтарды есептеп жобалайды. Макроскопиялық жүйелердің физикалық қасиеттерін статистикалық және термодинамикалық әдістермен зерттейміз.
Статикалық әдісі – ықтималдар теориясын қолдануға және осындай жүйелер құрлымының белгілі моделіне негізделген.
Термодинамикалық әдіс– зат құрылымы туралы маодльдік түсініктерді қажет етпейді және феноменологиялық болып талбылады, яғни «феномендерді» – құбылыстарды толық қарастырады. Сонымен термодинамиканың негізгі заңын (бастамаларын) қолданып дедукция әдісімен термодинамиканың негізгі қорытындыларын алуға болады.
Термодинамика тек қана макроскопиялық жүйелерді қарастырып, үзіліссіз қозғалыста және өзара әрекеттестікте болатын саны қисапсыз микроструктуралық кішкентай бөлшектердің (молекулалардың, атомдардың, иондардың) бар болуымен қамтамасыз етілетін, материя қозғалысының жылулық түрінің заңдылықтарын зерттейді.
2.Термодинамикалық жүйе – бір-бірімен және жүйені қоршаған сырқы денелермен («сыртқы ортамен») механикалық және жылулық әрекеттестікте болатын материалдық денелер жиынтығын айтады.Жүйені еркін таңдауға болады, бірақ оны таңдау шешетін есептің шартымен анықталады. Жүйеге кірмейтін денелерді қоршаған орта деп атайды. Жүйені қоршаған ортадан бақылайтын бетпен (қабықпен) бөледі. Мысалы, қарапайым жүеге поршеньмен жабдықталған цилиндрдің ішінде газ жатады. Осындай жүйе үшін сыртқы орта деп қоршаған ауаны айтады, ал бақылайтын бет ретінде цилиндрдің қабырғалары мен поршень қызмет етеді.
Термодинамикалық жүйенің механикалық және жылулық әрекеттестіктері бақылайтын бет арқылы іске асады. Механикалық әрекеттестік кезінде жүйенің өзі жұмыс істейді немесе жүйенің үстінен жұмыс істелінеді.
Жалпы тұрғыдан қарағанда жүйе ортамен затпен де алмасуы мүмкін (масса алмасу әрекеттестігі).
Мұндай жүйені ашық деп атайды. Газ бен будың трубинадағы немесе құбырлардағы ағын ашық жүйелердің мысалдары бола алады. Егер зат жүйенің шекарасы арқылы өтпейтін болса, онда жүйе жабық деп аталынады. Қоршаған ортамен жылу алмасу мүмкіндігі жоқ жүйені жылу изоляцияланған немесе адиабаталық деп атайды.
Адиабаталық жүйе ретінде газ бен қоршаған денелердің арасында жылу алмасуды болғызбайтын, қабырғалары идеал жылу изоляциясымен қапталған ыдыстың ішіндегі газды қарастыруға болады. Осындай изоляцияланған қабықты адиабаталық қабық деп атайды.
Қоршаған ортамен, энергиясымен және атымен алмаспайтын жүйені оңашаланған (немесе тұйық) жүйе деп атайды.
Жылуды жұмысқа немесе жылуға түрлендіруді іске асыратын жұмыстық дене қарапайым термодинамикалық жүйе бола алады. Мысалы, іштен жанатын қозғалтқышта жұмыстық дене ретінде карбюраторда дайындалған ауа мен бензин буынан тұратын жанғыш қоспа қолданылады.
Жүйелердің күйін термодинамикалық параметрлердің көмегімен сипаттаймыз.
Термодинамикалық параметр – жүйенің қасиеттерін сипаттайтын шама.
Бір-бірімен соқтығысқан кезде әрекеттесетін, тәртіпсіз жылулық қозғалыста болатын, өлшемдері өте кішкентай молекулалардың жиынтығы туралы, яғни физика курсынан белгілі идеал газ туралы түсінікті қолданып, термодинамикалық пареметрлердің кейбіреуін қарастырамыз.
Термодинамикалық паратемлер: температура, қысым және меншікті көлем.
Қысым – жұмыстық дене молекулаларының ыдыстың бетімен әрекеттесуінің нәтижесімен түсіндіріледі.
Температура – дененің қызғандығының (немесе қызбағандығының) дәрежесін сипаттайтын физикалық шама.
Меншікті көлем – зат массасы бірлігінің көлемі.
Термодинамикалық параметрлер ішкі және сыртқы болып екіге бөлінеді.
– сыртқы параметрлер сыртқы дененің және өрістің термодинамикалық жүйесін сипаттайды. Мысалы атмосфералық қысым ашық ыдыстағы сұйық үшін сыртқы параметр болып табылады;
– ішкі параметрлер жүйенің ішкі күйін анықтайды, яғни олардың мәндерінің қарастырылған жүйелердің координаталары мен жылдамдықтарына тәуелді. Мысалы, егер газ қозғалмайтын қабырғалы ыдыстың ішнде орналасса, онда ыдыс қабырғасындағы газдың қысымы молекуланың жылулық жылдамдық қозғалысына тәуелді және ішкі параметр болып табылады.
Экстентивті немесе аддитивті термодинамикалық параметрлер – термодинамикалық жүйедегі зат мөлшеріне пропорционал мәндер. Аддитивті термодинамикалық параметрге жүйе көлемі жатады.
Күй параметрлер термодинамикалық жүйедегі зат мөлшеріне тәуелсіз мәндерді – интенсивті немесе неаддитивті деп атаймыз. Интенсивті параметрлер қысым, температура және меншікті көлем болып табылады.
Тепе-теңдіктегі термодинамикалық жүйенің күй параметрлерінің арасында функционалдық байланыс бар. Осындай байланысты күй теңдеуі деп атайды. Қарапайым жүйелердің (газдар, булар және сұйықтар) меншікті көлемі, температурасы және қысымы термиялық күй теңдеуімен байланысқанын тәжірибе көрсетті.
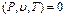
Күй теңдеуін басқа түрде жазуға болады: 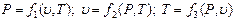
Жүйенің күйін анықтайтын негізгі үш параметрдің кез-келген екеуі тәуелсіз екені осы теңдеулерден көрініп тұр.
Термодинамиканың тәсілдері мен есептерді шешу үшін күй теңдеуін жетік білу керек. Бірақ күй теңдеуін термодинамиканың шеңберінде алу мүмкін емес. Күй теңдеуін тәжирбие жасау арқылы немесе статистикалық физиканың тәсілдерімен табу керек. Күй теңдеуінің нақты түрі әр заттың қасиеттеріне тәуелді.
Термодинамикалық параметрдің қандай да бір анқталған мәнге ие болуын – термодинамикалық жүйенің күйі деп атаймыз, яғни жүйенің әр нүктесіндегі әртүрлілік – тепе-теңсіз күй. Егер қоршаған ортадан немесе өзі тұрған сырқы ортадан жүйені оқшауласақ, онда уақыт өткен сайын жүйе тепе-теңдік қалыпқа келеді.
Жылу сыйымдылық.
Идеал газдардың күй теңдеуі. Молекула-кинетикалық теория бойынша газдың қысым және температураның сандық мағынасы зат молекулаларының орташа кинетикалық энергиясымен байланысты қатынастардан келесі өрнекті аламыз:
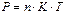
1 кг газды қарастырамыз. 1 кг газда 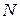 молекула бар екенін ескерсек
молекула бар екенін ескерсек 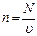 ; аламыз:
; аламыз: 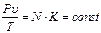 .
.
1 кг газға жатқызылған тұрақты шаманы 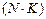
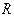 әріпімен белгілеп, газ тұрақтысы деп атайды. Сондықтан :
әріпімен белгілеп, газ тұрақтысы деп атайды. Сондықтан :
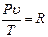 , немесе
, немесе 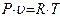 .
.
Алынған қатынас Клапейрон (1834 ж.) теңдеуі деп аталады.
Жоғарыдағы теңдікті  -ге көбейтіп газдың еркін массасы
-ге көбейтіп газдың еркін массасы  -ге арналған күй теңдеуін аламыз:
-ге арналған күй теңдеуін аламыз:
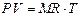
Егер газ тұрақтысын 1 кмоль газға, яғни массасы (кг) сан жағынан молекулалық массаға 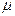 тең газдың мөлшеріне жатқызсақ, онда Клапейрон теңдеуіне универсалдық түр беруге болады.
тең газдың мөлшеріне жатқызсақ, онда Клапейрон теңдеуіне универсалдық түр беруге болады.
Жоғарыдағы теңдеуге оралып, орнына қойамыз: 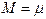 және
және 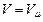 : газдың бір кмоль мөлшері үшін Клапейрон-Менделеев теңдеуін аламыз:
: газдың бір кмоль мөлшері үшін Клапейрон-Менделеев теңдеуін аламыз:
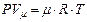
мұнда 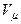 – бір киломоль газдың көлемі, ал
– бір киломоль газдың көлемі, ал 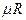 – универсал газ тұрақтысы.
– универсал газ тұрақтысы.
[kgl]
[gl] №2 дәріс. Термодинамиканың бірінші заңы[:]
Дәрістің мақсаты:Термодинамиканың бірінші заңын оқып үйрену.
Дәріс жоспары:
1. Термодинамиканың бірінші заңының мазмұны.
2. Ішкі энергия.
3. Энтальпия. Энтропия.
4. Термодинамиканың бірінші заңының теңдеуі.
5. Термодинамиканың бірінші заңының есепті түрі.
Кілт сөздер: Энтальпия. Энтропия.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|