
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
m(MgCl2)=(0,1772 ± 0,0039) г/100 мл
m(MgCl2)=(0,1772 ± 0,0039) г/100 мл
Лабораторная работа №5
«Окислительно-восстановительное титрование»
1) Приготовление 500 мл 0,05М раствора перманганата калия по точной навеске (вторичный стандарт).
Методика:
а) На технических весах в стеклянном бюксе взвешивают рассчитанную навеску исходного KMnO4.
Масса навески:
g KMnO4= Vр-ра KMnO4 ∙ С(1/5 KMnO4) ∙ M(1/5 KMnO4)=0,79 г
=31,6 г/моль экв.
б) Растворяют её, перенеся в коническую колбу, в определённом объёме дистиллированной воды (≈575 мл), перемешивая.
в) Свежеприготовленный раствор нагревают до кипения и поддерживают эту температуру ≈1 ч, чтобы произошло полное окисление примесей в воде с максимальной скоростью. Вода должна испариться до отметки 500 мл.
г) Раствор охлаждают и фильтруют через стеклянный пористый фильтр, чтобы удалить примесь MnO2, которая всегда есть в навеске. Это повысит устойчивость раствора KMnO4.
д) Раствор хранить в тёмном месте, беречь от действия воздуха.
2) Приготовление 100 мл раствора оксалата аммония (NH4)2SO4 ∙ H2O приблизительно с той же концентрацией, что и у KMnO4 (первичный стандарт).
Методика:
Реакция протекает по уравнению
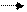 2MnO4-+5C2O42-+16H+ 2Mn2++10CO2+8H2O
2MnO4-+5C2O42-+16H+ 2Mn2++10CO2+8H2O
Рассчитанную навеску (NH4)2SO4 ∙ H2O взвешивают в бюксе на аналитических весах, количественно переносят в мерную колбу, пользуясь воронкой для пересыпания, растворяют в дистиллированной воде при перемешивании, доводят объём воды до метки. Закрывают колбу пробкой, перемешивают. Бюкс с пыльцой взвешивают на аналитических весах.
|
m2=16,7975 г
Титр и нормальность раствора:
T(NH4)2SO4 = m(NH4)2SO4 /Vр-ра=0,004639 г/мл;
С(1/2(NH4)2SO4 ∙ H2O)=1000 T(NH4)2SO4 /М(1/2(NH4)2SO4 ∙ H2O)=0,06534 н.
=71 г/моль экв.
3) Стандартизация перманганата.
Методика:
В коническую колбу для титрования переносят аликвоту раствора (NH4)2SO4, добавляют 10 мл 2 н. раствора H2SO4 и нагревают на водяной бане до 70-800С. Приливают из бюретки раствор KMnO4 по каплям. Титрование заканчивают, когда избыточная капля раствора KMnO4 окрасит раствор в бледно-розовый цвет, не исчезающий 1 минуту.
Результаты титрования:
| V(NH4)2SO4, мл | V KMnO4, мл |
| 11,15 | |
| 11,15 | |
| 11,2 | |
| 11,2 | |
| 11,2 |
VKMnO4=11,167 мл
Стандартные характеристики KMnO4:
нормальная концентрация:
по титру (NH4)2SO4 –
С(1/5 KMnO4)=[T(NH4)2SO4∙ V (NH4)2SO4 ∙ 1000]/[M(1/2 (NH4)2SO4 ∙H2O) ∙ V KMnO4]=0,05851 н.
по концентрации (NH4)2SO4 –
С(1/5 KMnO4)=[C(1/2(NH4)2SO4 ∙H2O) ∙ V (NH4)2SO4]/VKMnO4=0,05851 н.
титр:
по титру (NH4)2SO4 –
TKMnO4=[T (NH4)2SO4 ∙ V (NH4)2SO4 ∙ M(1/5 KMnO4)]/[V KMnO4 ∙ M(1/2(NH4)2SO4 ∙H2O)]=0,001849 г/мл
по концентрации (NH4)2SO4 –
T KMnO4=[ C(1/2(NH4)2SO4 ∙H2O)∙ V (NH4)2SO4∙ M(1/5 KMnO4))]/[V KMnO4 ∙1000]=0,001849 г/мл
 |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|