
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
С(1/1HCl)= 0,09520 н.. THCl=0,003475 г/мл
С(1/1HCl)= 0,09520 н.
THCl=0,003475 г/мл
4) Определение карбоната натрия титрованием.
Методика:
а) Карбонат-ион в водном растворе является слабым анионным основанием, протонирующимся по двум ступеням:
 CO32-+H2O HCO3-+OH-;
CO32-+H2O HCO3-+OH-;
 HCO3-+H2O H2CO3+OH-.
HCO3-+H2O H2CO3+OH-.
K1/K2 ≈104 – кривая титрования будет характеризоваться двумя скачками pH; Na2CO3 можно оттитровать как до NaHCO3, так и до CO2&H2O.
При титровании Na2CO3 как двукислотного основания по реакции
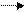 Na2CO3+2HCl 2NaCl+CO2+H2O
Na2CO3+2HCl 2NaCl+CO2+H2O
фактор эквивалентности Na2CO3 ∙ 10H2O – ½, молярная масса эквивалента – 143 г/моль экв.
б) При помощи градуированной пипетки отбирают 10 мл раствора Na2CO3, переносят в мерную колбу, доводят дистиллированной водой до метки, закрывают колбу пробкой, перемешивают.
в) Для определения Na2CO3 как двукислотного основания к отобранным из мерной колбы аликвотным частям раствора в колбах для титрования добавляют по 1 капле раствора метилового оранжевого и титруют их стандартным раствором HCl до перехода окраски раствора из жёлтой в оранжевую. По результатам 5-7 титрований находят среднее значение VHCl и рассчитывают содержание Na2CO3 по титру и концентрации раствора HCl.
Результаты титрования:
| Vсоды, мл | VHCl, мл |
| 10,15 | |
| 10,10 | |
| 10,15 | |
| 10,10 | |
| 10,20 |
VHCl=1/5 ∑Vi(HCl)=10,15мл
Содержание Na2CO3 в растворе:
на основе закона эквивалентов
n(1/2Na2CO3)=n(1/1HCl);
по концентрации HCl:
g (Na2CO3)=[C(1/1HCl) ∙ VHCl ∙ M(1/2 Na2CO3)]/1000 ∙Vмер.колбы/Vпробы соды=1,3818 г
по титру HCl:
g (Na2CO3)=[THCl ∙ VHCl ∙ M(1/2 Na2CO3)]/M(1/1HCl) ∙ Vмер.колбы/Vпробы соды=1,3818 г
 В растворе содержалось
В растворе содержалось
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|