
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Irma Dyon. Филатова Е. А.
РХТУ имени Д. И Менделеева
Кафедра аналитической химии
Лабораторный журнал
по аналитической химии
за 3-й семестр
Выполнила студентка группы О-2X
Irma Dyon
Проверила старший преподаватель
Филатова Е. А.
8.12 2005.
Лабораторная работа №1
«Идентификация катионов»
Склянка №1:
 бесцветный раствор могут присутствовать катионы NH4+, K+, Ca2+, Ba2+, Al3+, Zn2+, Mn2+.
бесцветный раствор могут присутствовать катионы NH4+, K+, Ca2+, Ba2+, Al3+, Zn2+, Mn2+.
Исследование:
| Катион | Реактив, условия проведения | Наблюдаемый аналитический эффект | Вывод |
| NH4+ | Избыток NaOH | Выпадение белого осадка, к-рый не буреет с течением времени | Катионов NH4+, K+, Ba2+ не может быть, Mn2+ - тоже, так как осадок не буреет, но присутствует один из ионов: Al3+, Zn2+, Ca2+. |
| Al3+, Zn2+, Ca2+ | Избыток NH4OH | Осадок не растворяется | В растворе присутствует ион Al3+ или Ca2+ |
| Ca2+, Al3+ | Избыток NaOH | Осадок не растворяется | В растворе предположительно ион Ca2+ |
| Ca2+ - качественная реакция | H2SO4(конц.), высушивание | Под микроскопом видны игольчатые кристаллы. | Выявлен ион Ca2+. |
Склянка №2:
 ярко-розовый раствор предположительно содержит ион Co2+.
ярко-розовый раствор предположительно содержит ион Co2+.
Исследование:
| Co2+ - качественная реакция | NH4CNS; амиловый спирт | Спирт не смешивается с раствором, и в зоне спирта образуется голубое кольцо. | В растворе присутствует ион Co2+. |
Склянка №3:
 бесцветный раствор могут быть катионы NH4+, K+, Ca2+, Ba2+, Al3+, Zn2+, Mn2+.
бесцветный раствор могут быть катионы NH4+, K+, Ca2+, Ba2+, Al3+, Zn2+, Mn2+.
Исследование:
| NH4+ | Избыток NaOH | Выпадает белый студенистый осадок, с течением времени не буреет, растворяется в избытке NaOH | Нет ионов NH4+, Mn2+, K+,Ba2+, Ca2+. |
| Al3+, Zn2+ | Избыток NH4OH | Осадок не растворяется. | В растворе, возможно, содержится ион Al3+ |
| Al3+ - качественная реакция | Ализарин, Al(NO3)3 для сравнения | При сравнении окраски исходного раствора и нитрата алюминия с ализарином она получилась одинаковой. | В растворе выявлен ион Al3+. |
В ходе проделанной работы выявлены катионы: Ca2+, Co2+, Al3+.
Лабораторная работа №2
«Идентификация неорганической соли»
Пробирка №1:
 зелёного цвета гигроскопичная соль предположительно содержит ион Ni2+.
зелёного цвета гигроскопичная соль предположительно содержит ион Ni2+.
Растворяется в HCl, раствор бледно-зелёный, CO2 не выделяется. Растворяется в воде, pH раствора ≈5. Значит, соль образована сильной кислотой и слабым основанием (не может быть ионов K+, Ca2+, Ba2+).
Исследование:
| Ион | Реактив, условия проведения | Наблюдаемый аналитический эффект | Вывод |
| Обнаружение катионов: | |||
| NH4+ (на всякий случай) | Избыток NaOH | Выпадает бледно-зелёный осадок, нерастворимый в избытке NaOH, NH4OH | Так как выпал осадок, иона NH4+ нет. Бледно-зелёный осадок может давать катион Ni2+. |
| Ni2+ - качественная реакция | Диметилглиоксим | Появление ярко-розового осадка | Соль образована катионом Ni2+. Если соль образована катионом Ni2+ и растворима в воде, то это не фосфат и не карбонат. Проверка на Cl-, SO42-, NO3-. |
| Обнаружение анионов: | |||
| Cl- | Избыток AgNO3 (HNO3 – среда) | Нет результата | |
| SO42- | Избыток BaCl2 (HCl – среда) | Нет результата | |
| NO3- | Дифениламин | Чёрно-фиолетовый осадок | Обнаружен ион NO3-. |
Вывод: дана соль Ni(NO3)2, что соответствует её растворимости в воде и pH<7.
Пробирка №2:
белое кристаллическое вещество. С HCl и баритовой водой результат не даёт (нет CO32—ионов). Растворяется в воде. pH=5-6.
Исследование:
| Ион | Реактив, условия проведения | Наблюдаемый аналитический эффект | Вывод |
| Обнаружение катионов: | |||
| NH4+ | Избыток NaOH, фенолфталеин, водяная баня | Осадка нет. Фенолфталеиновая бумага не покраснела. | Так как соль бесцветна, изначально ионов Fe3+, Co2+, Cu2+, Ni2+ нет. Ион NH4+ не обнаружен. Нужно искать катионы Ca2+, Ba2+, K+. |
| Ca2+ | Избыток (NH4)2C2O4 | Нет результата | |
| Ba2+ | Избыток K2Cr2O7, CH3COONa – среда | Нет результата | |
| К+ | Избыток Na3[Co(NO2)6], CH3COONa – среда | Выпадение оранжевого осадка | Выявлен ион K+. |
| Обнаружение анионов: | |||
| SO42- | Избыток BaCl2 (HCl – среда) | Нет результата | |
| Cl- | Избыток AgNO3 (HNO3 – среда) | Выпадение белого творожистого осадка | Есть ионы Cl-. |
Вывод: дана соль KCl, что соответствует её растворимости в воде. pH могло понизиться из-за кислотности воды.
В результате исследований выявлены соли Ni(NO3)2 и KCl.
Лабораторная работа №3
«Кислотно-основное титрование»
1) Приготовление 500 мл 0,1н. раствора соляной кислоты путём разбавления концентрированной HCl (вторичный стандарт).
Методика:
Для приготовления растворов разбавлением концентрированных растворов ареометром измеряют плотность ρ исходного раствора вещества, по таблице справочника находят соответствующую плотности процентную концентрацию С%. Рассчитывают, какой объём раствора нужно взять для разбавления его до заданного объёма (у нас 500 мл) с заданной концентрацией (у нас 0,1 н.):
а) mвещ-ва HCl=С(1/1HCl) ∙ V(р-ра HCl) ∙ M(1/1HCl)=0,1н. ∙ 0,5 л ∙ 36,5г/моль экв.=1,825г
б) 100 г/ρ г/мл – С г (С%) ρ=1,18 г/мл С=36,23%
х мл - 1,825 г
х=VHCl конц. =1,825г ∙100%/(1,18г/мл ∙ 36,23%)=4,2689 мл
Этот объём отмеряют цилиндром и отливают в бутыль, в которую предварительно налито некоторое количество дистиллированной воды, затем разбавляют раствор до нужного объёма дистиллированной водой и тщательно перемешивают.
2) Приготовление 100 мл 0,1н. раствора тетрабората натрия по точной навеске в мерной колбе (первичный стандарт).
Методика:
а) Рассчитывают массу тетрабората (ТБ), которую нужно взять для приготовления заданного объёма V раствора с нормальной концентрацией С(fэкв.):
mТБ= С(1/2ТБ) ∙ V(р-ра ТБ) ∙ M(1/2ТБ∙10H2O)= 0,1 н. ∙ 0,1 л ∙ 190,67 г/моль экв.=1,9067 г
Реакция протекает по уравнению
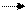 Na2B4O7 ∙10H2O+2HCl 4H3BO3+2NaCl+5H2O
Na2B4O7 ∙10H2O+2HCl 4H3BO3+2NaCl+5H2O
б) Навеску ТБ взвесить в бюксе на аналитических весах. Масса бюкса с навеской – m1. Навеску перенести в мерную колбу и растворить в небольшом объёме ГОРЯЧЕЙ дистиллированной воды. Бюкс с остатками навески («пыльца») взвесить на тех же аналитических весах. Масса бюкса с пыльцой – m2. Массу ТБ mТБ в растворе определить как разность m1 и m2.
|
m2=18,18465 г
в) Раствор в мерной колбе охладить до комнатной температуры и довести до метки холодной дистиллированной водой.
г) Рассчитать титр и нормальность полученного раствора:
TТБ=mТБ/Vр-ра=0,02157 г/мл;
С(1/2ТБ)=1000 TТБ/М(1/2ТБ)=0,1131 н.
3) Стандартизация раствора HCl.
Методика:
а) Из мерной колбы отобрать пипеткой аликвотные части раствора Na2B4O7 в чистые конические колбы, добавить 1-2 капли раствора индикатора метилового красного и титровать раствором HCl до чёткого изменения цвета индикатора от жёлтого до оранжево-жёлтого. В точке эквивалентности pH=5,12.
б) Отсчёт расхода долей титранта по бюретке должен быть сделан с точностью до сотых долей миллилитра.
в) Необходимо протитровать 5-7 проб. Разница в объёмах любой пары не должна превышать 0,05 мл.
г) Результаты титрования занести в таблицу.
| VТБ, мл | VHCl, мл |
| 11,63 | |
| 11,85 | |
| 12,01 | |
| 11,92 | |
| 11,87 |
VHCl=⅓∑Vi(HCl)=11,88мл
д) Вычислить характеристики стандартного раствора HCl:
на основе закона эквивалентности
n(1/2ТБ)=n(1/1HCl);
нормальная концентрация:
по титру ТБ –
С(1/1HCl)=[TТБ ∙ VТБ ∙ 1000]/[M(1/2ТБ) ∙ VHCl]=0,09520 н.
по концентрации ТБ –
С(1/1HCl)=[C(1/2ТБ) ∙ VТБ]/VHCl=0,09520 н.
титр:
по титру ТБ –
THCl=[TТБ ∙ VТБ ∙ 1000]/[VHCl ∙ M(1/2ТБ)]=0,003475 г/мл
по концентрации ТБ –
THCl=[С(1/1HCl) ∙ VТБ ∙ M(1/1 HCl)]/[VHCl ∙ M(1/2ТБ)]=0,003475 г/мл
 |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|