
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Обработка результатов. Лабораторная работа. Методика анализа
Обработка результатов
До титрования были известны значения:
V Na2B4O7 = 25, 00 мл; N Na2B4O7  = 0,1000 н.
= 0,1000 н.
В результате титрования определены объемы соляной кислоты, израсходованные на реакцию с 25,00 мл 0,1000 н раствора Na2B4O7:
V1 HCl = ….мл; V2 HCl = ….мл; Vср HCl = ….мл.
Расчет нормальности соляной кислоты проводят по формуле:
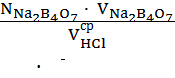 N HCl =
N HCl =
Расчет проводят с точностью до 1 10-4 г- экв.
Лабораторная работа
Стандартизация раствора едкого натра
Соляная кислота, нормальность которой точно известна, в свою очередь, используется для стандартизации приготовленного раствора щелочи.
Схема титрования Уравнение реакции:
NaOH NaOH + HCl = NaCl + H2O
HCl
Условие выбора индикатора: рТинд 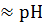 э.т.
э.т.
Состав раствора в эквивалентной точке:
NaCl рН = 7
H2O рН = 7
Следовательно, наиболее подходящим для данного титрования является индикатор с рТ =7. Однако, рассчитав рН раствора в начале и конце скачка по формулам , легко убедиться в том, что для 0,1 н растворов можно использовать индикатор с рТ от 4 до 10 (область скачка рН = 4…10). Поэтому в качестве индикатора в данном случае можно использовать фенолфталеин (рТ = 9).
Методика анализа
Бюретку, предварительно подготовленную к работе в соответствии с правилами работы в аналитической лаборатории, заполняют раствором щелочи, нормальность которой необходимо установить. В колбы для титрования отбирают по 25,00 мл стандартизованного раствора соляной кислоты, 1-2 капли индикатора фенолфталеина и титруют до появления неисчезающей в течение 30 с бледно – розовой окраски. Титрование проводят повторно. Объемы NaOH, пошедшие на титрование, не должны отличаться более чем на 0,10 мл.
Обработка результатов
До титрования были известны значения:
V HCl = 25,00 мл; N HCl  = 0,…. н. В результате титрования определены объемы:
= 0,…. н. В результате титрования определены объемы:
V1 NaOH = ….мл; V2 NaOH = ….мл; Vср NaOH = ….мл.
Расчет нормальности проводят по формуле:
N NaOH = 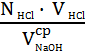
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|