
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Установление нормальности соляной кислоты
Установление нормальности соляной кислоты
Схема титрования
HCl
Na2B4O7
Тетрабората натрия является солью, образованной сильным
основанием и слабой кислотой. Вследствие гидролиза соли образуется сильное основание:
Na2B4O7 + 7 H2O = 2 NaОН + 4H3 BO3. Выделяющаяся щелочь взаимодействует с соляной кислотой: 2NaOH + 2HCl = 2NaCl + 2H2O.
Суммарно:
Na2B4O7 + 2 HCl + 5 H2O = 2 NaCl + 4H3 BO3.
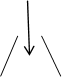
Условие выбора индикатора:
рТинд  э.т.
э.т.
В эквивалентной точке раствор состоит из NaCl – соли сильного основания и сильной кислоты и H3 BO3 - слабой кислоты. Следовательно, рН раствора в эквивалентной точке определяется рН борной кислоты. Расчет величины рН слабой кислоты производится по формуле:
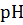 э.т = рН H3 BO3 = 1/2 рК H3 BO3 – 1/2 lg C H3 BO3.
э.т = рН H3 BO3 = 1/2 рК H3 BO3 – 1/2 lg C H3 BO3.
К H3 BO3 (по первой ступени) = 7,1  10-10; рК = 9,15.
10-10; рК = 9,15.
С учетом концентрации стандартного и титруемого раствора количество образующейся борной кислоты можно считать равным 0,1 г – экв.
Отсюда:
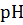 э.т = рН H3 BO3 = 1/2 9,15 – 1/2 lg 10-1 = 5,07.
э.т = рН H3 BO3 = 1/2 9,15 – 1/2 lg 10-1 = 5,07.
Наиболее близкими по показателю титрования (рТ) к этой величине из имеющихся в лаборатории является индикатор метилоранж (рТ = Методика анализа
В две конические колбы отбирают пипеткой 25,00 мл стандартного раствора тетрабората натрия и добавляют 1-2 капли метилоранжа. При введении метилоранжа раствор окрашивается в желтый цвет, характерный для ионной формы индикатора. Титрование раствором HCl проводят до появления оранжевой окраски, которая свидетельствует о наступлении момента эквивалентности. Титрование проводят повторно. Результаты титрования не должны отличаться более чем на 0,10 мл.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|