
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Електронна будова супряжених алкадієнів
Електронна будова супряжених алкадієнів
Чотири атоми Карбону в молекулі бутадієну знаходяться в sp2-гібридизованому стані і лінійно сполучені трьома σ -зв’язками, які напрямлені в просторі під кутом 120° і утворюють остов пласкої молекули. Атоми Карбону також утворюють шість σ -зв’язків з атомами Гідрогену. Після утворення σ -зв’язків у молекулі бутадієну-1, 3 залишаються ще чотири р-орбіталі (по одному негібридизованому р-електрону в кожного атома Карбону), хмари яких перпендикулярні до площини молекули. При бічному перекриванні електронна густина цих 4 р-орбіталей зливається, утворюючи спільну молекулярну орбіталь. Така взаємодія називається π, π -супряженням.
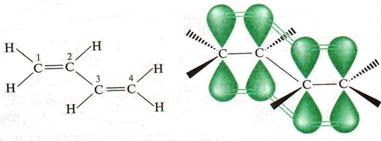
Супряжені дієни відрізняються від простих алкенів тим, що вони:
Хімічні властивості
Для супряжених дієнів, як і для алкенів, характерні реакції приєднання.
1. Гідрування.
а) Гідрування атомарним воднем відбувається переважно в положення 1, 4:
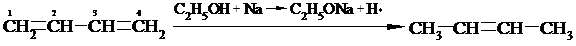
б) Водень при наявності каталізатора приєднується в положення 1, 2- і 1, 4:
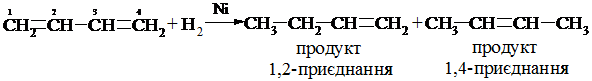
2. Галогенування
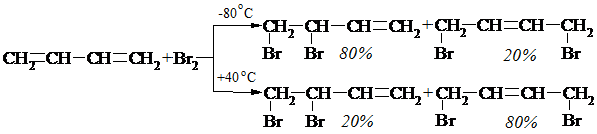
Механізм АЕ:
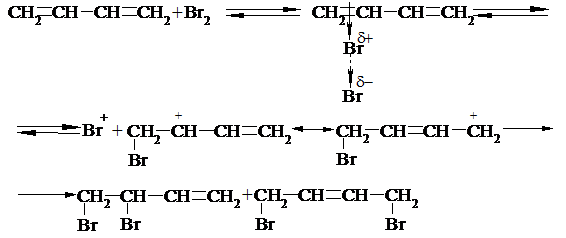
На першій стадії реакції утворюється відносно енергетично стійкий мезомерний алільний карбокатіон, в якому заряд ефективно розосереджений на 2 атомах Карбону (Рис. 3. 1).
При проведенні реакції при низькій температурі вона відбувається в умовах кінетичного контролю, тобто кількість кінцевих сполук – продуктів 1, 2- та 1, 4-приєднання, які утворюються в умовах реакції, визначається відносними швидкостями приєднання. Оскільки ж 1, 2-приєднання вимагає меншої енергії активації (тобто відбувається з більшою швидкістю), здебільшого утворюється продукт 1, 2-приєднання. При підвищенні температури більше значення має відносна стійкість продуктів, які утворюються. Оскільки зворотня реакція продукту 1, 4-приєднання вимагає значно більшої енергії активації (E≠ 1, 4), ніж продукту 1, 2-приєднання (E≠ 1, 2), продукт 1, 4-приєднання термодинамічно більш стійкий. При нагріванні продукт 1, 2-приєднання може ізомеризуватися в продукт 1, 4-приєднання, який є більш енергетично вигідним (Q1, 4> Q1, 2). Тоді співвідношення продуктів приєднання визначається положенням рівноваги між 1, 2- та 1, 4-ізомерами, а реакція проходить в умовах термодинамічного контролю.
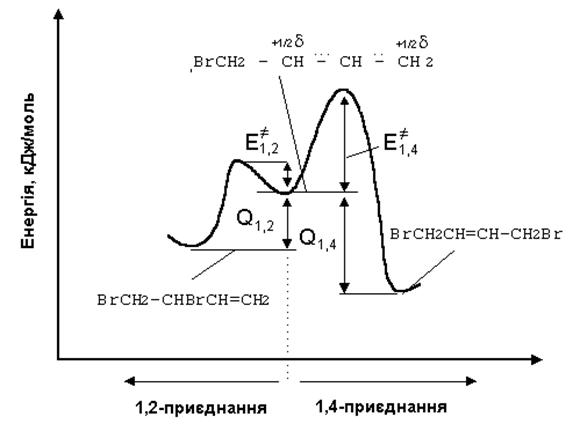
Рис. 3. 1. Енергетична діаграма бромування бутадієну-1, 3
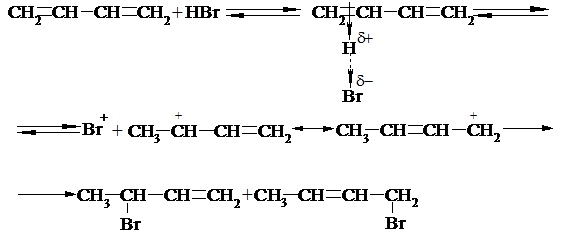
3. Гідрогалогенування. Відбувається аналогічно приєднанню галогенів.

Механізм АЕ:
4. Гіпогалогенування. Незалежно від умов реакції приводить переважно до продукту 1, 2-приєднання, так як цей продукт і швидше утворюється, і більш термодинамічно стійкий.
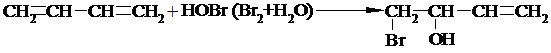
Механізм АЕ (Див. Алкени)
5. Дієновий синтез. Реакція Дільса-Альдера. Дієновим синтезом називають реакцію 1, 4-приєднання до спряжених дієнів речовин, які мають подвійний або потрійний зв’язок, з утворенням ненасичених шестичленних циклічних сполук.
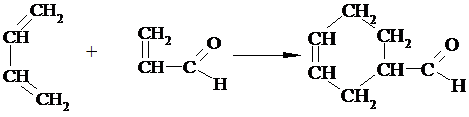
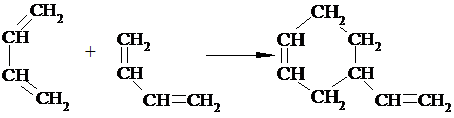

6. Полімеризація
Природний каучук – це цис-1, 4-поліізопрен:

Гутаперча – транс-1, 4-поліізопрен

Основні синтетичні каучуки:
а)синтетичний каучук, що утворюється з бутадієну (СКБ) при використанні каталізаторів Циглера-Натта (Al(С2H5)3+TiCl4):
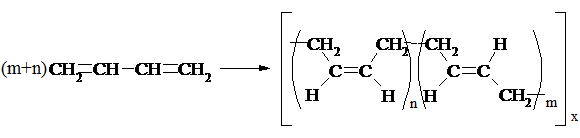
б) синтетичний каучук бутадієн-стирольний (СКС):
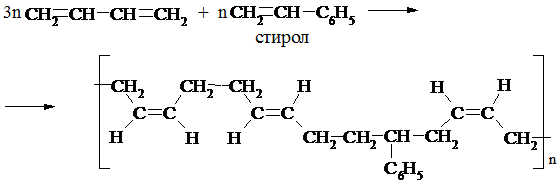
в) синтетичний каучук бутадієн-нітрильний (СКН):
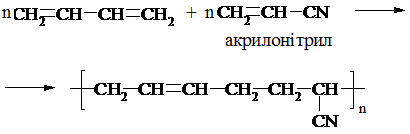
г) синтетичний каучук хлоропреновий (СКХ):
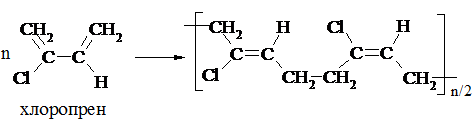
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|