
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Задача. Задача. Закон эквивалентов. Задача
Задача
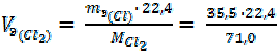
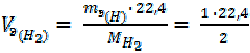
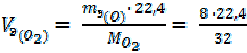 Определить эквивалентные объёмы Cl2, H2 и О2 при н. у.
Определить эквивалентные объёмы Cl2, H2 и О2 при н. у.
1. = 11, 2 л/моль
2. = 11, 2 л/моль
3. = 5, 6 л/моль
Количество эквивалентов вещества равно массе вещества, деленной на его эквивалентную массу, либо объёму газа (н. у. ), деленному на его эквивалентный объём.
n = m
mэ
= Vo
Vэ
(17)
Задача
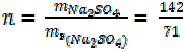 Сколько эквивалентов Na2SO4 содержится в 142 г Na2SO4?
Сколько эквивалентов Na2SO4 содержится в 142 г Na2SO4?
= 2 эквивалента
Сколько эквивалентов газа О2 содержится в 67, 2 л О2 (н. у. )?
n = Vo = 67, 2
= 12 эквивалентов
Vэ 5, 6
Закон эквивалентов
Вещества взаимодействуют друг с другом, а продукты реакций образуются в количествах, пропорциональных их эквивалентам.
Известна и другая формулировка этого закона:
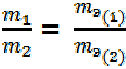
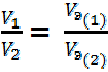 Массы (или объёмы) реагирующих друг с другом и образующихся веществ пропорциональны их эквивалентным массам (или объёмам – для газов), т. е.
Массы (или объёмы) реагирующих друг с другом и образующихся веществ пропорциональны их эквивалентным массам (или объёмам – для газов), т. е.
;
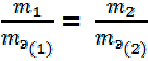
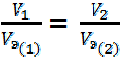
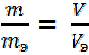 Для решения задач более удобны формулы:
Для решения задач более удобны формулы:
(18)
(19)
(20)
Задача
7, 7 г нитрата трёхвалентного металла прореагировали со щелочью. Образовалось 3, 2 г гидроксида этого металла. Определить эквивалентную массу металла и установить, что это за металл.
Решение
Поскольку оба вещества заданы по массе, воспользуемся формулой (18):
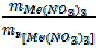
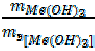 = ;
= ;
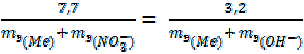 ;
; 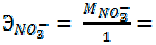 62 г/моль
62 г/моль
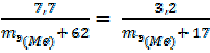
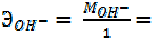 17 г/моль
17 г/моль
Решая уравнение относительно 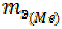 , получим
, получим 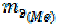 = 15 г/моль.
= 15 г/моль.
Поскольку по уравнению задачи металл трехвалентен, его молярная масса равна:

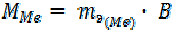 = 15 3 = 45 г/моль
= 15 3 = 45 г/моль
По периодической системе элементов определяем, что металл – скандий.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|