
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
m(раствора) = V(раствора) · ρ(раствора).
m(раствора) = V(раствора) · ρ (раствора).
Как правило, плотность растворов измеряется в г/мл или, что одно и то же, в г/см3. Поэтому при использовании этой зависимости объем раствора должен измеряться в миллилитрах.
ЛЕКЦИЯ 2-3 (5 ЧАСОВ) ЭКВИВАЛЕНТ. ЗАКОН ЭКВИВАЛЕНТОВ
Эквивалентом вещества называют такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях.
Примеры.
В соединении HCl на один моль атомов водорода приходится один моль атомов хлора. Следовательно, эквивалент хлора равен 1 моль атомов хлора.
В соединении H2O на один моль атомов водорода приходится 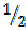 моля атомов кислорода. Следовательно, эквивалент кислорода равен
моля атомов кислорода. Следовательно, эквивалент кислорода равен 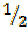 моля атомов кислорода.
моля атомов кислорода.
В соединении NH3 на один моль атомов водорода приходится 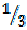 моля атомов азота, поэтому эквивалентом азота в данном соединении является
моля атомов азота, поэтому эквивалентом азота в данном соединении является 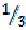 моля атомов азота.
моля атомов азота.
Эквивалентной массой называется масса одного эквивалента вещества.
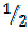
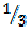 Так, в рассмотренных примерах эквивалентная масса хлора равна массе одного моля атомов хлора, т. е. 35, 5 г/моль, эквивалентная масса кислорода – массе моля атомов кислорода, т. е.
Так, в рассмотренных примерах эквивалентная масса хлора равна массе одного моля атомов хлора, т. е. 35, 5 г/моль, эквивалентная масса кислорода – массе моля атомов кислорода, т. е. 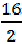 = 8 г/моль, а эквивалентная масса азота – массе моля атомов азота, т. е.
= 8 г/моль, а эквивалентная масса азота – массе моля атомов азота, т. е. 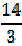 = 4, 67 г/моль.
= 4, 67 г/моль.
| Эквивалентная масса простого вещества массе атома элемента, деленной на валентность: | или | элемента равна молярной |
| mэ = , г/моль | (1) |
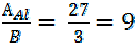
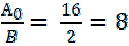
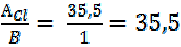
 Например, для алюминия mэ(Al) = г/моль для кислорода mэ(О) = г/моль для хлора mэ(Cl) = г/моль
Например, для алюминия mэ(Al) = г/моль для кислорода mэ(О) = г/моль для хлора mэ(Cl) = г/моль
Эквивалентная масса сложного вещества может быть рассчитана двумя способами.
Оксиды. 1-й способ расчета.
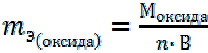 , (2)
, (2)
где: Моксида – молярная масса оксида, г/моль;
n – число атомов оксидообразующего элемента в молекуле оксида; В – валентность этого элемента в данном оксиде.
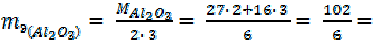
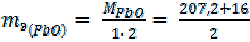
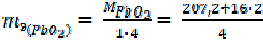
| = 111, 6 г/моль = 59, 8 г/моль |
Оксиды. 2-й способ расчета.
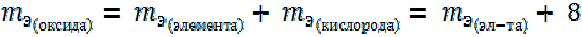
Например:
(3)
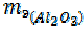
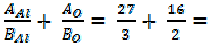
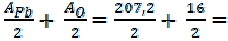 =
= 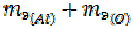 = 9 + 8 = 17 г/моль
= 9 + 8 = 17 г/моль
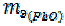 =
= 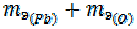 = 103, 6+8=111, 6 г/моль
= 103, 6+8=111, 6 г/моль
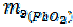 =
= 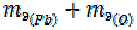 =
= 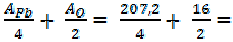 51, 8 + 8=59, 8 г/моль
51, 8 + 8=59, 8 г/моль
Кислоты. 1-й способ расчета.
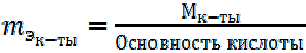 (4)
(4)
Под основностью кислоты понимают число ионов Н+, которое отдает молекула кислоты в реакции с основанием.
Для одноосновных кислот, например, HCl:
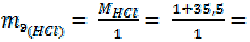 36, 5 г/моль
36, 5 г/моль
Для двух- и трехосновных кислот следует учитывать конкретные реакции. Например, для реакции
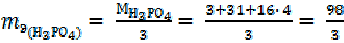 Н3РО4 + 3NaOH = Na3PO4 + 3H2O (5)
Н3РО4 + 3NaOH = Na3PO4 + 3H2O (5)
= 32, 7 г/моль
Для реакции
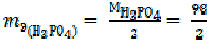 Н3РО4 + 2NaOH = Na2НPO4 + 2H2O (6)
Н3РО4 + 2NaOH = Na2НPO4 + 2H2O (6)
= 49 г/моль
Для реакции
Н3РО4 + NaOH = NaН2PO4 + H2O (7)
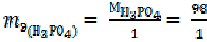 = 98 г/моль
= 98 г/моль
Кислоты. 2-й способ расчета.
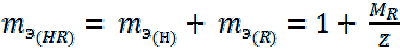 (8)
(8)
где R – кислотный остаток;
МR – молярная масса кислотного остатка;
Z – абсолютная величина заряда иона кислотного остатка.
Примеры:
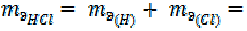
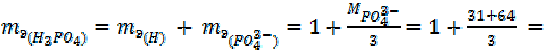
| 1 + 35, 5 = 36, 5 г/моль |
2.
= 1 + 31, 7 = 32, 7 г/моль
– для реакции по уравнению (5)
3. 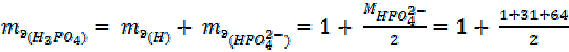 =
=
= 1 + 48 = 49 г/моль
– 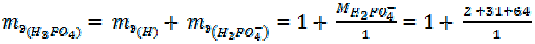 для реакции по уравнению (6)
для реакции по уравнению (6)
4. =
= 1 + 97 = 98 г/моль
– для реакции по уравнению (7)
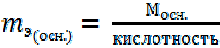 Основания. 1-й способ расчета.
Основания. 1-й способ расчета.
(9)
Под кислотностью основания понимают число гидроксильных групп 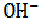 ,
,
отданных молекулой основания при взаимодействии с кислотой.
Для однокислотных оснований, например NaOH
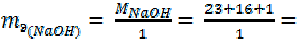 40 г/моль
40 г/моль
Для многокислотных оснований следует учитывать конкретные реакции.
Например, для реакции:
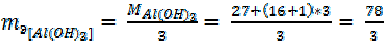 Al(OH)3 + 3HCl = AlCl3 + 3H2O (10)
Al(OH)3 + 3HCl = AlCl3 + 3H2O (10)
= 26 г/моль
Для реакции:
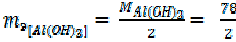 Al(OH)3 + 2HCl = AlОНCl2 + 2H2O (11)
Al(OH)3 + 2HCl = AlОНCl2 + 2H2O (11)
= 39 г/моль
Для реакции:
Al(OH)3 + HCl = Al(ОН) 2 Cl+ H2O (12)
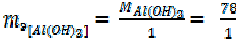 = 78 г/моль
= 78 г/моль
Основания. 2-й способ расчета.
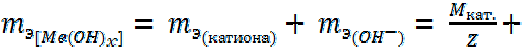 17 (13)
17 (13)
где Мкат. – молярная масса катиона образованной соли; Z – заряд этого катиона.
Примеры:
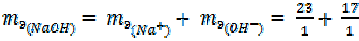
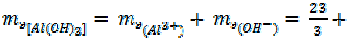 1. = 40 г/моль
1. = 40 г/моль
2. 17 = 26 г/моль
– для реакции по уравнению (10)
3. 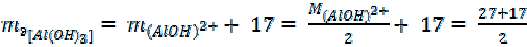 =
=
= 22 + 17 = 39 г/моль
– 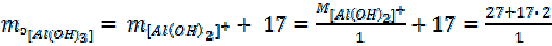 для реакции по уравнению (11)
для реакции по уравнению (11)
4. +17=
= 61 + 17 = 78 г/моль
– для реакции по уравнению (12)
Соли. 1-й способ расчета.
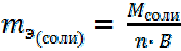
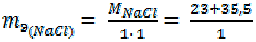
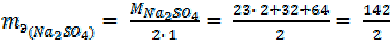
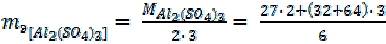
| = 58, 5 г/моль |
Например,
(14)
= 71 г/моль
= 57 г/моль
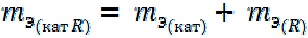
Соли. 2-й способ расчета.
где R – кислотный остаток; Кат – катион соли.
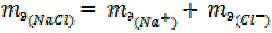
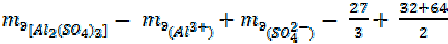 Например, = 23 + 35, 5 = 58, 5 г/моль
Например, = 23 + 35, 5 = 58, 5 г/моль
=
= 9 + 48 = 57 г/моль
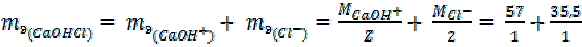 =
=
= 92, 5 г/моль
 =
=
= 106 г/моль
Эквивалентная масса кристаллогидрата равна сумме эквивалентных масс безводного вещества и воды с учетом количества молекул воды.
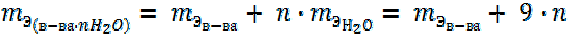 (15)
(15)
В окислительно-восстановительных реакциях эквивалентная массаокислителя или восстановителя равна его молярной массе, деленной на число электронов, принятых или отданных одним атомом, входящим в состав молекулы окислителя или восстановителя.
Пример:
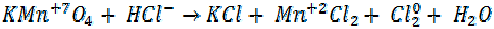
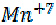
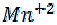 + 5e = восстановление, KMnO4 - окислитель
+ 5e = восстановление, KMnO4 - окислитель
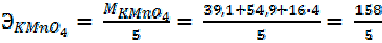
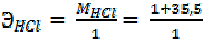
| = 36, 5 г/моль |
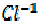 - e =
- e = 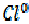 окисление, HCl – восстановитель В результате ОВР марганец принял 5е, хлор отдал 1е. Поэтому:
окисление, HCl – восстановитель В результате ОВР марганец принял 5е, хлор отдал 1е. Поэтому:
= 31, 6 г/моль
При расчетах газообразных соединений более удобно пользоваться значениями эквивалентного объёма.
Эквивалентным объёмом называется объём, занимаемый при данных условиях одним эквивалентом газообразного вещества.
В общем виде эквивалентный объём газа рассчитывается по формуле:
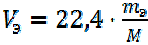 , (16)
, (16)
Для газов, состоящих из одноатомных молекул (гелий и все благородные газы), это 22, 4 л/моль.
Для водорода, фтора и хлора, молекулы которых состоят из двух атомов
(H2, F2, Cl2), эквивалентный объём 11, 2 л/моль.
Эквивалентный объём кислорода 5, 6 л/моль.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|