
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
CH3CHO + H2 C2H5OH. CH3OK+ H2O KOH + CH3OH. СН3COOCH3 + H2O CH3COOH + CH3OH
CH3CHO + H2 C2H5OH
(CH3COO)2Ca 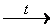 (CH3)2CO + CaCO3
(CH3)2CO + CaCO3
Карбоновые кислоты и их производные:
CH3OK+ H2O KOH + CH3OH
CH3COOK + KOH 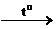 CH4 + K2CO3
CH4 + K2CO3
СН3COOCH3 + H2O CH3COOH + CH3OH
Далее привожу примеры заданий практической части для отработки материала по части С3.
ПРАКТИЧЕСКАЯ ЧАСТЬ:
Задания С3: Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) ацетат калия à этан à X à этанол à диэтиловый эфир
2) CaC2à этин à этаналь 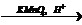 X1
X1 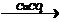 X2
X2 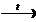 X3
X3
3) Al4C3 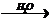 X1
X1 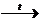 X2
X2  этаналь
этаналь 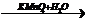 X3
X3  X1
X1
4) CaC2à этинà этаналь 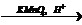 X1
X1 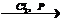 X2
X2 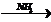 X3
X3
5) CaC2 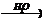 X1
X1 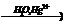 X2→ H3C–COOH
X2→ H3C–COOH 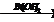 X3→ (CH3)2–C=O
X3→ (CH3)2–C=O
6) HC 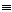 CH
CH 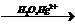 X1
X1 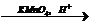 CH3COOH
CH3COOH 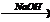 X2
X2 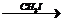 X3
X3 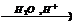 уксусная кислота
уксусная кислота
7) Метилат калия 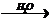 Х1à бромметан
Х1à бромметан 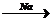 Х2
Х2 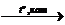 Х3
Х3 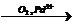 этаналь
этаналь
8) Ацетальдегид ® ацетат калия ® этановая кислота ® этилацетат ® ацетат кальция ® ацетон
9) CH3CHO 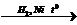 Х1
Х1 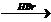 Х2à этилен à CH3CHO
Х2à этилен à CH3CHO 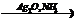 X3
X3
10) CH3COOHà X1 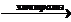 С2H6
С2H6 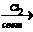 X2
X2 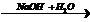 X3
X3  X4
X4
11) C2H5OH 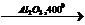 X1
X1 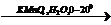 X2
X2 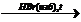 X3
X3 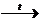 этин
этин  C2H4O
C2H4O
12) CH2BrCH2CH2Br 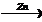 X1
X1 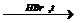 X2à пропен
X2à пропен 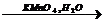 X3à 1, 2- дибромпропан
X3à 1, 2- дибромпропан
13) CH4 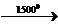 X1à C6H6
X1à C6H6 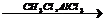 X2
X2 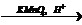 X3
X3 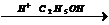 X4
X4
14) карбид алюминия 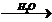 Х1
Х1 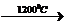 Х2
Х2 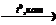 бензол
бензол 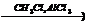 X3
X3 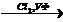 X4
X4
15) 1-хлорпропан 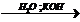 Х1
Х1 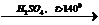 X2
X2 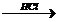 X3
X3 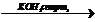 X2à изопропилбензол
X2à изопропилбензол
16) этен 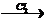 X1
X1 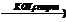 X2
X2  X3à толуол
X3à толуол 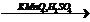 X4
X4
17) C2H4à C2H4Cl2  X1
X1  X2
X2 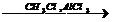 X3
X3 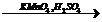 C6H5CООН
C6H5CООН
18) CH3CH2CH2OHà X1 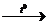 C6H14
C6H14 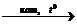 X2
X2 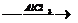 C6H5СН3à C6H5CООН
C6H5СН3à C6H5CООН
19) С2Н2  Х1®C6H5С2Н5
Х1®C6H5С2Н5 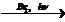 X2
X2  X3
X3 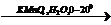 X4
X4
20) ацетилен  бензол
бензол  этилбензол
этилбензол 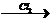 X1
X1  X2
X2  полистирол
полистирол
21) C6H6→ C6H5CH3à C6H5CООНà C6H5CООCH3à CH3OHà (CH3)2O (укажите условия проведения реакций).
22)  Укажите условия протекания 1, 2, 3-й реакций.
Укажите условия протекания 1, 2, 3-й реакций.
23) C2H2→ X1→ X2→ C6H5CH3→ NO2–C6H4–CH3 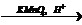 X3
X3
24) CH3-CH2-CH(CH3)-CH3 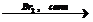 X1
X1 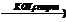 X2
X2 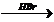 X1
X1 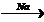 X3à CO2
X3à CO2
25) CH4à HCHO 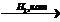 X1
X1 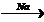 X2
X2 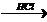 X1
X1 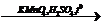 X3
X3
26) пропилацетат 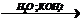 X1à CH4
X1à CH4 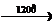 X2
X2  винилацетат
винилацетат 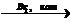 X3
X3
27) CH3-CH2-CHO 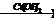 X1
X1 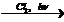 X2
X2 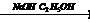 X3
X3 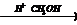 X4
X4 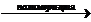 X5
X5
28) Ацетат калия 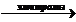 X1
X1  X2
X2 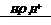 X3
X3 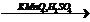 X4
X4 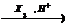 X5
X5
29) этанол 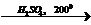 Х1
Х1  Х2
Х2 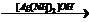 Ag2C2
Ag2C2  X2
X2 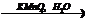 X3
X3
30) C6H6→ C6H5-CH(CH3)2 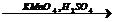 X1
X1 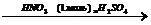 X2
X2  X3
X3 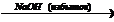 X4
X4
Элементы ответов на задания практической части:
Задание 1
1) Электролиз раствора ацетата калия:
K(-) (K+) – не восстанавливается, щелочной металл
2H2O + 2ē = H2+ 2OH– | 2
А(+) 2CH3COO––2ē = CH3-CH3 + 2CO2 | 2
Суммарное уравнение:
2CH3COO– + 2H2O = H2+ 2OH– + CH3-CH3 + 2CO2
Или 2CH3COOK + 2H2O = H2+ 2KOH + CH3-CH3 + 2CO2
2) При нагревании этана в присутствии катализатора Ni, Pt, происходит дегидрирование, X – этен: CH3-CH3  CH2=CH2 + H2
CH2=CH2 + H2
3) Следующая стадия – гидратация этена:
CH2=CH2 + H2O  CH3-CH2OH;
CH3-CH2OH;
4) Перманганат калия в кислой среде – сильный окислитель и окисляет спирты до карбоновых кислот:
5C2H5OH + 4KMnO4 + 6H2SO4 = 5CH3COOH + 4MnSO4 + 2K2SO4 + 11H2O
5) Наконец, взаимодействие уксусной кислоты и спирта приведет к образованию сложного эфира:
CH3COOH + C2H5OH = CH3COOC2H5 + H2O
Задание 2
1) CaC2 + 2H2O → Ca(OH)2 + C2H2
2) C2H2 + H2O 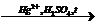 CH3СHO
CH3СHO
3) 5CH3СHO + 2KMnO4 + 3H2SO4 → 5CH3COOH + K2SO4 + 2MnSO4 + 3H2O
4) 2CH3COOH + CaCO3 → (CH3COO)2Ca + H2O + CO2
5) (CH3COO)2Ca 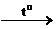 CaCO3 + (CH3)2CO
CaCO3 + (CH3)2CO
Задание 3
1) Al4C3 + 12H2O= 3CH4 + 4 Al(OH)3
2) 2 CH4à C2H2 + 3H2
3) C2H2 + H2O 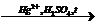 CH3СHO
CH3СHO
4) 3CH3СHO + 2KMnO4 + 3H2O → 2CH3COOK+ CH3COOH+ 2MnO2 + H2O
5) CH3COOK + KOH 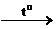 CH4 + K2CO3
CH4 + K2CO3
Задание 4
1) CaC2 + 2H2O → Ca(OH)2 + C2H2
2) C2H2 + H2O 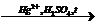 CH3СHO
CH3СHO
3) 5CH3СHO + 2KMnO4 + 3H2SO4 → 5CH3COOH + K2SO4 + 2MnSO4 + 3H2O
4) 2CH3COOH + Cl2 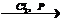 CH2ClCOOH + HCl
CH2ClCOOH + HCl
5) CH2ClCOOH + NH3à CH2(NH2)COOH + HCl
20) CaC2 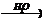 X1
X1 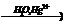 X2→ H3C–COOH
X2→ H3C–COOH 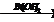 X3→ (CH3)2–C=O
X3→ (CH3)2–C=O
Задание 5
1) CaC2 + 2H2O → Ca(OH)2 + C2H2
2) Н-С≡ С-Н 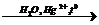 H3C – COH
H3C – COH
3) H3C–COH +2Сu(ОН)2 → H3C–COOH +Сu2О + 2Н2О
4) 2H3C–COOH + Ba(OH)2 → (СН3COO)2Ba + 2Н2О
5) (СН3COO)2Ba (к) 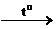 (CH3)2–C=O + BaCO3
(CH3)2–C=O + BaCO3
Задание 6
1) Н-С≡ С-Н 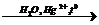 H3C – COH
H3C – COH
2) 5CH3СHO + 2KMnO4 + 3H2SO4 → 5CH3COOH + K2SO4 + 2MnSO4 + 3H2O
3) H3C–COOH + NaOH→ СН3COONa + Н2О
4) СН3COONa + CH3I à СН3COOCH3 + NaI
5) СН3COOCH3 + H2O 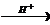 CH3COOH + CH3OH
CH3COOH + CH3OH
Задание 7
1) CH3OK+ H2O 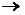 KOH + CH3OH
KOH + CH3OH
2) CH3OH + HBr 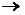 CH3Br + H2O
CH3Br + H2O
3) 2CH3Br + 2Na  С2H6 + 2NaBr
С2H6 + 2NaBr
4) С2H6  C2H4 + H2
C2H4 + H2
5) 2C2H4 + O2 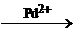 2CH3CHO
2CH3CHO
Задание 8
Ацетальдегид ® ацетат калия ® этановая кислота ® этилацетат ® ацетат кальция ® ацетон. Перепишем:
CH3CHO ® CH3COOK ® CH3COOH ® CH3COOC2H5 ® (CH3COO)2Ca ® (CH3)2CO
Тип реакции может подсказать сравнение состава исходного и получаемого веществ. Так, для первого превращения видно, что необходимо окислить альдегид в щелочной среде, например:
1) CH3CHO + 2KMnO4 + 3KOH ® CH3COOK + 2K2MnO4 + 2H2O
2) CH3COOK + HCl = CH3COOH + KCl
3) CH3COOH + C2H5OH 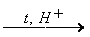 CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
4) Чтобы из эфира получить ацетат, надо провести его гидролиз в щелочной среде, причем в качестве щелочи взять гидроксид кальция:
2CH3COOC2H5 + Ca(OH)2 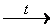 (CH3COO)2Ca + 2C2H5OH
(CH3COO)2Ca + 2C2H5OH
5) Особую сложность может вызвать последнее превращение, поскольку способы получения кетонов в базовом курсе химии обычно не рассматриваются. Для его осуществления проводят пиролиз (термическое разложение) ацетата кальция:
(CH3COO)2Ca 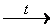 (CH3)2CO + CaCO3
(CH3)2CO + CaCO3
Задание 9
1) CH3CHO + H2 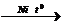 C2H5OH
C2H5OH
2) C2H5OH + HBr à C2H5Br + H2O
3) C2H5Br + KOH (спирт) à C2H4 + KBr + H2O
4) 2C2H4 + O2 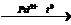 2 CH3CHO
2 CH3CHO
5) CH3CHO + Ag2O + NH3 à CH3COONH4 + 2Ag
Задание 10:
1) CH3COOH + KOHà CH3COOK + H2O
2) CH3COOK + 2H2O 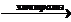 H2+ 2KOH + CH3-CH3 + 2CO2
H2+ 2KOH + CH3-CH3 + 2CO2
3) CH3-CH3 + Cl2 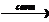 CH3-CH2Cl + HCl
CH3-CH2Cl + HCl
4) CH3-CH2Cl + NaOH (водн) à CH3-CH2-OH +NaCl
5) 2CH3-CH2-OH  H2O + CH3-CH2-O-CH2-CH3
H2O + CH3-CH2-O-CH2-CH3
Задание 11
1) C2H5OH 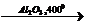 CH2=CH2 + H2O
CH2=CH2 + H2O
2) 3CH2=CH2 + 2KMnO4 + 4H2O 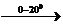 3CH2OH-CH2OH + 2MnO2 + 2KOH
3CH2OH-CH2OH + 2MnO2 + 2KOH
3) CH2OH-CH2OH + 2HBr 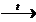 CH2BrCH2Br +2H2O
CH2BrCH2Br +2H2O
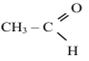 4) CH2BrCH2Br +2KOH (спирт)
4) CH2BrCH2Br +2KOH (спирт) 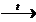 Н-С≡ С-Н + 2H2O +2KBr
Н-С≡ С-Н + 2H2O +2KBr
5) Н-С≡ С-Н +H2O 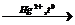
Задание 12
1) CH2BrCH2CH2Br + Zn 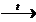 CH2=CH2CH3 + ZnCl2
CH2=CH2CH3 + ZnCl2
2) CH2=CH2CH3+ HBr 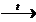 CH3-CH2BrCH3
CH3-CH2BrCH3
3) CH3-CH2BrCH3 +KOH (спирт) à CH2=CH2CH3 + KBr
4) CH2=CH2CH3 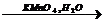 CH2(OH)-CH(OH)-CH3
CH2(OH)-CH(OH)-CH3
5) CH2(OH)-CH(OH)-CH3 + 2HBr 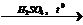 CH2BrCH2BrCH3 + 2H2O
CH2BrCH2BrCH3 + 2H2O
Задание 13
1) 2CH4 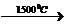 C2H2 + 3H2
C2H2 + 3H2
2) 3C2H2 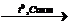 C6H6
C6H6
3) C6H6 + CH3Cl 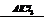 C6H5CH3 + HCl
C6H5CH3 + HCl
4) C6H5CH3 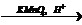 C6H5-COOH
C6H5-COOH
5) C6H5-COOH 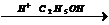 C6H5-COOC2H5 +H2O
C6H5-COOC2H5 +H2O
Задание 14
1) Al4C3 + 12H2O= 3CH4 + 4 Al(OH)3
2) 2CH4 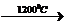 C2H2 + 3H2
C2H2 + 3H2
3) 3C2H2 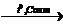 C6H6
C6H6
4) C6H6 + CH3Cl 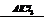 C6H5CH3 + HCl
C6H5CH3 + HCl
5) C6H5CH3 + Cl2 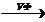 C6H5CH2Cl +HCl
C6H5CH2Cl +HCl
Задание 15:
1) H2CCl-CH2-CH3 + KOH (водн) à KCl + H2COH-CH2-CH3
2) H2COH-CH2-CH3 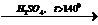 H2C=CH2-CH3 + H2O
H2C=CH2-CH3 + H2O
3) H2C=CH2-CH3 + HCl à H3C-CH2Cl-CH3
4) H3C-CH2Cl-CH3 + KOH (спирт)à H2C=CH2-CH3 + KCl
5) 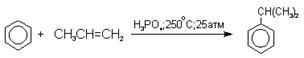
Задание 16 и 17
1) С2H4 + Cl2 à CH2Cl-CH2Cl
2) CH2Cl-CH2Cl + 2KOH (спирт)à C2H2 +2KCl + 2H2O
3) 3C2H2 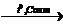 C6H6
C6H6
4) C6H6 + CH3Cl 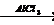 C6H5CH3 + HCl
C6H5CH3 + HCl
5) 5H3C–C6H5+6КМnО4 + 9Н2SO4→ 5C6H5CООН +3К2SO4+ 6МnSО4+14Н2O (возможно использование другого окислителя)
Задание 18:
1) CH3CH2CH2OH + НСl→ CH3CH2CH2Сl + Н2O
2) CH3CH2CH2Сl + 2Nа 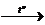 C6H14 +2NаСl
C6H14 +2NаСl
3) C6H14  C6H6 + 4Н2
C6H6 + 4Н2
4) C6H6 + СН3Сl 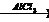 H3C–C6H5+ НСl
H3C–C6H5+ НСl
5) 5H3C–C6H5+6КМnО4 + 9Н2SO4→ 5C6H5CООН +3К2SO4+ 6МnSО4+14Н2O (возможно использование другого окислителя)
Задание 19
1) 3C2H2  C6H6
C6H6
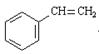
2) C6H6 + С2Н5Cl 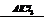 HCl+ C6H5С2Н5
HCl+ C6H5С2Н5
3) C6H5С2Н5 + Br2 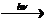 C6H5СНBrСH3 + HBr
C6H5СНBrСH3 + HBr
4) C6H5СНBrСH3 + KOH (спирт) 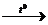
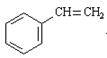 + KBr + H2O
+ KBr + H2O
5) 3 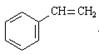 +2KMnO4 + 4H2O
+2KMnO4 + 4H2O 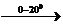 3
3 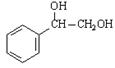 + 2MnO2 + 2KOH
+ 2MnO2 + 2KOH
Задание 20
1) 3C2H2  C6H6
C6H6
2) C6H6 + С2Н5Cl 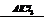 HCl+ C6H5С2Н5
HCl+ C6H5С2Н5
3) C6H5С2Н5 + Cl2 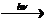 C6H5СНClСH3 + HCl
C6H5СНClСH3 + HCl
4) C6H5СНClСH3 + KOH (спирт) 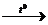
 + KCl + H2O
+ KCl + H2O
5) n ( 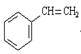 )
) 
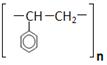
Задание 21
1) C6H6 + CH3Cl 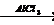 C6H5CH3 + HCl
C6H5CH3 + HCl
2) 5H3C–C6H5+6КМnО4 + 9Н2SO4→ 5C6H5CООН +3К2SO4+ 6МnSО4+14Н2O
3) C6H5CООН + CH3OH 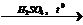 C6H5CООCH3 +H2O
C6H5CООCH3 +H2O
4) C6H5CООCH3 + NaOH 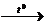 C6H5CООNa + CH3OH
C6H5CООNa + CH3OH
5) 2CH3OH 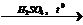 CH3-O-CH3 + H2O
CH3-O-CH3 + H2O
Задание 22:
1) C6H12O6 ® 2C2H5OH + 2CO2 (р-я идет в присутствии ферментов)
2) C2H5OH + HCl ® C2H5Сl + H2O
3) C2H5Сl + C6H6 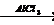 CH3–CH2–C6H5
CH3–CH2–C6H5
4) CH3–CH2–C6H5 + Сl2 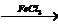 CH3–CH2–C6H4Cl + HCl
CH3–CH2–C6H4Cl + HCl
5) CH3–CH2–C6H4Cl + 6[O] ® C6H4Cl–COOH + 2H2O + CO2
Задание 23:
1) 3C2H2  C6H6
C6H6
2) C6H6 + Cl2  C6H5Cl + HСl
C6H5Cl + HСl
3) C6H5Cl + CH3Cl + 2Na 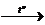 C6H5CH3 + 2NaCl
C6H5CH3 + 2NaCl
4) C6H5CH3 + HNO3 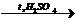 NO2–C6H4–CH3 + H2O
NO2–C6H4–CH3 + H2O
5) 5NO2–C6H4–CH3 + 6КМnО4 + 9Н2SO4→ 5NO2–C6H4–CООН +3К2SO4+ 6МnSО4 + 14Н2O (возможно использование другого окислителя)
Задание 24:
1) CH3-CH2-CH(CH3)-CH3 + Br2 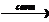 CH3-CH2-CBr(CH3)-CH3 + HBr
CH3-CH2-CBr(CH3)-CH3 + HBr
2) CH3-CH2-CBr(CH3)-CH3 + KOH 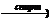 CH3-CH2=C(CH3)-CH3 + H2O +KBr
CH3-CH2=C(CH3)-CH3 + H2O +KBr
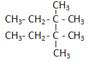 3) CH3-CH2-CBr(CH3)-CH3 + HBr
3) CH3-CH2-CBr(CH3)-CH3 + HBr  CH3-CH2-CBr(CH3)-CH3
CH3-CH2-CBr(CH3)-CH3
4) CH3-CH2-CBr(CH3)-CH3 + 2Na  2NaBr +
2NaBr +
5) 2C10H22 + 31 O2à 20 CO2 + 22 H2O
Задание 25:
1) CH4 + O2 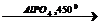 HCHO + H2O
HCHO + H2O
2) HCHO + H2 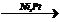 CH3OH
CH3OH
3) 2CH3OH + 2Naà 2CH3ONa +H2
4) CH3ONa + HCl à CH3OH +NaCl
5) 5CH3OH + 2KMnO4 +3H2SO4 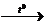 5HCHO + 2MnSO4 + K2SO4 + 8H2O
5HCHO + 2MnSO4 + K2SO4 + 8H2O
Задание 26:
1) CH3COO-CH2CH2CH3 +KOH 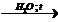 CH3COOK + CH2CH2CH3OH
CH3COOK + CH2CH2CH3OH
2) CH3COOK + KOH 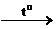 CH4 + K2CO3
CH4 + K2CO3
3) 2CH4 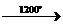 C2H2 + 3H2
C2H2 + 3H2
4) C2H2 + CH3COOH 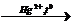 СН3СООСН=СН2 +H2O
СН3СООСН=СН2 +H2O
5) СН3СООСН=СН2 + Br2 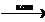 СН3СООСНBr-СН2Br
СН3СООСНBr-СН2Br
Задание 27:
1) CH3-CH2-CHO + 2Сu(OH)2à CH3-CH2-COOH + Сu2О + 2Н2О
2) CH3-CH2-COOH + Cl2 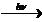 CH3-CHCl-COOH + HCl
CH3-CHCl-COOH + HCl
3) CH3-CHCl-COOH +NaOH (спирт)à CH2=CH-COOH +NaCl + H2O
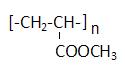 4) CH2=CH-COOH + CH3OH
4) CH2=CH-COOH + CH3OH 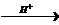 CH2=CH-COOCH3 + H2O
CH2=CH-COOCH3 + H2O
5) nCH2=CH-COOCH3 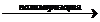
Задание 28:
Смотри ответ на задание №1
Сложность данной цепочки в том, что если не знать первой реакции, понять о каких веществах идет речь в остальной ее части невозможно.
Задание 29:
1) C2H5OH 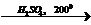 CH2=CH2+H2O
CH2=CH2+H2O
2) CH2=CH2  HC≡ CH + H2
HC≡ CH + H2
3) HC≡ CH + 2[Ag(NH3)2]OH à AgC≡ CAg +4NH3 + 2H2O
4) AgC≡ CAg + 2HCl à HC≡ CH + 2AgCl
5) 3HC≡ CH + 8KMnO4 à 3K2C2O4 + 2KOH + 2H2O + 8 MnO2
Задание 30:
1) C6H6 + CH2=CH-CH3 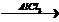 C6H5-CH(CH3)2
C6H5-CH(CH3)2
2) C6H5-CH(CH3)2 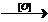 C6H5-COOH
C6H5-COOH
3) 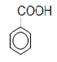 + HNO3
+ HNO3 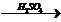
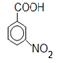 + H2O
+ H2O
4) 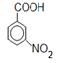 + 6[H]
+ 6[H] 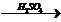
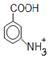 + 2H2O
+ 2H2O
5) 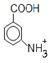 + NaOHà
+ NaOHà  + H2O
+ H2O
Список литературы:
1. Демонстрационные варианты КИМ [электронный ресурс]/ подготовлен Федеральным государственным научным учреждением «ФИПИ»// Федеральный институт педагогических измерений. – Режим доступа: http: //www. fipi. ru - (26. 02. 2009)
2. Единый государственный экзамен 2009. Химия. Универсальные материалы для подготовки учащихся. [текст]/ А. А. Каверина, А. С. Корощенко, Ю. Н. Медведев, А. В. Яшукова. – ФИПИ. - М.: Интеллект-центр, 2009. – 272с.
3. ЗаданияС3 ЕГЭ по химии (2004-2005 г)[электронный ресурс]/ Г. М. Можаев //Контрен - Химия - Образование - Информационные технологии. – Режим доступа: http: //kontren. narod. ru/index. html - (26. 02. 2009)
4. Кузнецова, Н. Е. Химия: Учебник для учащихся 10 класса общеобразовательных учреждений (профильный уровень) [текст]/ Н. Е. Кузнецова, И. М. Титова, Н. Н. Гара. – М.: Вентана-Граф, 2005. -384с.: ил.
5. Кузьменко, Н. Е. Химия. Для школьников старших классов и поступающих в ВУЗы[текст]/ Н. Е. Кузьменко и др. – М.: Дрофа, 1997. -528с.: ил.
6. Лиманская, С. В. Методические особенности подготовки к выпускному экзамену по химии (в форме и по материалам единого государственного экзамена) [текст]/ С. В. Лиманская, Т. П. Лунина. - Министерство образования РМ, МРИО, Региональный центр обработки результатов ЕГЭ. – Саранск, 2006. – 68с.
7. Лисин, А. Ф. Органическая химия. Учебное пособие для старших классов средних школ [текст]/А. Ф. Лисин, М. А. Ахметов. – Ульяновск: «Симбирская книга», 1995. -224с.
8. Самое полное издание типовых вариантов реальных заданий ЕГЭ: 2009: Химия [текст]/ авт. -сост. А. С. Корощенко, М. Г. Снастина. – М.: АСТ: Астрель, 2009. – 187с.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|