
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
CH4 + Cl2 CH3Cl + HCl (1 стадия)
Реакция образования хлорметана протекает по цепному механизму, который характеризуется следующими стадиями:
а) инициирование цепи: Сl2 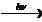 2Сl·
2Сl·
б) Рост цепи. Радикал хлора отнимает у молекулы алкана атом водорода: Cl·+ СН4→ НСl + СН3·
При этом образуется алкильный радикал, который отнимает атом хлора у молекулы хлора: СН3· + Сl2→ СН3Сl + Сl·
Эти реакции повторяются до тех пор, пока не произойдет обрыв цепи по одной из реакций:
Cl· + Cl· → Сl2, СН3· + СН3· → С2Н6, СН3· + Cl· → СН3Сl·
Хлорирование метана не останавливается на стадии получения метилхлорида (если взяты эквимолярные количества хлора и метана), а приводит к образованию всех возможных продуктов замещения, от метилхлорида до тетрахлоруглерода: CH2Cl2, CHCl3, ССl4. Хлорирование других алканов приводит к смеси продуктов замещения водорода у разных атомов углерода. Соотношение продуктов хлорирования зависит от температуры. Скорость хлорирования первичных, вторичных и третичных атомов зависит от температуры, при низкой температуре скорость убывает в ряду: третичный, вторичный, первичный. При повышении температуры разница между скоростями уменьшается до тех пор, пока не становится одинаковой. Кроме кинетического фактора на распределение продуктов хлорирования оказывает влияние статистический фактор: вероятность атаки хлором третичного атома углерода в 3 раза меньше, чем первичного и в два раза меньше чем вторичного. Таким образом хлорирование алканов является нестереоселективной реакцией, исключая случаи, когда возможен только один продукт монохлорирования. Бромирование алканов отличается от хлорирования более высокой стереоселективностью из-за большей разницы в скоростях бромирования третичных, вторичных и первичных атомов углерода при низких температурах. Иодирование алканов иодом не происходит, получение иодидов прямым иодированием осуществить нельзя. С фтором реакция протекает со взрывом (как правило, фтор разбавляют азотом или растворителем).
Примеры: CH3-CH2-CH(CH3)-CH3 + Br2 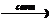 CH3-CH2-CBr(CH3)-CH3 + HBr (на этом примере поясняется правило Марковникова и объясняется устойчивость карбокатионов)
CH3-CH2-CBr(CH3)-CH3 + HBr (на этом примере поясняется правило Марковникова и объясняется устойчивость карбокатионов)
3) Нитрование. Алканы реагируют с азотной кислотой или N2O4 в газовой фазе с образованием нитропроизводных:
СH4+HNO3 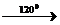 СН3NO2+H2O
СН3NO2+H2O
Все имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов.
4) Крекинг. При нагревании выше 500°С алканы подвергаются пиролитическому разложению с образованием сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции. При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов. В 1930-1950 гг. пиролиз высших алканов использовался в промышленности для получения сложной смеси алканов и алкенов, содержащих от пяти до десяти атомов углерода. Он получил название „термический крекинг“. С помощью термического крекинга удавалось увеличить количество бензиновой фракции за счёт расщепления алканов, содержащихся в керосиновой фракции (10-15 атомов С в углеродном скелете) и фракции солярового масла (12-20 атомов С). Однако октановое число бензина, полученного при термическом крекинге, не превышает 65, что не удовлетворяет требованиям условий эксплуатации современных двигателей внутреннего сгорания. В настоящее время термический крекинг полностью вытеснен в промышленности каталитическим крекингом, который проводят в газовой фазе при более низких температурах - 400-450°С и низком давлении - 10-15 атм на алюмосиликатном катализаторе, который непрерывно регенерируется сжиганием образующегося на нём кокса в токе воздуха. При каталитическом крекинге в полученном бензине резко возрастает содержание алканов с разветвлённой структурой.
А) До 1000° С (пиролиз) CH4 à C + 2H2
Б) Выше 1200° С разлагается по реакции: 2CH4 = C2H2 + 3H2
В) Конверсия метана CH4 + Н2О 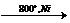 CO + 3H2
CO + 3H2
В заданиях ЕГЭ используется вторая реакция. (выделена синим цветом)
C8H18 → C4H10 + С4Н8; С2Н6 → С2Н2 + 2Н2
5) Изомеризация (перегруппировка). Нормальные алканы при определенных условиях могут превращаться в алканы с разветвленной цепью:
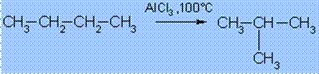
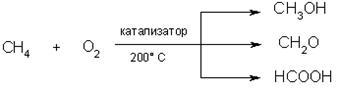
6) Окисление. При мягком окислении метана кислородом воздуха в присутствии различных катализаторов могут быть получены метиловый спирт, формальдегид, муравьиная кислота:
Мягкое каталитическое окисление бутана кислородом воздуха - один из промышленных способов получения уксусной кислоты:
2C4H10 + 5O2  4CH3COOH + 2Н2О.
4CH3COOH + 2Н2О.
7) Дегидрирование (отщепление водорода). Протекает в присутствии катализаторов при повышенной температуре:
С2Н4  Н2+ СН2=СН2
Н2+ СН2=СН2
Получение:
 А) Главным источником алканов (а также других углеводородов) является нефть и природный газ, которые обычно встречаются совместно.
А) Главным источником алканов (а также других углеводородов) является нефть и природный газ, которые обычно встречаются совместно.
 Б) Из карбидов (см. выше)
Б) Из карбидов (см. выше)
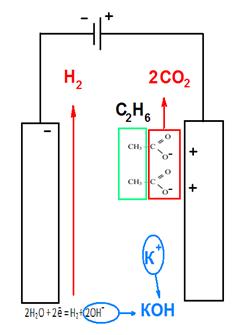
В) Синтез Кольбе. При электролизе солей карбоновых кислот, анион кислоты - RCOO- перемещается к аноду, и там, отдавая электрон превращается в неустойчивый радикал RCOO•, который сразу декарбоксилируется. Радикал R• стабилизируется путем сдваивания с подобным радикалом, и образуется R-R.
Например:
 2CH3COOK+2H2O
2CH3COOK+2H2O  H2+ 2KOH + CH3-CH3 + 2CO2
H2+ 2KOH + CH3-CH3 + 2CO2
Г) Реакция Вюрца. Для увеличения числа атомов углерода в цепи используется реакция Вюрца. Предварительно проводят галогенирование. Реакция идёт в ТГФ при температуре -80°С.
1) 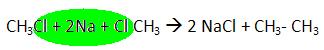 CH4 + Cl2
CH4 + Cl2 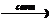 CH3Cl + HCl (1 стадия)
CH3Cl + HCl (1 стадия)
2)
3) CH3CH2CH2Сl + 2Nа 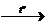 C6H14 +2NаСl
C6H14 +2NаСl
 4) 2CH3Br + 2Na
4) 2CH3Br + 2Na  С2H6 + 2NaBr
С2H6 + 2NaBr
5) CH3-CH2-CBr(CH3)-CH3 + 2Na  2NaBr +
2NaBr +
Д) Cинтез Фишера-Тропша: nCO + (2n+1)H2→ CnH2n+2 + H2O
Е) Взаимодействие алкенов или алкинов с водородом (" гидрирова ние" ) происходит в присутствии металлических катализаторов (Ni, Pd) при
нагревании: СН3-СН=СН2 + Н2 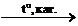 СН3-СН2-СН3
СН3-СН2-СН3
СНз-C≡ СН + 2Н2 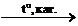 СН3-СН2-СН3.
СН3-СН2-СН3.
Ж)Получение из солей карбоновых кислот. При сплавлении безводных солей карбоновых кислот со щелочами получаются алканы, содержащие на один атом углерода меньше по сравнению с углеродной цепью исходных карбоновых кислот: CH3COONa + NaOH 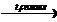 СН4↑ + Na2CO3.
СН4↑ + Na2CO3.
УПРАЖНЕНИЯ по теме:
↘ В качестве итогового примера предлагается цепочка превращений:
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|