
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Mg2C3 + 4H2O= 2Mg(OH)2 + НС=С–СН3
Ульяновский Институт Повышения Квалификации
и Переподготовки Работников Образования
Кафедра Естествознания

Слушателя курсов повышения квалификации
Группы Х1, учителя химии
МОУ Большенагаткинской СОШ
Цильнинского района
Великанова Сергея Геннадьевича
По теме:
Научный руководитель Ахметов М. А.,
заведующий кафедрой естествознания,
кандидат химических наук, доцент.
Ульяновск
2009
СОДЕРЖАНИЕ
Введение…………………………………………………………………………………………………3-4
Методика обучения решению заданий блока С3………………………………..... 5-14
Практические задания……………………………………………………………………………. 15-16
Ответы на задания …………………………………………………………………………………. 17-25
Список литературы …………………………………………………………………………………26
ВВЕДЕНИЕ
 Задания с развернутым ответом – самые сложные в экзаменационной работе. В отличие от заданий с выбором ответа и кратким ответом, они предусматривают одновременную проверку усвоения нескольких (двух и более) элементов содержания из различных содержательных блоков. Задания С3 ( блок химическая реакция ) проверяют усвоение знаний о взаимосвязи веществ различных классов на примерах превращений органических веществ.
Задания с развернутым ответом – самые сложные в экзаменационной работе. В отличие от заданий с выбором ответа и кратким ответом, они предусматривают одновременную проверку усвоения нескольких (двух и более) элементов содержания из различных содержательных блоков. Задания С3 ( блок химическая реакция ) проверяют усвоение знаний о взаимосвязи веществ различных классов на примерах превращений органических веществ.

Необходимыми элементами для выполнения заданий блока С3 являются следующие:
А15. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа. Характерные химические свойства углеводородов: алканов, алкенов, диенов, алкинов. Характерные химические свойства ароматических углеводородов: бензола и толуола.
А16. Характерные химические свойства предельных одноатомных и многоатомных спиртов; фенола.
А17. Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров. Биологически важные вещества: жиры, углеводы (моносахариды, дисахариды, полисахариды), белки.
А18. Взаимосвязь органических веществ
А26. Реакции, характеризующие основные свойства и способы получения углеводородов.
А27. Реакции, характеризующие основные свойства и способы получения кислородсодержащих соединений.
В6. Характерные химические свойства углеводородов: алканов, алкенов, диенов, алкинов. Механизмы реакций замещения и присоединения в органической химии. Правило В. В. Марковникова.
В7. Характерные химические свойства предельных одноатомных и многоатомных спиртов; фенола; альдегидов, предельных карбоновых кислот, сложных эфиров.
Поэтому прежде чем приступить к обучению учащихся решению заданий блока С3, желательно прорешать названные выше элементы, как составляющие части цепочек превращений органических веществ.
За выполнение заданий этого блока учащиеся могут получить максимальный балл 5 (по одному баллу за каждое правильно написанное уравнение реакции). Но большинство заданий построено таким образом, что пока не будут определены предыдущие звенья, невозможно определить последующие.
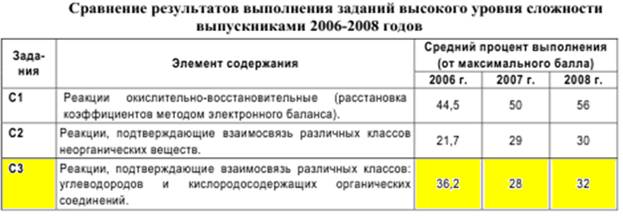 Из приведенной ниже таблицы видно, что задания блока С3 являются наиболее сложными, поскольку при решении заданий этого блока необходимо владеть умением применять знания в новой ситуации: прогнозировать продукт реакции, определять возможности взаимодействия между предложенными веществами и т. д. Предполагается, что с подобными заданиями успешно смогут справиться лишь те выпускники, которые имеют высокий уровень подготовки.
Из приведенной ниже таблицы видно, что задания блока С3 являются наиболее сложными, поскольку при решении заданий этого блока необходимо владеть умением применять знания в новой ситуации: прогнозировать продукт реакции, определять возможности взаимодействия между предложенными веществами и т. д. Предполагается, что с подобными заданиями успешно смогут справиться лишь те выпускники, которые имеют высокий уровень подготовки.
В своей работе я сделал попытку систематизировать и обобщить встречающиеся в различных источниках варианты заданий, расположив их в порядке сложности выполнения и выработать определенную стратегию подготовки учащихся к решению данных заданий.
Методика обучения решению заданий блока С3:
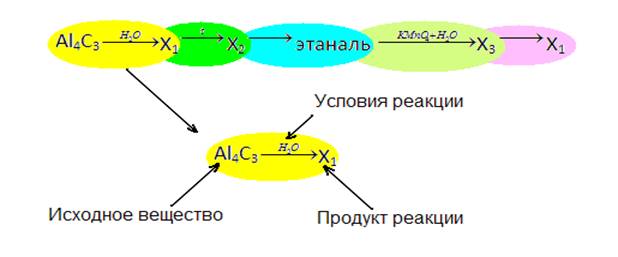 Рассмотрим общую схему построения заданий блока С3 на примере одного из заданий:
Рассмотрим общую схему построения заданий блока С3 на примере одного из заданий:
Как видно из этой схемы цепочка превращений включает в себя 5 звеньев. Каждое звено состоит из трех элементов: исходное вещество, продукт реакции и условия проведения реакций. В заданиях могут встретиться следующие случаи:
1) 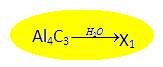 Известно исходное вещество, условие проведения реакции, но неизвестен продукт реакции
Известно исходное вещество, условие проведения реакции, но неизвестен продукт реакции
2) 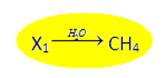 Известен продукт реакции, условие проведения реакции, но неизвестно исходное вещество
Известен продукт реакции, условие проведения реакции, но неизвестно исходное вещество
3) 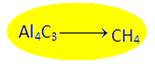 Известно исходное вещество и продукт реакции, но неизвестны условия проведения реакции:
Известно исходное вещество и продукт реакции, но неизвестны условия проведения реакции:
4) 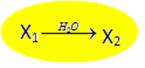 Известны условия проведения реакций, но неизвестны исходные вещества и продукт реакции:
Известны условия проведения реакций, но неизвестны исходные вещества и продукт реакции:
Это один из наиболее сложных и часто втречающихся случаев, так как вещество Х1 определяется как продукт предыдущего звена цепи.
5) 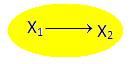 Более редкий, но возможный вариант, когда неизвестно ничего (разновидность предыдущего случая):
Более редкий, но возможный вариант, когда неизвестно ничего (разновидность предыдущего случая):
При обучении учащихся следует учитывать эти особенности и предлагать для тренировки задания различных вариантов.
КАРБИДЫ.
Начать обучение на мой взгляд логичнее всего со взаимосвязи органических и неорганических веществ на примерах гидролиза карбидов, обращая внимание на общее сходство и основное отличие этих реакций:
CaC2 + 2H2Oà Ca(OH)2 + C2H2 (Можно использовать Na2C2, К2С2. Эти карбиды можно рассматривать как производные ацетилена, в которых атомы водорода замещены атомами металла. Взаимодействие карбидов щелочных металлов с водой протекает исключительно бурно. Так, если карбид калия просто облить водой, произойдет бурная реакция, которая сопровождается взрывом такой силы, что выделяющийся ацетилен сразу же разлагается с выделением угля. Чтобы провести реакцию К2С2 + 2Н2О à 2КОН + С2Н2, надо медленно пропускать над карбидом водяной пар. . )
Al4C3 + 12H2O= 3 CH4 + 4 Al(OH)3 (так же гидролизуется карбид бериллия Ве2С )
Mg2C3 + 4H2O= 2Mg(OH)2 + НС=С–СН3
Интересно, что карбид магния другого состава, MgC2, дает при гидролизе только ацетилен:
MgC2 + 2H2O= Mg(OH)2 + C2H2
С выделением почти равных количеств водорода и метана разлагается карбид марганца: Mn3C + 6H2O à 3Mn(OH)2 + CH4 + H2
↘ В цепочках превращений обычно используются карбиды кальция и алюминия.
Далее разбираются характерные химические свойства по различным классам органических соединений (УВ и кислородосодержащих: алканы, циклоалканы, алкены, алкадиены, алкины, ароматические, спирты, фенолы, альдегиды, кетоны, карбоновые кислоты, эфиры, углеводы). При этом особое внимание уделяем наиболее часто встречающимся в заданиях ЕГЭ цепочкам переходов (далее выделены в тексте синим цветом).
Как пример рассмотрим алканы:
АЛКАНЫ:
Алка́ ны (насыщенные углеводороды, парафины) — ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2. Каждый атом углерода в молекулах алканов находится в состоянии sp³ гибридизации. При нормальных условиях алканы с CH4 до C4H10 — газы; с C5H12 до C17H36 — жидкости. И после C18H38 — твёрдые тела. 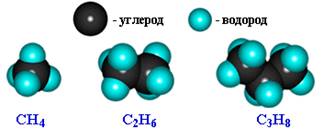
В обычных условиях алканы химически инертны. Они устойчивы к действию многих реагентов: не взаимодействуют с концентрированными серной и азотной кислотами, с концентрированными и расплавленными щелочами, не окисляются сильными окислителями - перманганатом калия KMnО4 и т. п.. Это объясняется тем, что единичные C-H и C-C связи относительно прочны и их сложно разрушить.
1) Горение как реакция характерная для всех органических веществ. В данном случае эта реакция определяет их использование в качестве топлива. Пример: CH4 + 2O2 → CO2 + 2H2O + Q. В случае нехватки кислорода вместо углекислого газа получается угарный газ или уголь.
2) Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-светом или нагреть.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|