
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Заключение 3 страница
Значения энергии электронов на внутренних оболочках практически не зависят от взаимодействия атомов при вступлении их в химические взаимодействия. Поэтому по характеристическим рентгеновским спектрам можно определить присутствие отдельных химических элементов в любых сложных соединениях, в любом агрегатном состоянии вещества.
Молекулярные спектры. Газы, состоящие из молекул, имеют очень много спектральных линий. Эти линии представляют собой систему широких полос. Положение каждой полосы соответствует одному из возможных электронных переходов. Расщепление одного энергетического уровня на полосу близко расположенных подуровней объясняется двумя причинами: колебаниями атомов внутри молекулы и ее вращением.
Энергия колебательного движения молекулы подчиняется законам квантовой физики и имеет дискретный ряд значений. Таким образом, один электронный энергетический уровень разбивается на множество колебательных подуровней. Кроме колебаний отдельных частей молекулы, может происходить вращение молекулы как целого. При вращении молекулы ее энергия увеличивается. Изменения энергии вращательного движения также квантуются. Электронные и колебательные уровни энергии молекулы разбиваются на множество вращательных подуровней. Число возможных переходов резко увеличивается, возникает огромное число линий спектра, сливающихся в широкие полосы.
Сплошной спектр излучения жидких и твердых тел. В жидких и твердых телах атомы и молекулы находятся на близких расстояниях и сильно взаимодействуют друг с другом. Все они принадлежат одной квантовой системе, и поэтому, согласно принципу Паули, их электроны не могут находиться в одинаковых состояниях. Каждый атомный энергетический уровень отдельного атома в твердом или жидком теле расщепляется на N подуровней, где N - число атомов в этом теле.
Однако число N так велико, что энергетические подуровни находятся рядом друг с другом. Энергия электронов в твердом или жидком теле при нагревании изменяется столь малыми порциями, что возможно излучение и поглощение фотонов практически со всеми возможными значениями частоты. Спектр излучения и поглощения твердых и жидких тел оказывается сплошным.
Вопросы
1. На основании какой аналогии де Бройль предположил наличие волновых свойств у микрочастиц?
2. От чего зависит длина волны микрочастицы?
3. В каких экспериментах подтвердилось наличие волновых свойств у микрочастиц?
4. Электрон и протон движутся с одинаковой скоростью. Какой из этих частиц соответствует меньшая длина волны?
5. Какой должна быть постоянная Планка, чтобы волновые свойства стали наблюдаемыми у макротела с массой 1г и скоростью 1 м/с?
6. Может ли длина волны де Бройля какой-нибудь частицы быть больше размеров самой частицы? А меньше?
7. Каков физический смысл волн де Бройля?
8. Какими частицами пользовался Резерфорд при облучении листочков фольги? Каков заряд этих частиц?
9. Перечислите основные особенности рассеяния a-частиц, приведшие Резерфорда к планетарной модели атома?
10. Зачем электроны должны вращаться в модели атома Резерфорда? Почему атом Резерфорда не может существовать?
11. Сформулируйте постулаты Бора. На каких фактах основан первый постулат?
12. Чем определяется частота излучения атома?
13. Укажите различия между моделью атома Резерфорда и теорией Бора.
14. В каких экспериментах подтвердилась дискретность значений энергии электронов в атомах?
15. Какие уравнения описывают движение электрона в модели Бора?
16. По какому закону изменяются радиусы орбит при увеличении их номера?
17. Каков смысл того, что потенциальная энергия электрона в атоме водорода отрицательна и по абсолютной величине больше кинетической энергии?
18. Как зависит энергия электрона от номера орбиты? К какому значению приближается энергия, если r ® ¥ ?
19. В чем заключается процесс ионизации? В каком случае энергия ионизации больше - когда электрон находится на первой орбите или когда на более высокой?
20. Сколько длин волн де Бройля укладывается на первой боровской орбите?
21. В каких случаях наблюдаются спектры излучения, а в каких – поглощения?
22. Почему не испускает света кислород в окружающем нас воздухе?
23. За счет какой энергии электроны атомов могут переходить в возбужденное состояние?
24. Как с помощью схемы спектральных линий (Рис. 5. 4) объяснить, что длины волн серии Лаймана меньше, чем длины волн серий Бальмера и Пашена? Каким участкам спектра соответствуют эти серии?
25. Каковы достоинства и недостатки теории Бора?
26. В каких случаях справедливо стационарное уравнение Шредингера?
27. Запишите уравнение Шредингера для частицы, потенциальная энергия которой равна нулю.
28. Если импульс частицы известен точно, то чему равна неопределенность координаты?
29. Если частице, находящейся в потенциальной яме в состоянии n=1, сообщается энергия, меньшая, чем необходимая для перехода в состояние с n=2, то может ли частица принять эту энергию?
30. При каких n свойства частицы в потенциальной яме подобны свойствам классической частицы?
31. Какой вид имеет потенциальная яма для электрона в атоме водорода?
32. Чем правило квантования момента импульса в современной теории атома отличается от правила квантования Бора?
33. Возможно ли с точки зрения теории Бора состояние 1s? Чему равен момент импульса электрона в этом состоянии?
34. Как зависит вероятность обнаружения электрона в атоме водорода в состоянии 1s от расстояния до ядра? Сопоставьте данные, полученные современной теорией, с теорией Бора.
35. Какой вид имеют электронные облака в 1s и 2р состояниях атома водорода?
36. Какие результаты современной теории свидетельствуют об отсутствии в атоме электронных орбит?
37. Как в классической физике объясняется существование орбитального магнитного момента электрона? спина? спинового магнитного момента?
38. Какое условие для выбора возможных направлений орбитального момента импульса электрона получено в квантовой механике?
39. От чего зависит максимальное число значений проекции орбитального момента на направление магнитного поля?
40. Чему равен спин электрона? Какие значения может принимать проекция спина на направление поля?
41. Какие соображения привели к формулировке принципа Паули?
42. Какие частицы подчиняются принципу Паули?
43. В соответствии с какими принципами заполняются электронные оболочки в многоэлектронных атомах?
44. Почему у калия (Z=19) при незавершенной М-оболочке (состояние 3d) 19-й электрон размещается в следующей N-оболочке (состояние 4s)?
45. Чем объясняется периодическая повторяемость химических свойств элементов?
46. Как объяснить химическую активность щелочных металлов?
47. Почему атомы элементов с полностью застроенными оболочками являются химически инертными?
48. Почему спектры разреженных газов являются линейчатыми?
49. Как объяснить естественную ширину спектральных линий?
50. Как влияет увеличение давления газа и его температуры на ширину спектральных линий?
51. В каких случаях атом может излучать на частотах рентгеновского диапазона?
52. Почему характеристический рентгеновский спектр не зависит от того, в каком соединении находится атом?
53. Как объяснить полосатые молекулярные спектры и сплошные спектры твердых и жидких тел?
Лекция 5. 2 Ядерная физика
В начале XX в. благодаря опытам Резерфорда возникло представление о том, что в центре атома находится очень малое по своим размерам, но массивное ядро. Одновременно с созданием квантовой теории и попытками объяснить строение атома и его электронной оболочки начались исследования и атомного ядра.
5. 2. 1 Заряд и масса ядра. Состав ядра
Оказалось, что ядро достаточно сложно, и в его структуре остается много неясного и по сей день. Тем не менее, в начале 30-х годов ХХ в. была разработана модель атомного ядра, которая по-прежнему находит широкое применение. Согласно этой модели, ядро состоит из частиц двух типов - протонов и нейтронов. Нейтроны и протоны имеют общее наименование - нуклоны.
Протонпредставляет собой ядро простейшего атома - водорода. Он имеет положительный заряд q = +е = 1, 6× 10-19 Кл и массу тр = (1, 6726485 ± 0, 0000086) × 10-27 кг, или приближенно тр= 1, 6726× 10-27 кг.
Нейтрон, существование которого было установлено только в 1932 г. Дж. Чедвиком, электрически нейтрален (q = 0). Масса нейтрона почти совпадает с массой протона: тn = (1, 674954 ± 0, 000009) × 10-27 кг, или округленно тn = 1, 6750× 10-27 кг.
В атомной и ядерной физике массу измеряют в атомных единицах массы (а. е. м), равной 1/12 массы атома углерода 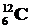 : 1 а. е. м. = 1, 6605402× 10-27 кг, либо в ее энергетическом эквиваленте.
: 1 а. е. м. = 1, 6605402× 10-27 кг, либо в ее энергетическом эквиваленте.
Энергетический эквивалент массы определяется по формуле 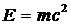 и для 1 а. е. м. равен Е= 1. 6605× 10-27× (2, 9979× 108)2 =1, 4924× 10-10 Дж »931, 5 МэВ.
и для 1 а. е. м. равен Е= 1. 6605× 10-27× (2, 9979× 108)2 =1, 4924× 10-10 Дж »931, 5 МэВ.
Ядро атома водорода состоит из одного протона, тогда как ядра атомов других химических элементов содержат и нейтроны, и протоны. Общее число нуклонов, т. е. нейтронов и протонов, обозначается буквой А и называется массовым числом. Такое название это число получило потому, что произведение А на массу отдельного нуклона очень близко к массе ядра. Массовое число является целым числом, ближайшим к численному значению массы ядра, выраженному в а. е. м.
Измерения заряда ядра были выполнены Г. Мозли в 1913 г. Он установил, что заряд ядра точно равен произведению элементарного заряда на порядковый номер атома в таблице Менделеева:
q=Ze.
В связи с этим порядковый номер элемента называется зарядовым числом. Зарядовое число равно числу протонов в ядре. Нетрудно понять, что число нейтроновв ядре
N = A-Z.
Чтобы охарактеризовать ядро, необходимо указать только А и Z. Обычно химические элементы принято обозначать символом 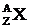 , где Х - символ химического элемента (см. табл. 5. 2), А - массовое число, Z - зарядовое число. Например,
, где Х - символ химического элемента (см. табл. 5. 2), А - массовое число, Z - зарядовое число. Например, 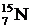 означает ядро атома азота, содержащее 7 протонов и 8 нейтронов, т. е. всего 15 нуклонов. У нейтрального атома число электронов, обращающихся вокруг ядра, равно атомному номеру Z (так как заряд электрона по величине равен заряду протона, но противоположен по знаку). Основные химические свойства атома определяются числом электронов. Следовательно, Z характеризует атом данного химического элемента: углерода, кислорода, золота или какого-нибудь другого элемента.
означает ядро атома азота, содержащее 7 протонов и 8 нейтронов, т. е. всего 15 нуклонов. У нейтрального атома число электронов, обращающихся вокруг ядра, равно атомному номеру Z (так как заряд электрона по величине равен заряду протона, но противоположен по знаку). Основные химические свойства атома определяются числом электронов. Следовательно, Z характеризует атом данного химического элемента: углерода, кислорода, золота или какого-нибудь другого элемента.
В ядрах одного химического элемента (например, углерода) число нейтронов может быть различным, а число протонов всегда одно и то же. Например, в ядрах углерода число протонов всегда равно 6, а число нейтронов может быть равно 5, 6, 7, 8, 9 или 10. Ядра, содержащие одинаковое число протонов, но различное число нейтронов, называются изотопами. Например, 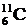 ,
, 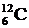 ,
, 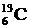 - изотопы углерода. Изотопы имеют практически одинаковые химические свойства. Распространенность изотопов одного и того же элемента неодинакова. Например, 98, 9% встречающегося в природных условиях углерода приходятся на изотоп
- изотопы углерода. Изотопы имеют практически одинаковые химические свойства. Распространенность изотопов одного и того же элемента неодинакова. Например, 98, 9% встречающегося в природных условиях углерода приходятся на изотоп 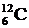 и только примерно 1, 1% - на изотоп
и только примерно 1, 1% - на изотоп 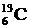 . Многие изотопы не встречаются в природе, но могут быть получены искусственно с помощью ядерных реакций. К ним относятся все трансурановые элементы (Z > 92).
. Многие изотопы не встречаются в природе, но могут быть получены искусственно с помощью ядерных реакций. К ним относятся все трансурановые элементы (Z > 92).
Размеры ядер могут быть измерены лишь приближенно из-за ограничений, накладываемых соотношением неопределенностей (5. 2). Установлено, что ядра имеют примерно сферическую форму, причем радиус R возрастает в зависимости от А согласно приближенной формуле:
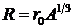 , где r0 = 1. 3× 10-15 м.
, где r0 = 1. 3× 10-15 м.
Так как объем сферы пропорционален R3, то объем ядра пропорционален числу нуклонов: V ~ А. Следовательно, все ядра имеют примерно одинаковую плотность
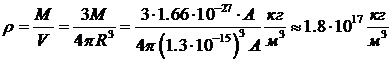 .
.
Это огромная плотность. Плотность ртути, например, «всего» 13. 6× 103 кг.
5. 2. 2 Ядерные силы. Энергия связи ядра
Общая масса покоя ядра МЯ, как показывают точные измерения, всегда меньше суммы масс составляющих его протонов и нейтронов:
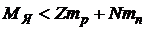
Разность 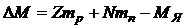 называется дефектом массы. Так как масса пропорциональна энергии
называется дефектом массы. Так как масса пропорциональна энергии 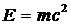 , то энергия ядра меньше, чем энергия составляющих его протонов и нейтронов, находящихся в свободном состоянии. Это означает, что для разделения ядра на отдельные частицы нужно затратить энергию
, то энергия ядра меньше, чем энергия составляющих его протонов и нейтронов, находящихся в свободном состоянии. Это означает, что для разделения ядра на отдельные частицы нужно затратить энергию 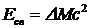 . Эта энергия называется энергией связи.
. Эта энергия называется энергией связи.
Удельной энергией связи (или средней энергией связи на нуклон) называют полную энергию связи ядра, деленную на число нуклонов А. На рис. 5. 11 показана зависимость средней энергии связи на нуклон от А для стабильных ядер. С увеличением А кривая сначала резко возрастает. В ядре дейтерия 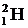 она равна 1, 1 МэВ/нуклон, для
она равна 1, 1 МэВ/нуклон, для 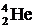 эта величина составляет уже 7, 1 МэВ/нуклон, для изотопа железа
эта величина составляет уже 7, 1 МэВ/нуклон, для изотопа железа 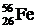 она равна 8, 8 МэВ/нуклон и далее медленно снижается. Это означает, что легкие ядра, как и более тяжелые ядра, оказываются менее прочными, нежели ядра элементов в середине периодической системы. Такая зависимость обеспечивает высвобождение ядерной энергии как в процессе деления тяжелых ядер, так и в процессе синтеза легких ядер.
она равна 8, 8 МэВ/нуклон и далее медленно снижается. Это означает, что легкие ядра, как и более тяжелые ядра, оказываются менее прочными, нежели ядра элементов в середине периодической системы. Такая зависимость обеспечивает высвобождение ядерной энергии как в процессе деления тяжелых ядер, так и в процессе синтеза легких ядер.
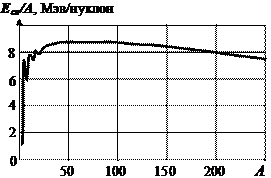
Рис. 5. 11 Средняя энергия связи на нуклон как функция массового числа А для стабильных ядер
Какие же силы удерживают протоны и нейтроны в ядре? Протоны положительно заряжены, и поэтому между ними существует отталкивание. Силы взаимодействия, удерживающие нуклоны в ядре, превосходят кулоновские силы, поэтому это взаимодействие получило название сильного (ядерного) взаимодействия. Сильное (ядерное) взаимодействие - это притяжение, действующее между всеми нуклонами.
Сильное взаимодействие оказалось более сложным, чем гравитационное и электромагнитное взаимодействия. Точное математическое описание его пока неизвестно. Тем не менее, установлены следующие свойства ядерных сил:
а) заряженные (протоны) и незаряженные частицы (нейтроны) притягиваются друг к другу с одинаковой силой;
б) ядерные силы обладают короткодействием, они действуют на расстоянии около 2× 10-15 м (т. е. в пределах ядра), при этом они больше кулоновских в 100 раз;
в) ядерные силы обладают насыщением, проявляющемся в том, что каждый нуклон в ядре взаимодействует лишь с ограниченным числом ближайших к нему нуклонов.
Сильное взаимодействие обладает и другими особенностями. Например, если ядро содержит слишком много или слишком мало нейтронов по сравнению с числом протонов, то сильное взаимодействие ослабевает: при нарушении баланса между протонами и нейтронами ядра становятся нестабильными. Как показано на рис. 5. 12, в стабильных ядрах число протонов и нейтронов одинаково (N = Z) вплоть до Z »15. При больших Z стабильные ядра содержат больше нейтронов, чем протонов.
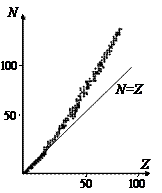
Рис. 5. 12 Число нейтронов как функция числа протонов в стабильных ядрах (обозначены точками)
Это объясняется ростом сил кулоновского отталкивания с увеличением числа протонов Z. Поэтому стабильными ядрами являются те, в которых больше нейтронов, взаимодействующих только ядерными силами. При очень больших Z избыток нейтронов приводит к увеличению размеров ядра и ослаблению связи между нуклонами из-за насыщения и короткодействия ядерных сил. При Z > 92 стабильных ядер не существует.
5. 2. 3 Радиоактивность. Закон радиоактивного распада
Радиоактивность – самопроизвольный распад ядер некоторых атомов с испусканием особого рода излучений, называемых радиоактивными. Радиоактивность была открыта в 1887 г. Анри Беккерелем. Состав излучений был установлен по их отклонению в магнитном поле (Рис. 5. 13). По направлению отклонения и радиусу кривизны траектории было определено, что альфа -лучи (a-частицы) несут положительный заряд, равный по абсолютному значению удвоенному заряду электрона, и представляют собой поток ядер атомов гелия. Бета -лучи (b-частицы) являются потоком быстрых электронов с энергией, достигающей 10 МэВ. Гамма -лучи, не отклоняющиеся магнитным полем, представляют собой кванты электромагнитного излучения очень высокой частоты, они обладают наибольшей из всех радиоактивных излучений проникающей способностью.
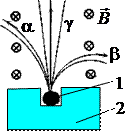
Рис. 5. 13 Отклонение в магнитном поле (направленном от нас перпендикулярно плоскости рисунка) a-, b- и g-лучей: 1 – радиоактивный источник, 2 – свинцовый контейнер
Исследования показали, что большинству значений массового числа ядер соответствует лишь один стабильный изобар 1. Так, при А=10 стабилен лишь один элемент – бор 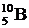 . Другие изобары
. Другие изобары 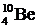 и
и  нестабильны. Нестабильность связана с тем, что энергия этих ядер больше, чем у других, в которые они могут превращаться. Стабильными являются ядра, у которых числа протонов или нейтронов равны 2, 8, 20, 28, 50, 82. Эти числа названы магическими. Наиболее стабильны ядра, у которых магическими являются и число протонов и число нейтронов. Нестабильны и в природе не встречаются ядра с Z=43, 61, 85 и Z > 92.
нестабильны. Нестабильность связана с тем, что энергия этих ядер больше, чем у других, в которые они могут превращаться. Стабильными являются ядра, у которых числа протонов или нейтронов равны 2, 8, 20, 28, 50, 82. Эти числа названы магическими. Наиболее стабильны ядра, у которых магическими являются и число протонов и число нейтронов. Нестабильны и в природе не встречаются ядра с Z=43, 61, 85 и Z > 92.
Ядра, обладающие избыточной энергией, могут освобождаться от нее двумя путями:
- самопроизвольным делением на более устойчивые ядра;
- самопроизвольным изменением заряда на единицу.
Примером превращения первого типа является a-распад, когда из материнского ядра выбрасывается ядро гелия, второго - b-распад, при котором из ядра выбрасываются электроны или позитроны1.
При испускании ядром a-частицы его массовое число уменьшается на 4 единицы, а зарядовое – на две: 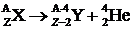 . Элемент смещается на две клетки к началу таблицы Менделеева. При этом дочернее ядро довольно часто освобождается от избыточной энергии испусканием g-квантов.
. Элемент смещается на две клетки к началу таблицы Менделеева. При этом дочернее ядро довольно часто освобождается от избыточной энергии испусканием g-квантов.
При b-распаде массовое число не меняется, а зарядовое увеличивается на единицу: 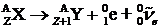 . Элемент смещается на одну клетку в противоположном направлении. При этом дочернее ядро также часто освобождается от лишней энергии испусканием g-квантов.
. Элемент смещается на одну клетку в противоположном направлении. При этом дочернее ядро также часто освобождается от лишней энергии испусканием g-квантов.
Электроны в ядре не могут существовать и вылетают из него сразу после распада нейтрона:
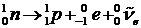 . .
| 5. 23 |
Кроме электрона, при b-распаде из ядра вылетает частица  , названная электронным антинейтрино. Из-за отсутствия у нейтрино заряда и, предположительно, массы покоя оно очень слабо взаимодействует с веществом. Существование нейтрино экспериментально было доказано лишь в середине ХХ в. Предсказано же оно было В. Паули в 1931 г. для объяснения неодинаковости энергии электронов, вылетающих из ядра при b-распаде. Позитроны и электронные нейтрино вылетают из нестабильного ядра, если в ядре происходит распад протона2 по схеме:
, названная электронным антинейтрино. Из-за отсутствия у нейтрино заряда и, предположительно, массы покоя оно очень слабо взаимодействует с веществом. Существование нейтрино экспериментально было доказано лишь в середине ХХ в. Предсказано же оно было В. Паули в 1931 г. для объяснения неодинаковости энергии электронов, вылетающих из ядра при b-распаде. Позитроны и электронные нейтрино вылетают из нестабильного ядра, если в ядре происходит распад протона2 по схеме:
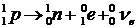 . .
| 5. 24 |
Гамма-излучение представляет собой поток фотонов очень высокой энергии. Отвечающее данному распаду g-излучение имеет всегда одну и ту же энергию. Так как g-излучение не несет заряда, превращения одного химического элемента в другой при этом не происходит.
При радиоактивном распаде количество атомов исходного элемента уменьшается, а атомов-продуктов распада - увеличивается. Процесс распада является случайным процессом: невозможно точно предсказать, когда произойдет распад данного ядра. Однако из-за большого числа распадающихся ядер можно предсказать, сколько ядер образца распадется за данный промежуток времени. Число распадов DN, происходящих за очень короткий промежуток времени Dt, пропорционально Dt и полному числу радиоактивных ядер N:
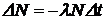 . .
| 5. 25 |
Знак (-) в правой части означает, что число распадов DN равно уменьшению числа еще не распавшихся ядер. Коэффициент пропорциональности l называется постоянной распада. Эта постоянная различна у разных изотопов. Чем больше l, тем выше скорость распада.
Переходя к пределу при Dt ®0, запишем уравнение (5. 25) в дифференциальной форме: 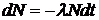 .
.
Решив данное дифференциальное уравнение методом разделения переменных, получим:
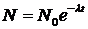 . .
| 5. 26 |
Выражение (5. 26) называют законом радиоактивного распада. Здесь N0 – число атомов в момент времени t=0.
Обозначив время, за которое исходное количество атомов уменьшается вдвое, через Т (период полураспада ), получим: 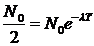 , откуда
, откуда 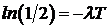 или
или 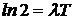 . Отсюда находим связь постоянной распада с периодом полураспада:
. Отсюда находим связь постоянной распада с периодом полураспада: 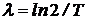 .
.
Радиоактивные элементы, появляющиеся во время распада, также распадаются. Цепь радиоактивных превращения состоит из 14-15 звеньев. Конечными продуктами радиоактивных превращений являются стабильные изотопы свинца. Естественные радиоактивные ядра образуют так называемые семейства (по принадлежности к одной и той же цепи распада). В природе существует три радиоактивных семейства, называемых по начальным элементам цепей радиоактивного распада: семейство урана 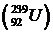 , семейство тория
, семейство тория 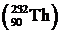 и семейство актиния
и семейство актиния 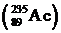 . Существует также семейство, начинающееся с искусственно получаемого нептуния
. Существует также семейство, начинающееся с искусственно получаемого нептуния 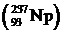 .
.
5. 2. 4 Ядерные реакции
Ядерной реакцией называется процесс сильного взаимодействия атомного ядра с какой-либо частицей или другим ядром, приводящий к преобразованию ядра. В результате осуществления ядерной реакции при образовании ядра-продукта могут испускаться частицы или g-кванты.
В отличие от радиоактивного распада, самопроизвольно приводящего к превращению одного атомного ядра в другое, ядерная реакция вызывается воздействием бомбардирующей частицы. В качестве бомбардирующих частиц могут фигурировать нейтрон, протон, a-частицы и др. Незаряженные частицы, например нейтроны, могут проникать в атомные ядра, обладая сколь угодно малой кинетической энергией. Для получения пучков заряженных частиц с энергией, достаточной для проникновения в любое атомное ядро, созданы ускорители заряженных частиц, в которых с помощью электрических и магнитных полей ядра атомов или электроны разгоняются до больших энергий. Проникшая внутрь ядра частица делает ядро нестабильным, и в результате ядро превращается в более стабильное с выбросом частиц или g-квантов. При любых ядерных реакциях соблюдаются законы сохранения энергии, импульса, момента импульса, электрического заряда. Действие законов сохранения ограничивает возможные варианты ядерных реакций и позволяет предсказать возможные варианты ядерных превращений.
Ядерные реакции под действием a-частиц. Исторически первой ядерной реакцией, обнаруженной в 1919 г. Резерфордом, была реакция превращения ядра азота в ядро кислорода:
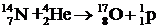 .
.
Вскоре были обнаружены и другие реакции. Часть реакций происходит с поглощением энергии. Такие реакции называют эндотермическими. В приведенной выше реакции поглощается энергия 1, 16 МэВ. Реакции, происходящие с выделением энергии, называют экзотермическими, например
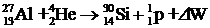 ,
,
где DW = 2, 26 МэВ.
Наряду с реакциями, сопровождающимися испусканием протонов, происходят также реакции с испусканием нейтронов. В результате реакций могут получаться нестабильные ядра, испытывающие затем a- и b-распад. В этом случае говорят об искусственной радиоактивности.
Ядерные реакции под действием протонов. Протон имеет вдвое меньший заряд, чем a-частица, поэтому испытывает меньшее отталкивание со стороны ядра. Ядерные реакции под действием протонов могут, следовательно, происходить при меньших энергиях. Под действием протонов ядерные реакции могут идти практически на всех ядрах. Приведем примеры:
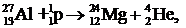
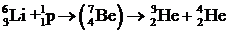 .
.
Промежуточное ядро изотопа бериллия, получаемое в последней реакции, является неустойчивым и распадается на ядра изотопов гелия. Расщепление каждого ядра лития сопровождается выделением энергии 17, 25 МэВ.
Ядерные реакции под действием нейтронов. Нейтрон – наиболее эффективная частица для осуществления ядерных реакций, поскольку у него нет заряда и он не испытывает кулоновского отталкивания со стороны ядра. В результате захвата нейтрона ядром получаются либо стабильные, либо неустойчивые ядра. Для хода реакции важно, какой энергией обладали нейтроны до захвата.
Под действием быстрых нейтронов, приносящих в ядро энергию, достаточную для преодоления потенциального барьера ядра, из ядра могут вылетать заряженные частицы:
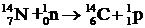 .
.
Особенно эффективными для возбуждения ядерных реакций являются медленные нейтроны, большее время находящиеся вблизи ядра. Вследствие этого вероятность его захвата ядром становится очень большой. Наиболее частой реакцией под действием таких нейтронов является простой захват нейтрона ядром, в результате чего массовое число ядра становится больше на единицу, например:
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|