
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Заключение 1 страница
5. ФИЗИКА АТОМА И ВНУТРЕЯДЕРНЫЕ ПРОЦЕССЫ ЭЛЕМЕНТАРНЫЕ ЧАСТИЦЫ
Лекция 5. 1 Атомная физика (4 часа)
Первые экспериментальные результаты, из которых можно было сделать вывод о дискретности структуры вещества, были получены при открытии Фарадеем законов электролиза (см. раздел «Электричество и магнетизм»). Представление об атомном строении вещества к началу XX в. принималось уже большинством ученых. После открытия электрона в 90-х годах XIX в. возникло представление о существовании структуры атома, одним из составляющих которой рассматривался электрон. Важную роль в развитии теории атома и микрочастиц сыграли представления о квантовых свойствах света, возникшие в физике в начале ХХ в.
5. 1. 1 Волновые свойства микрочастиц
В 1924 г. французский ученый Луи де Бройль предположил, что волновыми свойствами обладают не только фотоны, но и все частицы. Уравнения для импульса 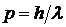 и энергии
и энергии 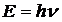 справедливы также для всех частиц. Для частиц, которые движутся со скоростями, меньшими скорости света, импульс можно записать как
справедливы также для всех частиц. Для частиц, которые движутся со скоростями, меньшими скорости света, импульс можно записать как 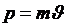 , тогда можно получить выражение для длины волны, соответствующей данной частице:
, тогда можно получить выражение для длины волны, соответствующей данной частице:
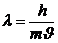 . .
| 5. 1 |
Видно, что для макрочастиц, имеющих сравнительно большую массу, длина волны очень мала, потому что постоянная Планка очень малая величина (h=6. 62× 10-34 Дж× с), и только для очень малых частиц, например электронов (me=0. 91× 10-30 кг), длина волны может быть измерена. Настоящее потрясение ученые испытали, когда эта гипотеза через три года была подтверждена. Два американских ученых К. Дэвиссон и Л. Джермер на опыте наблюдали дифракцию электронов от поверхности кристаллов, которые, как известно, обладают периодической структурой и для электронного пучка играют роль дифракционной решетки. Впоследствии наблюдалась картина интерференции электронов от двух щелей, аналогичная той, что наблюдается в опыте Юнга.
Оказалось, что явление интерференции наблюдается и в том случае, когда электроны проходят через систему щелей поодиночке. Электрон, проходя через одну из щелей, ощущает влияние второй щели! Явление интерференции в этом случае аналогично тому, которое происходит с фотонами при их малом числе и описывается вероятностными законами.
Вначале ученым не было понятно, какова природа волн де Бройля. Математический формализм, с помощью которого описывались волновые свойства, заключался в написании уравнения волны, аналогичному уравнению для напряженности электрического поля в электромагнитной волне. Было установлено, что, так же как и для фотонов, квадрат модуля волновой функции микрочастицы пропорционален вероятности обнаружения частицы в любой момент времени в любой малой области пространства.
Это означает, что характер движения электрона или любой другой микрочастицы невозможно описать уравнениями механики Ньютона. Движение этих частиц описывается законами квантовой механики, и это описание носит вероятностный характер, который наиболее четко выражен в соотношении неопределенности Гейзенберга:
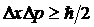 , ,
| 5. 2 |
где 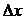 – неопределенность координаты частицы,
– неопределенность координаты частицы, 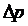 – неопределенность ее импульса,
– неопределенность ее импульса, 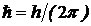 («аш» перечеркнутое).
(«аш» перечеркнутое).
Физически это означает, что невозможно одновременно точно определить положение частицы и ее импульс. Чем точнее мы определяем импульс, тем менее точно координату и наоборот.
Квантовая механика позволяет выйти из одного затруднения философского характера, с которым столкнулась классическая физика. Считалось, что, используя точные физические законы, можно (по крайней мере, в принципе) рассчитать движение всех частиц во Вселенной и тем самым предсказать будущее, в том числе и действия каждого отдельного человека, состоящего из протонов, нейтронов и электронов. При этом было понятно, что такие расчеты практически неосуществимы из-за гигантского числа взаимодействующих частиц.
Квантовая механика показала, что рассчитать поведение частиц можно лишь с определенной степенью вероятности, причем степень этой вероятности катастрофически уменьшается с увеличением времени прогноза. Так, расчет показывает, что для электрона, в первоначальный момент локализованного в области, сопоставимой с размером атома, уже через секунду область локализации имеет размер около тысячи километров. То есть электрон, координаты которого были известны с приемлемой точностью, через секунду может быть обнаружен где угодно в пределах очень большой области. Говорить о предсказании будущего в такой ситуации даже для одной микрочастицы не приходится.
5. 1. 2 Модель атома Резерфорда
Примерно в 1911 г. Эрнест Резерфорд (1871-1937) с сотрудниками выполнил эксперименты по рассеянию положительно заряженных альфа-частиц1 на тонкой металлической фольге.
Источниками a-частиц служили крупицы радия 1, находящиеся в свинцовом контейнере 2 (Рис. 5. 1). Выходящий из узкого канала контейнера пучок частиц попадал на тонкую фольгу 3 из золота. За ней помещался спинтарископ 4 - устройство для наблюдения и подсчета a-частиц, рассеянных под определенным углом.
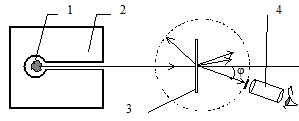
Рис. 5. 1Схема опытов Резерфорда
Полученные Резерфордом экспериментальные результаты оказались неожиданными. Большинство a-частиц свободно проходило сквозь фольгу, как если бы та представляла собой в основном пустое пространство. Что же касается a-частиц, отклонившихся от первоначального направления движения, то небольшое количество рассеивалось на очень большие углы - иногда почти на 180°. Такое, по мнению Резерфорда, могло происходить только в том случае, если положительно заряженные a-частицы испытали отталкивание массивного положительного заряда, сосредоточенного в очень малой области пространства.
На основании результатов опытов Резерфорд сделал следующие выводы: атом имеет массивное положительно заряженное ядро, малое по сравнению с размером атома. Именно оно отбрасывает назад a-частицы, летящие прямо на него. Остальную часть атома занимают электроны, не влияющие существенным образом на движение a-частиц. Резерфорд предположил, что атом устроен подобно планетной системе: вокруг ядра по орбитам вращаются электроны (покоящиеся электроны упали бы на ядро под действием электрического притяжения). По оценкам Резерфорда, размеры ядра должны быть порядка 10-15-10-14 м. Оценка размеров атома по кинетической теории давала величину порядка 10-10 м. Это означало, что электроны должны находиться от ядра на расстоянии примерно от 10000 до 100000 поперечников ядра, т. е. основную часть атома составляет пустое пространство.
Планетарная модель атома Резерфорда явилась значительным шагом на пути к современным представлениям о строении атома. Однако она не была совершенной моделью, поскольку противоречила классической физике. Вращающиеся электроны должны терять энергию из-за излучения электромагнитной волны и примерно через 10-8 с они должны «упасть» на ядро, чего на самом деле не происходит. Кроме того, из модели Резерфорда следовало, что испускаемый атомами свет должен иметь непрерывный спектр, тогда как наблюдаемые спектры были линейчатыми.
5. 1. 3 Постулаты Бора
Первую попытку разрешить противоречия между классической теорией и моделью атома Резерфорда предпринял датский физик Н. Бор. Анализ результатов опытов Резерфорда, а также выявленные к тому времени закономерности в спектре излучения атома водорода позволили Бору предложить квантовые постулаты:
1. Атомы могут находиться длительное время в устойчивых (стационарных) состояниях, в которых не излучается энергия; в каждом из стационарных состояний атом может обладать только вполне определенной энергией.
2. Излучение или поглощение энергии атомами происходит в момент скачкообразного перехода атома из одного стационарного состояния в другое (при этом электрон скачком переходит с одной стационарной орбиты на другую). Атомы излучают и поглощают энергию дискретными порциями - квантами, энергия которых e = hv равна разности энергий тех стационарных состояний, между которыми происходит данный переход:
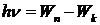 ,
,
а частота излучения:
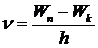 , ,
| 5. 3 |
где Wn, Wk - энергия стационарных состояний. Если Wn > Wk, излучается квант энергии (фотон), если Wn < Wk, квант энергии поглощается.
3. Из бесконечного множества электронных орбит, возможных с точки зрения классической механики, осуществляются в действительности лишь те, для которых момент импульса электрона на орбите 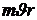 кратен
кратен 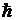 :
:
 . .
| 5. 4 |
Здесь n - целое положительное число, r - радиус n-й разрешенной орбиты. Эти орбиты нумерованы числами 1, 2, 3, ... в зависимости от значения п, которое называется квантовым числом.
Соотношение (5. 2) называют правилом квантования Бора. Оно не имело под собой прочной теретической основы. Единственным аргументом для выбора соотношения (5. 2) в качестве условия квантования было то, что это соотношение позволяло достичь согласия с наблюдаемыми спектрами.
Бор исходил из того, что атомы испускают линейчатые спектры, поэтому и энергетические состояния должны образовывать дискретный спектр. Дискретность значений энергий была доказана в опытах Франка и Герца в 1913 г.
5. 1. 4 Теория водородоподобных атомов по Бору
К водородоподобным атомам относят кроме водорода однократно ионизованный атом гелия, двукратно ионизованный атом лития и т. д. Водородоподобный атом имеет, таким образом, всего один электрон.
Модель атома Резерфорда-Бора позволила объяснить происхождение линейчатых спектров излучения и поглощения водородоподобных атомов, исследованных еще в начале ХIX в.
Обычно атомы находятся в невозбужденном состоянии с минимально возможным значением энергии. Это состояние называется основным. Состояния с более высокими энергиями называются возбужденными. Энергия фотона, поглощаемого атомом при переходе из основного состояния с энергией W1 в возбужденное состояние с энергией Wn, где n = 2, 3, 4..., равна энергии фотона, излучаемого атомом при обратном переходе.
Частота излучения при этом:
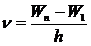 ,
,
однако переход в основное состояние возможен и через несколько промежуточных состояний при испускании нескольких фотонов с меньшей энергией и частотой:
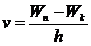 ,
,
где n> k> 1.
При этом возбужденные атомы химического элемента испускают совокупность дискретных частот - линейчатый спектр, характерный только для данного элемента.
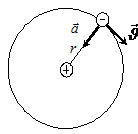
Рис. 5. 2 Движение электрона по круговой орбите в модели Бора
Согласно представлениям Бора, движение электронов вокруг ядра подчиняется законам классической механики (Рис. 5. 2). Связь между радиусом орбиты r и скоростью электрона 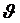 может быть найдена, если учесть, что центростремительное ускорение при движении по круговой орбите
может быть найдена, если учесть, что центростремительное ускорение при движении по круговой орбите 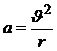 , а по второму закону Ньютона
, а по второму закону Ньютона 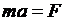 . Центростремительное ускорение сообщается электрону, в соответствии с законом Кулона, силой притяжения между отрицательно заряженным электроном и положительно заряженным ядром (см. «Электричество и магнетизм»):
. Центростремительное ускорение сообщается электрону, в соответствии с законом Кулона, силой притяжения между отрицательно заряженным электроном и положительно заряженным ядром (см. «Электричество и магнетизм»): 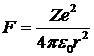 . Здесь учтено, что заряд электрона равен - е, заряд ядра + Ze, где Z - число положительно заряженных протонов в ядре (порядковый номер атома в таблице Менделеева)1.
. Здесь учтено, что заряд электрона равен - е, заряд ядра + Ze, где Z - число положительно заряженных протонов в ядре (порядковый номер атома в таблице Менделеева)1.
Тогда второй закон Ньютона запишется в виде:
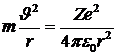 ,
,
или:
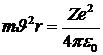 . .
| 5. 5 |
Правило квантования:  .
.
Разделив первое уравнение на второе, получим:
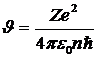 . .
| 5. 6 |
Выразив из (5. 4) 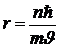 , подставим сюда скорость из (6. 6). Получим:
, подставим сюда скорость из (6. 6). Получим:
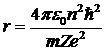 . .
| 5. 7 |
Это соотношение определяет радиусы разрешенных орбит в боровской модели атома водорода. Ближайшей к ядру орбите соответствует п = 1, и для атома водорода (Z = 1) радиус первой орбиты получается равным 0, 529× 10-10 м.
На каждой из допустимых орбит электрон обладает вполне определенной энергией. Потенциальная энергия определяется как энергия взаимодействия двух точечных зарядов – отрицательно заряженного электрона и положительно заряженного ядра:
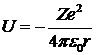 .
.
Кинетическая энергия электрона:
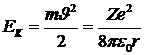 .
.
При выводе этого выражения использована формула (5. 5). Полная энергия, равная сумме кинетической и потенциальной энергий:
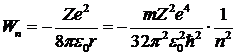 . .
| 5. 8 |
Полная энергия электрона в атоме отрицательна, это означает, что электрон находится в потенциальной яме. Чтобы оторвать электрон от атома, ему нужно сообщить положительную энергию, равную Wn. Эта энергия называется энергией ионизации. Для водорода (Z = 1) низший энергетический уровень соответствует п = 1. При подстановке в формулу (6. 8) численных значений находим энергию на этом уровне: W1 = -2, 17× 10-18 Дж = -13, 6 эВ (джоули мы перевели в электрон-вольты, как это принято в атомной физике: 1 эВ = 1, 6× 10-19 Дж).
Вычисление значений энергии электрона на стационарных орбитах и определение возможных частот излучения по формуле (5. 1) дает поразительно точное совпадение с экспериментом, так же хорошо совпадает с экспериментом значение энергии ионизации атома водорода (13, 6 эВ).
Объяснение правилу квантования Бора впоследствии дал де Бройль, основываясь на волновой природе электронов.
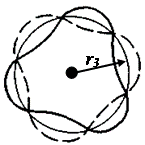
Рис. 5. 3 На третьей боровской орбите укладывается три длины волны де Бройля
Каждому электрону в атоме соответствует стоячая волна де Бройля. Стоячие механические волны могут возникать на струнах скрипки или гитары. Если ущипнуть струну, то в ней возбудится большое число волн самой различной длины. Но лишь сравнительно немногие из них не будут затухать - это волны с минимумами колебаний на закрепленных концах. При этом на длине струны должно укладываться целое число половин длин волн. Движению электронов по круговой орбите соответствует механическая волна в кольцевой струне. Стоячая волна в такой струне возникает, когда на ее длине укладывается целое число длин волн. Таким образом, электронам соответствуют круговые стоячие волны де Бройля, которые «замыкаются» на себя (рис. 6. 3). Длина круговой боровской орбиты радиусом rn равна 2prn, поэтому 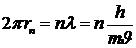 , откуда
, откуда
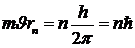 .
.
Последнее соотношение представляет собой не что иное, как правило квантования (5. 1), введенное Бором.
5. 1. 5 Закономерности в спектрах водородоподобных атомов
Излучение возбужденных газов наблюдалось еще в начале XIX в., и было обнаружено, что спектр излучения разреженных газов является не непрерывным, а дискретным (линейчатым). Каждое вещество обладает своим, характерным только для него спектром испускания, позволяющим идентифицировать газ. Если излучение с непрерывным спектром (например солнечный свет) проходит через газ, то в спектре появятся темные линии, соответствующие светлым линиям в линейчатом спектре испускания данного газа. Такой спектр (с темными линиями) называется спектром поглощения. Было установлено, что газы поглощают свет на тех же частотах, на которых они излучают.
Самый простой спектр имеет водород. В 1885 г. Дж. Бальмер показал, что четыре видимые линии в спектре водорода, соответствующие длинам волн 656, 486, 434 и 410 нм, можно определить по формуле:
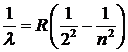 , n =3, 4, …, , n =3, 4, …,
| 5. 9 |
где R = 1, 097× 107 м-1 - постоянная Ридберга , а число п для первых четырех линий принимает значение 3, 4, 5 и 6.
Выполненные несколько позднее исследования спектра водорода показали, что в ультрафиолетовой и инфракрасной областях имеются другие серии линий, аналогичные по своей структуре серии Бальмера, но с другими длинами волн. Оказалось, что каждая из этих серий может быть описана формулой, напоминающей формулу (6. 9). Например, так называемая серия Лаймана содержит линии с длинами волн от 91 до 122 нм, которые описываются формулой 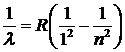 , n =2, 3, …,
, n =2, 3, …,
В серии Пашена длины волн соответствуют формуле
 , n =4, 5, …,
, n =4, 5, …,
Различные разрешенные значения энергии обычно изображаются на схеме энергетических уровней в виде горизонтальных линий. Для водорода такая схема уровней показана на Рис. 5. 4.

Рис. 5. 4 Спектральные серии в спектре
атома водорода
Квантовое число п в соответствии с формулой (5. 6) определяет значения уровней энергии. Согласно теории Бора, электрон в атоме водорода может находиться на любом из разрешенных уровней. Но он никогда не может оказаться между этими уровнями, например при энергии –9, 0 эВ. При комнатной температуре почти все атомы водорода находятся в основном состоянии. При более высоких температурах или в электрическом разряде за счет столкновений между свободными электронами и атомами многие электроны получают дополнительную энергию и переходят в возбужденные состояния. Через некоторое время электроны из возбужденного состояния переходят в состояния с меньшей энергией, испуская при этом фотоны. Этими переходами в рамках боровской модели и объясняются спектры испускания возбужденных газов.
Вертикальными стрелками на рис. 5. 4 указаны переходы, соответствующие различным наблюдаемым спектральным линиям. Например, переход электрона с уровня n = 3 на уровень n = 2 соответствует линии серии Бальмера с длиной волны l=656 нм, а переход с уровня n = 4 на уровень n = 2 – линии с l=486 нм.
Закономерности в спектрах водородоподобных атомов легко объясняются теорией Бора. Действительно, из (5. 1) следует: 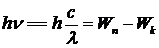 . Подставив сюда значения энергии из (5. 8), получим:
. Подставив сюда значения энергии из (5. 8), получим:
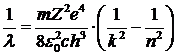 . .
| 5. 10 |
При выводе этой формулы сделана замена 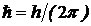 . Формула (5. 10) совпадает с формулами для длин волн спектральных линий (5. 9) и др., при значении квантовых чисел k =1, 2, 3, n> k и постоянной Ридберга, равной
. Формула (5. 10) совпадает с формулами для длин волн спектральных линий (5. 9) и др., при значении квантовых чисел k =1, 2, 3, n> k и постоянной Ридберга, равной 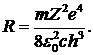 Расчет постоянной Ридберга по этой формуле дает значение, весьма близкое к полученному экспериментально.
Расчет постоянной Ридберга по этой формуле дает значение, весьма близкое к полученному экспериментально.
Таким образом, теория Бора смогла объяснить, почему атомы испускают линейчатые спектры, и точно предсказать для атома водорода длины волн испускаемого излучения. Теория Бора позволила объяснить и спектры поглощения: столкновение фотона с атомом приводит к переходу электрона с одного энергетического уровня на другой, более высокий. Закон сохранения энергии требует, чтобы налетающий фотон обладал энергией, равной разности энергий уровней. Этим объясняется, почему непрерывный спектр, проходя через газ, давал темные линии (поглощения) на тех же самых частотах, что и линии испускания.
Теория Бора постулировала также стабильность атомов; основное состояние является низшим состоянием электрона и не существует более низкого энергетического уровня, на который электрон мог бы перейти из основного состояния с испусканием излучения. Наконец, теория Бора, как было показано выше, точно предсказывает энергию ионизации водорода 13, 6 эВ.
К сожалению, теория Бора оказалась полностью несостоятельной уже для атомов, содержащих два электрона, не говоря о более сложных атомах. Она не смогла объяснить, почему линии испускания при более детальном изучении оказались состоящими из двух или большего числа очень близких линий (так называемая тонкая структура). Теория Бора не смогла также объяснить, почему одни спектральные линии ярче других. Не получили объяснения и межатомные связи в молекулах, твердых телах и жидкостях. Теория Бора является внутренне противоречивой – не является ни последовательно классической, ни последовательно квантовой, тем не менее, она сыграла важную роль в создании более совершенной квантовой теории атома, которой и уступила место.
5. 1. 6 Основные положения квантовой механики. Уравнение Шредингера
В начале 20-х годов XX в. многие физики стали все более отчетливо сознавать необходимость новой, более последовательной теории. И она не заставила себя ждать. Менее чем через два года после того, как де Бройль выдвинул гипотезу о волновых свойствах микрочастиц, Э. Шредингер и В. Гейзенберг независимо разработали новую, более общую теорию. Избранные ими подходы были различными, но, как выяснилось вскоре, оказались полностью совместимыми.
Новая теория, описывающая явления в мире микрочастиц, получила название квантовой механики. Она блестяще решила проблему спектров сложных атомов; она объяснила относительную яркость спектральных линий и образование молекул из атомов; она представляет собой несравненно более общую теорию, которая охватила всю совокупность квантовых явлений от излучения черного тела до структуры атомов и молекул. Квантовая механика объяснила широкий круг явлений природы, ее предсказания позволили создать много новых устройств, нашедших практическое применение. Квантовая механика занимается в основном изучением микромира атомов и света; но в применении к макротелам новая теория должна приводить к классическим законам механики Ньютона. Это означает, что квантовая механика должна полностью удовлетворять принципу соответствия (см. разд. 4. 4).
В основе квантовой механики лежит представление о волновых свойствах микрочастиц и соотношение неопределенностей Гейзенберга. Как указывалось в разделе Лекция 5. 1, каждой частице соответствует волновая функция, причем квадрат модуля волновой функции позволяет определить вероятность обнаружения микрочастицы в заданном объеме
Уравнение, решением которого является волновая функция Y для микрочастиц, движущихся во внешнем поле и обладающих потенциальной энергией, было получено Шредингером в 1926 г. Для случая, когда потенциальная энергия частицы не зависит от времени, уравнение одномерного движения имеет вид:
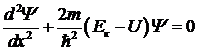 . .
| 5. 11 |
где m – масса частицы, Eк и U – ее кинетическая и потенциальная энергия, соответственно. Уравнение (5. 11) называется стационарным уравнением Шредингера и справедливо для частиц, движущихся со скоростями, много меньшими скорости света.
Применим уравнение Шредингера для свободно движущейся частицы, т. е. частицы, не взаимодействующей с другими телами. Импульс р свободно движущейся частицы может быть выражен следующим образом:
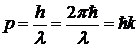 , ,
| 5. 12 |
где 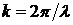 - волновое число. Потенциальная энергия свободно движущейся частицы равна нулю. Уравнение Шредингера для случая U=0 принимает вид:
- волновое число. Потенциальная энергия свободно движущейся частицы равна нулю. Уравнение Шредингера для случая U=0 принимает вид:
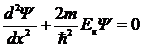 . .
| 5. 13 |
Множитель перед волновой функцией равен квадрату волнового числа:
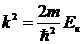 . .
| 5. 14 |
Действительно, подставив в это выражение кинетическую энергию, выраженную через импульс 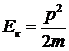 , получим:
, получим: 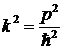 , что согласуется с (5. 12). С учетом этого уравнение Шредингера приводится к виду:
, что согласуется с (5. 12). С учетом этого уравнение Шредингера приводится к виду:
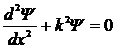 . .
| 5. 15 |
Это уравнение подобно уравнению гармонического осциллятора (см. раздел «Механика»), и его решением является гармоническая функция
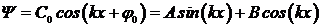 . .
| 5. 16 |
Амплитуда такой волны осциллирует на всей оси x1. Следовательно, определить область локализации частицы невозможно, т. е. неопределенность ее координаты 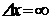 . Это утверждение согласуется с принципом неопределенности Гейзенберга. Если импульс частицы задан точно (как в нашем случае), то его неопределенность Dр = 0. Из (5. 2) следует, что в таком случае
. Это утверждение согласуется с принципом неопределенности Гейзенберга. Если импульс частицы задан точно (как в нашем случае), то его неопределенность Dр = 0. Из (5. 2) следует, что в таком случае 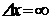 .
.
Применим сейчас уравнение Шредингера для частицы (например для электрона), находящейся в прямоугольной потенциальной яме с бесконечно высокими стенками. Это означает, что в пределах ямы 0< x< a (Рис. 5. 5) потенциальная энергия частицы U равна нулю, а за ее пределами – бесконечности. Для координат 0< x< a справедливо, следовательно, уравнение Шредингера в виде (5. 13). Представим его решение в виде 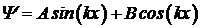 . Для нахождения констант А и В воспользуемся граничными условиями. Частица, обладающая конечной кинетической энергией, не может покинуть бесконечно глубокую потенциальную яму, следовательно, на границах ямы ее волновая функция обращается в ноль: Y=0 при х=0 и Y=0 при х=а.
. Для нахождения констант А и В воспользуемся граничными условиями. Частица, обладающая конечной кинетической энергией, не может покинуть бесконечно глубокую потенциальную яму, следовательно, на границах ямы ее волновая функция обращается в ноль: Y=0 при х=0 и Y=0 при х=а.

Рис. 5. 5 График зависимости потенциальной энергии от координаты х в прямоугольной потенциальной яме с бесконечно высокими стенками
Используя первое граничное условие, имеем: 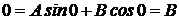 , откуда следует: В=0. Используя второе граничное условие, получим:
, откуда следует: В=0. Используя второе граничное условие, получим:
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|