
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Заключение 2 страница
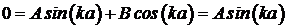 .
.
Функция синуса равна нулю при ka=np, где n – целое число, или, с учетом (5. 14), при 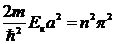 . Отсюда следует, что кинетическая энергия частицы может принимать лишь дискретные значения:
. Отсюда следует, что кинетическая энергия частицы может принимать лишь дискретные значения:
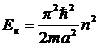 , n = 1, 2, 3. … , n = 1, 2, 3. …
| 5. 17 |
Найдем, как изменяется волновая функция в пределах потенциальной ямы. Решение уравнения (5. 15) с учетом найденной константы В=0 имеет вид:
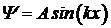 ,
,
где волновое число k представим в виде: k=np/a. Если n = 1, то 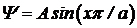 и на отрезке 0< x< a укладывается половина пространственного периода волновой функции (Рис. 5. 6а). На этом же рисунке приведены графики волновой функции для других значений n.
и на отрезке 0< x< a укладывается половина пространственного периода волновой функции (Рис. 5. 6а). На этом же рисунке приведены графики волновой функции для других значений n.
а б
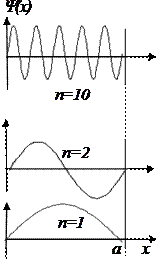
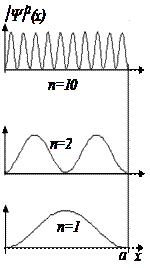
Рис. 5. 6 Волновые функции (а) и квадраты модулей волновых функций (б) микрочастицы в прямоугольной потенциальной яме
Графики квадратов модулей волновой функции показаны на Рис. 5. 6б. При n = 1 вероятность обнаружения частицы максимальна в центре потенциальной ямы, тогда как при n = 2 вероятность обнаружения ее в центре ямы равна нулю1. При больших n квадрат модуля волновой функции осциллирует с малым пространственным периодом. Если этот период становится меньше размеров детектора частиц, то вероятность обнаружения частицы будет одинаковой в любом месте потенциальной ямы, как и для классической частицы. Таким образом, квантовые закономерности при определенных условиях совпадают с классическими закономерностями, что является еще одним подтверждением принципа соответствия.
Итак, решения уравнения Шредингера для двух случаев проиллюстрировали основные выводы квантовой теории: энергия микрочастицы в потенциальной яме принимает дискретные значения (квантуется); вероятность обнаружения частицы в той или иной части потенциальной ямы зависит от ее энергии; нельзя одновременно точно определить импульс и координату микрочастицы.
5. 1. 7 Современные представления о строении атома
Результаты, достигнутые боровской теорией в решении задачи об энергетических уровнях электрона в водородоподобной системе, могут быть получены в квантовой механике без привлечения постулатов Бора.
Электрон находится в кулоновском поле ядра, обладающем сферической симметрией (Рис. 5. 7). Естественно, это требует использования сферических координат при решении уравнения Шредингера. Если рассматривать сферически симметричные стационарные состояния, в которых волновая функция зависит только от радиуса, то оказывается, что уравнение Шредингера для атома водорода имеет решения лишь при условии, что полная энергия электрона принимает те же значения, что и в теории Бора.
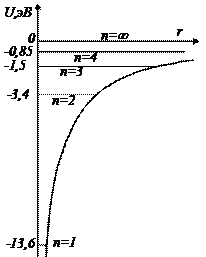
Рис. 5. 7 Кривая зависимости потенциальной энергии электрона U от расстояния до ядра r и разрешенные значения полной энергии для нескольких значений главного квантового числа n.
На энергетической диаграмме, изображенной на Рис. 5. 7, приведены значения энергии в состояниях, характеризуемых разными квантовыми числами n. Квантовое число n называется в квантовой теории атома главным квантовым числом.
Кроме того, из решения уравнения Шредингера следует, что момент импульса электрона в атоме квантуется (принимает дискретные значения) в соответствии с формулой
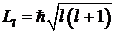 , ,
| 5. 18 |
где l = 0, 1, 2, …, (n - 1) – орбитальное квантовое число. Состояния электрона, обладающего различными значениями орбитального квантового числа, в атомной физике принято обозначать и называть следующим образом:
l =0 – s-состояние, l =1– р-состояние, l =2– d-состояние, l =3 – f-состояние и далее в порядке следования букв латинского алфавита.
В основном состоянии атома водорода главное квантовое число n =1. При этом орбитальное квантовое число может иметь единственное значение l= 01. Тогда из соотношения (5. 18) следует, что в основном состоянии атома водорода момент импульса электрона равен нулю. В этом случае движение электрона можно представить как колебания относительно ядра по прямой, проходящей через ядро. С точки зрения теории Бора, такое состояние соответствовало бы «маятниковообразной орбите», проходящей через ядро атома. Квантовая механика приводит к возможности существования таких состояний электрона, в которых он не имеет момента импульса, связанного с движением по орбите.
По теории Бора, вероятность обнаружить электрон в состоянии с n =1 отлична от нуля только для значения rБ, определяемом формулой (5. 7). Согласно же квантовой механике, эта вероятность лишь достигает максимума при этом значении rБ, но она отлична от нуля и при других значениях r. На Рис. 5. 8а приведена зависимость квадрата модуля волновой функции электрона от расстояния до ядра.
Никаких плоских круговых орбит в атоме водорода в действительности нет. Как видно из рисунка, электрон в основном состоянии атома водорода может быть обнаружен на различных расстояниях от ядра. Атом водорода в этом состоянии (1s) можно представить в виде сферы, в центре которой находится атомное ядро, окруженное сферически симметричным электронным облаком с максимальной плотностью на расстоянии rБ от ядра, где вероятность его обнаружения максимальна (Рис. 5. 8б). Для 2р состояния решение уравнения Шредингера дает иной результат. Форма электронного облака атома водорода в этомсостоянии не обладает сферической симметрией и напоминает гантель (Рис. 5. 8в).
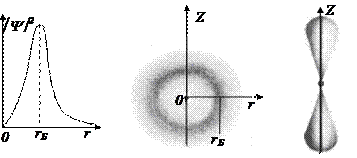
а б в
Рис. 5. 8 Зависимость квадрата модуля волновой функции электрона в состоянии 1s от расстояния до ядра (а); вид электронного облака для состояний 1s (б) и 2р (в)
5. 1. 8 Пространственное квантование. Спин электрона
В модели Бора электрон, вращающийся по круговой орбите, может рассматриваться как кольцевой ток, обладающий магнитным моментом (см. раздел «Электричество и магнетизм»). Поскольку электрон имеет отрицательный заряд, то магнитный момент орбитального движения электрона направлен противоположно механическому моменту импульса (рис. 6. 9). Нетрудно найти связь между модулями этих моментов:
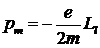 1.
1.
Для указания ориентации векторов 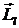 и
и 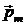 должно быть выбрано некоторое направление в пространстве, в качестве которого выбирается направление либо внешнего магнитного поля, в котором находятся атом, либо направление внутреннего магнит
должно быть выбрано некоторое направление в пространстве, в качестве которого выбирается направление либо внешнего магнитного поля, в котором находятся атом, либо направление внутреннего магнит
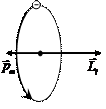
Рис. 5. 9 Ориентация момента импульса и магнитного момента орбитального движения электрона
ного поля, созданного всеми электронами (кроме рассматриваемого) и ядром. В классической физике предполагалось само собой разумеющимся, что вектор 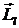 (или
(или 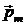 ) может быть ориентирован относительно избранного направления магнитного поля произвольным образом. На языке теории Бора это означает, что плоскость орбиты электрона может быть ориентирована произвольно по отношению к внешнему магнитному полю. Однако такое предположение было ошибочным.
) может быть ориентирован относительно избранного направления магнитного поля произвольным образом. На языке теории Бора это означает, что плоскость орбиты электрона может быть ориентирована произвольно по отношению к внешнему магнитному полю. Однако такое предположение было ошибочным.
Оказалось, что существует так называемое пространственное квантование момента импульса. В квантовой механике строго доказано, что проекция 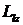 вектора
вектора 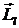 орбитального момента импульса электрона на направление Z магнитного поля может принимать лишь дискретные значения:
орбитального момента импульса электрона на направление Z магнитного поля может принимать лишь дискретные значения:
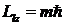 . .
| 5. 19 |
где m - так называемое магнитное квантовое число, принимающее значения: m = 0, ±1, ±2, ±3, ..., ±l. Здесь l – орбитальное квантовое число. Таким образом, вектор 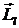 может ориентироваться в пространстве только определенным образом. На Рис. 5. 9 приведены возможные значения проекции на ось Z вектора
может ориентироваться в пространстве только определенным образом. На Рис. 5. 9 приведены возможные значения проекции на ось Z вектора 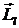 для электронов в d-состояниях (l=2).
для электронов в d-состояниях (l=2).
В 1921 г. Штерн и Герлах экспериментально обнаружили эффект, который можно было объяснить, лишь предположив наличие у электрона собственного момента импульса Ls, названного спином1 [2] и соответствующего магнитного момента. Наличие спина можно было бы объяснить тем, что электрон, обращаясь вокруг атомного ядра, одновременно вращается вокруг собственной оси. Однако это представление ныне полностью отброшено. Согласно современным данным, электрон нельзя представлять как локализованный объект, тем более вращающийся вокруг своей оси. Численное значение спина электрона определяется по формуле 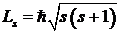 , где s - спиновое квантовое число, принимающее лишь одно значение s=1/2, поэтому спин электрона равен
, где s - спиновое квантовое число, принимающее лишь одно значение s=1/2, поэтому спин электрона равен 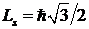 .
.
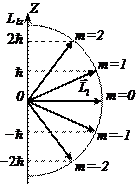
Рис. 5. 10 Квантование проекции момента импульса электрона в атоме на направление магнитного поля
По аналогии с пространственным квантованием орбитального момента импульса проекция вектора 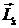 на направление магнитного поля также квантуется и определяется по формуле аналогичной (5. 19):
на направление магнитного поля также квантуется и определяется по формуле аналогичной (5. 19):
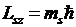 . .
| 5. 20 |
где ms - магнитное спиновое квантовое число, которое принимает только два значения ms = + 1/2и ms = - 1/2. В единицах 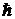 проекция спина принимает значения ± ½, поэтому для краткости говорят, что электрон обладает полуцелым спином. Очень часто говорят, что спин электрона может быть ориентирован либо вдоль направления магнитного поля, либо противоположно ему. Такое общепринятое словоупотребление неточно: говоря о направлении спина, при этом в действительности имеют в виду направление его составляющей Lsz.
проекция спина принимает значения ± ½, поэтому для краткости говорят, что электрон обладает полуцелым спином. Очень часто говорят, что спин электрона может быть ориентирован либо вдоль направления магнитного поля, либо противоположно ему. Такое общепринятое словоупотребление неточно: говоря о направлении спина, при этом в действительности имеют в виду направление его составляющей Lsz.
5. 1. 9 Принцип Паули. Периодическая система Д. И. Менделеева
В данном разделе мы кратко обсудим строение более сложных атомов с двумя и большим числом электронов. Математический аппарат квантовой механики существенно усложнился, так как в многоэлектронных атомах каждый электрон находится не в электрическом поле ядра, но в суммарном поле ядра и остальных электронов. Однако понять строение таких атомов можно из достаточно общих закономерностей.
В атоме водорода в основном состоянии с квантовыми числами n=1 и l=0 энергия электрона имеет минимальное значение, атом в этом состоянии может существовать неограниченно долго. Во всех остальных состояниях атом существует ограниченное время, порядка 10-8 с, и самопроизвольно переходит в основное состояние с излучением фотона. Если бы и в других атомах основные состояния электронов были бы такими же(n=1, l=0), то спектры излучения всех элементов были бы подобны спектру водорода. В действительности оказалось, что в нейтральном невозбужденном атоме, содержащем Z электронов, лишь два из них находятся в состоянии с минимальной энергией. Остальные электроны находятся на более высоких энергетических уровнях и не переходят самопроизвольно на более низкие уровни неограниченно долгое время.
Такое поведение электронов в атомах объяснил в 1925 г. В. Паули, установивший принцип, гласящий: в любом атоме (или другой квантовой системе) в одном и том же состоянии, характеризуемом одинаковой совокупностью четырех квантовых чисел п, l, тl, тs может находиться только один электрон 1 .
Согласно принципу Паули, электроны с одним и тем же значением главного квантового числа должны отличаться друг от друга хотя бы одним из трех других квантовых чисел l, тl и тs. В состоянии с одним значением главного квантового числа п орбитальное квантовое число l может принимать п значений (от 0 до п -1). Одному значению орбитального квантового числа l соответствует (2l +1) значений магнитного квантового числа тl (от -l до l). Общее же число возможных состояний с одним и тем же значением главного квантового числа, но различными значениями орбитального и магнитного квантовых чисел равно 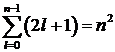 . Четвертое квантовое число может принимать только два значения: тs= ±1/2. Таким образом, общее число различных квантовых состояний электрона с одним и тем же значением главного квантового числа равно 2п2.
. Четвертое квантовое число может принимать только два значения: тs= ±1/2. Таким образом, общее число различных квантовых состояний электрона с одним и тем же значением главного квантового числа равно 2п2.
Совокупность электронов с одним и тем же значением главного квантового числа называют электронной оболочкой и обозначают латинскими буквами (Табл. 5. 1).
Таблица 5. 1
| Главное квантовое число n | |||||
| Обозначение оболочки | К | L | М | N | О |
| Максимальное количество электронов в оболочке, 2n2 |
Периодический закон изменения химических и физических свойств элементов в зависимости от их атомных масс был открыт в 1869 г. Д. И. Менделеевым. Через определенные промежутки (периоды) элементы, оказывающиеся в одном вертикальном ряду (периоде), обнаруживают сходные свойства. Для объяснения строения таблицы Менделеева достаточно применить два принципа: принцип Паули и принцип минимума энергии системы, в соответствии с которыми и происходит заполнение разрешенных электронных состояний.
Прежде всего отметим, что в многоэлектронных атомах в отличие от атома водорода, из-за взаимодействия электронов между собой их энергия оказывается зависящей не только от главного квантового числа, но и от остальных трех квантовых чисел, в первую очередь от орбитального числа. Но преобладающим остается влияние главного квантового числа. Поэтому минимальной энергией обладают электроны в состоянии с главным квантовым числом n=1, большей энергией - в состояниях с n = 2, 3, 4 и т. д. У легких атомов с Z< 19 заполняются вначале оболочки с меньшим n, однако из-за возрастающей зависимости энергии от квантового числа l уже при Z=19 наблюдается отступление от этого порядка. Вместо заполнения свободных состояний 3d, заполняется состояние 4s (Табл. 5. 2).
Рассмотрим кратко последовательность заполнения некоторых состояний в атомах. В атоме водорода единственный электрон находится в состоянии 1s, характеризуемом квантовыми числами п =1, l=0, тl=0. При этом проекция его спина на направление внешнего поля характеризуется спиновым числом ms=-1/2, либо ms=1/2. В атоме гелия имеется два электрона. Второй электрон этого атома также может находиться в состоянии с такими же п, l, и тl, но проекция спина второго электрона должна быть ориентирована противоположно проекции первого.
Таблица 5. 2
| Период в таблице Менделеева | Атомный номер | Оболочка | K (n=1) | L (n=2) | M (n=3) | N (n=4) | ||||
| Состояние | 1s (l=1) | 2s | 2p (l=2) | 3s | 3p | 3d (l=3) | 4s | 4p | ||
| Символ химического элемента | Число электронов | |||||||||
| I | Н | |||||||||
| Не | ||||||||||
| Li | ||||||||||
| Be | ||||||||||
| В | ||||||||||
| - | -- | -- | -- | -- | ||||||
| F | ||||||||||
| Ne | ||||||||||
| III | Na | |||||||||
| Mg | ||||||||||
| Al | ||||||||||
| -- | -- | -- | -- | -- | -- | -- | ||||
| Ar | ||||||||||
| IV | К | – | ||||||||
| Ca | – | |||||||||
| Sc | ||||||||||
| Ti | ||||||||||
| -- | -- | -- | -- | -- | -- | -- | -- | -- | ||
| Kr | ||||||||||
Группа состояний с п =1, l=0, тl=0 и ms= ±1/2 образует заполненную K-оболочку атома, соответствующую завершению первого периода периодической системы Менделеева. Следующий по порядку атом лития содержит три электрона. Но, по принципу Паули, третий электрон атома лития уже не может разместиться в целиком заполненной К оболочке и занимает низшее энергетическое состояние в оболочке с п = 2 (L-оболочке). Таким состоянием является состояние 2s (п = 2, l = 0, тl = 0).
Литием начинается второй период периодической системы. Четвертый электрон бериллия (Z = 4)занимает также состояние 2s, а пятый электрон бора (Z =5) должен уже занять энергетически более высокое состояние 2р (п = 2, l = 1). Электроны всех атомов вплоть до неона (Z = 10) находятся в состоянии 2р. У неона таких электронов 6, т. е. Число, максимально возможное для такого состояния. Таким образом, L-оболочка неона оказывается полностью заполненной, и на этом элементе завершается второй период периодической системы Менделеева.
Одиннадцатый электрон натрия (Z = 11) размещается уже в М-оболочке (п = 3), занимая низшее состояние 3s. Далее, вплоть до аргона (Z =18) идет последовательная застройка М-оболочки. Она заканчивается заполнением всех состояний 3р у аргона, завершающего третий период периодической системы.
Девятнадцатый электрон калия (Z = 19) должен был бы занять состояние 3dв М-оболочке. Однако химические и оптические свойства калия, как показывает опыт, аналогичны свойствам Li и Na, у которых валентный электрон находится в s состоянии. Поэтому и у калия его девятнадцатый валентный электрон должен находиться в s состоянии. Но это состояние может быть только состояние 4s в следующей N оболочке (п = 4). Таким образом, начиная с калия, при незаполненном3dсостоянии М-оболочки, начинается застройка N-оболочки. Спектроскопические и химические свойства кальция (Z = 20) показывают, что его двадцатый электрон также размещается в состоянии 4s N-оболочки. Начиная со скандия (Z= 21), возобновляется нормальное заполнение состояний 3d, которое заканчивается у меди (Z = 29). Далее до криптона (Z = 36) происходит нормальное заполнение N-оболочки. Криптон завершает четвертый период периодической системы элементов. Элемент рубидий (Z == 37), следующий за криптоном, по своим свойствам аналогичен атомам щелочных металлов Na и К. Рассмотрение заполнения всех существующих в природе элементов не входит в нашу задачу.
Таким образом, периодичность химических свойств элементов объясняется повторяемостью электронных конфигураций. Наиболее химически активные щелочные металлы имеют по одному электрону на внешней оболочке. Электрон на новой оболочке оказывается более удаленным от атомного ядра; кроме того, взаимодействие с ядром существенно ослабляется экранирующим действием полностью застроенных внутренних электронных оболочек. Поэтому литий, натрий, калий очень легко отдают один электрон при взаимодействиях с атомами химических элементов, имеющими незавершенную оболочку: фтора, хлора, брома, кислорода, серы, селена. Поэтому же указанные металлы образуют положительные ионы, а неметаллы - отрицательные.
У инертных газов электронные оболочки заполнены целиком. Они образуют очень устойчивую систему, подобную электронной оболочке атома гелия. Поэтому неон, аргон и криптон по химическим свойствам очень близки к гелию. Атомы этих элементов химически инертны, так как у них велика энергия связи электронов с ядром.
5. 1. 10 Атомные и молекулярные спектры
Линейчатые спектры газов. Атомы вещества в разреженном состоянии испускают и поглощают лишь фотоны определенных энергий: 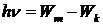 . Это означает, что частоты поглощения и излучения являются дискретными. Такие спектры называются линейчатыми. Для наблюдения линейчатого спектра испускания нужно направить на щель спектроскопа только свет, идущий от горячего газа. Если же мы хотим наблюдать линейчатый спектр поглощения того же газа, нужно пропустить через него поток света со сплошным спектром. Тогда на фоне сплошного спектра от другого источника будут видны темные линии, вызванные поглощением фотонов атомами газа.
. Это означает, что частоты поглощения и излучения являются дискретными. Такие спектры называются линейчатыми. Для наблюдения линейчатого спектра испускания нужно направить на щель спектроскопа только свет, идущий от горячего газа. Если же мы хотим наблюдать линейчатый спектр поглощения того же газа, нужно пропустить через него поток света со сплошным спектром. Тогда на фоне сплошного спектра от другого источника будут видны темные линии, вызванные поглощением фотонов атомами газа.
Исследование спектров показало, что разные линии спектра имеют разную ширину, т. е. излучение происходит не на одной частоте, а в некотором, хотя и узком частотном диапазоне. Спектральные линии не являются строго монохроматическими.
Одной из причин уширения спектральных линий является эффект Доплера (см. раздел 4. 4. 2). Поскольку атомы газа, участвуя в тепловом хаотическом движении, имеют различные скорости, то из-за влияния эффекта Доплера неподвижный наблюдатель регистрирует от удаляющихся атомов свет с несколько большей длиной волны, а от приближающихся атомов - с более короткой.
Исследования линейчатых спектров показали, что уширение спектральных линий атомных спектров всегда превышает величину, которую можно объяснить эффектом Доплера. Ширину спектральных линий неподвижных и удаленных друг от друга атомов называют естественной шириной спектральной линии. Так как любая спектральная линия имеет конечную ширину, то это означает, что энергия атома в возбужденном состоянии не имеет одного строго определенного значения. Энергия атома может отклоняться от средних значений Wn и Wk на некоторые величины DWn и DWk. Естественная ширина спектральной линии определяется суммой значений ширины двух энергетических уровней:
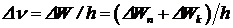 . .
| 5. 21 |
Неопределенность энергии атома в любом стационарном состоянии объясняют соотношением неопределенностей (5. 2), которое в применении к энергии имеет вид:
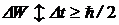 , ,
| 5. 22 |
где Dt – время жизни атома в возбужденном состоянии, имеющее порядок величины 10-8 с. Оценим естественную ширину спектральной линии для типичного случая, считая, что совершается переход из возбужденного в основное состояние (в основном состоянии время жизни практически равно бесконечности, поэтому неопределенность энергии рана нулю). Учитывая соотношения (5. 18) и (5. 19), имеем:
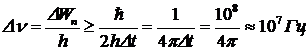
Так как видимый свет имеет частоту порядка 1014 Гц, то относительная ширина спектральной линии очень мала (Dn/n»10-7).
Ширина спектральных линий близка к естественной ширине в спектрах разреженных газов при слабом и редком взаимодействии атомов. При повышении давления газа и его температуры увеличивается частота столкновения атомов. Взаимодействия атомов приводят к уменьшению их времени жизни в возбужденных состояниях, что ведет к уширению спектральных линий. Этот процесс называется ударным уширением спектральных линий.
Сплошные спектры испускания газов. Нагретые до высокой температуры газы могут излучать свет, у которого не только линейчатый, но и сплошной спектр, например спектр солнечного света. При высокой температуре в газе имеется много свободных электронов, энергия которых не квантована, т. е. может принимать сплошной ряд значений. Энергия в виде излучения выделяется при рекомбинации свободных электронов с положительными ионами.
Характеристические рентгеновские спектры. В зависимости от разности энергий атома в двух состояниях, между которыми совершается переход, испускаемый квант электромагнитного излучения может принадлежать диапазону радиоволн, инфракрасного излучения, видимого света, ультрафиолетового или рентгеновского излучения.
Рентгеновское излучение происходит, если в атомах с порядковыми номерами Z > > 1 в результате, например, столкновения атома с заряженной частицей из внутренней К-оболочки удаляется один электрон. При этом на освободившееся место переходит один из электронов с соседней оболочки L. На это освободившееся место в свою очередь переходит один электрон с М-оболочки и т. д. Эти переходы сопровождаются испусканием дискретного спектра электромагнитного излучения, называемого характеристическим рентгеновским излучением.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|