
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Схема реакции нитрования дифенила
Схема реакции нитрования дифенила
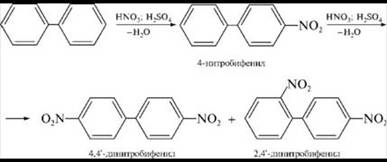
Нитрогруппа в молекуле 4-нитробифенила, являясь электроноакцепторной группой (ориентантII рода), уменьшает электронную плотность, прежде всего в бензольном кольце, в котором она находится, поэтому вторая нитрогруппа вступает в незамещённое ядро.
Внешний вид и физические свойства
Бесцветные или белые кристаллы, со специфическим запахом. Хорошо растворим в эфире, бензоле, спирте и других органических растворителях, не растворим в воде. Температура плавления 70, 5 °С, кипения 254—255 °С, относительная плотность в твёрдом виде {\displaystyle d_{4}^{25}}= 1, 156. В жидком виде плотность составляет: 0, 970 г/см3 (100 °С), 0, 889 г/см3 (200 °С), 0, 751 г/см3 (350 °С)
Температура воспламенения дифенила 113 °С, самовоспламеняется при 566 °С
Нахождение в природе и биологическая роль
Дифенил встречается в каменноугольной смоле и нефти. Ингибирует рост грибов, поэтому применяется для предохранения цитрусовых и яблок во время транспортировки. Препарат среднетоксичен, но биологически разлагается до малотоксичных соединений.
Применяется как прекурсор в синтезе полихлорированных дифенилов, а также других соединений, используемых как эмульгаторы, инсектициды и красители.
Соединение относится к пищевым добавкам, используется как консервант под кодом Е230.
Пыль дифенила в воздухе раздражает дыхательные пути и глаза. Предельно допустимая концентрация составляет 1 мг/м3
Нафталин
Простейшим из конденсированных бензоидныхуглеводородов является нафталин
Нафталин состоит из двух конденсированных бензольных колец. Два атома углерода общие для двух колец. В отличие от бензола атомы углерода в молекуле нафталина неравноценны.
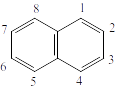
Положения 1, 4, 5 и 8 обозначаются «α », положения 2, 3, 6, 7 обозначаются «β ».
Твёрдое кристаллическое вещество с характерным запахом. В воде не растворяется, но хорошо растворим в бензоле, эфире, спирте, хлороформе.
· Химическая формула: С₁ ₀ Н₈
· Температура плавления: 80, 3 °C
· Температура кипения: 217 °C
Нафталин получают из каменноугольной смолы. Также нафталин можно выделять из тяжёлой смолы пиролиза (закалочное масло), которая применяется в процессе пиролиза на этиленовых установках. Ещё одним способом промышленного получения нафталина является деалкилирование его алкилпроизводных.
В природе нафталин выделяют термиты вида Coptotermesformosanus, чтобы защитить свои гнёзда от муравьёв, грибков и нематод.
Важное сырьё химической промышленности: применяется для синтеза фталевого ангидрида, тетралина, декалина, разнообразных производных нафталина.
Производные нафталина применяют для получения красителей и взрывчатых веществ, в медицине, как инсектицид моли в быту.
Нафталин поступает в окружающую среду с коксохимического производства, а также с производств по очистке бензола, синтезу красителей, синтетических смол, изоляционных материалов и пестицидов. Из окружающей среды он удаляется в результате окисления под действием УФ и путём биодеградации под влиянием бактерий. Продуктами окисления являются нафтохинон, бензофуранон, этоксибензофуранон и некоторые другие вещества. Отравление нафталином возможно при вдыхании паров, пыли и при проникновении через кожу, при этом происходит поражение нервной системы, желудочно-кишечного тракта, почек, поверхностное помутнение роговицы. При хронических отравлениях наблюдаются изменения в крови: разрушение эритроцитов и лейкоцитов, снижение содержания гемоглобина. Хронические отравления нафталином приводят к нарушению секреторной деятельности желудочно-кишечного тракта, белковообразовательной и антитоксической функции печени, вызывает развитие атрофического ринита и фарингита.
В человеческом организме чаще всего концентрируется в жировой ткани, где может накапливаться до тех пор, пока жировая ткань не начнёт сжигаться, и яд не попадёт в кровь, после чего наступает отравление организма (кровотечения, возникновение опухолей и т. д. ).
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|