
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Дәріс 2. Атом құрылысы және периодтық жүйе. Химиялық байланыс.
Мазмұ ны:
1. Энергияның кванттануы туралы тү сінік
2. Бордың атом моделі
3. Материяның корпускулалы-толқ ындық екі жақ тылығ ы.
4. Белгісіздік принципі
5. Толқ ындық функция
6. Квант сандары
7. Паули принципі, Хунд ережесі, ең аз энергия принципі
8. Электрондық формулалар, электрондық структуралық схемалар
9. Атом қ ұ рылысы тұ рғ ысынан қ ұ растырылғ ан периодтық заң.
10. Периодтық жү йенің қ ұ рылысы.
11. Иондану энергиясы, электрон тартқ ыштық, электр терістілік.
12. Элементтер қ асиетінің периодтылығ ы, екінші ретті периодтылық.
13. Атомдық жә не иондық радиустардың ө згеру заң дылық тары.
14. Периодтық заң жә не периодтық жү йенің маң ызы.
15. Химиялық байланыс.
1. Алғ аш энергия кванттануы туралы мә лімет 1900 ж Макс Планкпен ұ сынылды. Бө лінетін не сің ірілетін квант энергиясы Планк тең деуімен анық талады: ∆ E = hν, где h – пропорционалдық коэффициенті (Планк тұ рақ тысы), оның сандық мә ні 6, 63· 10-34 Дж· с. ν – толқ ын жиілігі. Толқ ын ү зындығ ы жә не сә улелену жиілігі бір-бірімен мына қ атынаспен λ · ν = с байланысты, мұ ндас-жарық тың жылдамдығ ы.
2. Атомның тұ рақ тылығ ын тү сіндіру ү шін дания ғ алымы Н. Бор ү ш постулат ұ сынды: 1. Электрон ядроны кез келген орбитамен емес, оның энергиясына сай тұ рақ ты орбита бойымен айналады. Стационар орбитада электрон айналып жү рген кезде энергия бө лінбейді не сің ірілмейді. Математикалық тү рде Бор постулаты 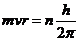 , мұ нда n-натуралды саң, m-объект массасы, r-шең бер радиусы. Осы формулағ а сү йеніп Бор сутек атомының қ ұ рылысың қ арастырды. Электрон орбитасының минималды радиусы, яғ ни минимальді потенциалды энергиясы бірге тең n мө лшеріне сә йкес келеді. n=2, 3, 4, …, мө лшерлеріне сә йкес сутегі атомының кү йі қ озғ ан деп аталады 2. Электрон бір стационар орбитадан екінші стационар орбитағ а ө ткен кезде энергия бө лінеді не сің іріледі. Квантталғ ан орбиталар радиустерінің мө лшерін, электрон қ озғ алысының жылдамдығ ын анық тайтын n саны бас кванттық сан деп аталады. 3. Энергия ү здіксіз емес, тек белгілі бір порция – квант тү рінде бө лінеді не сің іріледі. Теорияның кемшіліктері: 1. атомдар спектрлердің кейбір сипаттамаларын толық тү сіндірмейді. 2. Ө те қ арапайым молекулалардағ ы химиялық байланыстардың саң дық мә нін есептеуге мү мкіндік бермейді.
, мұ нда n-натуралды саң, m-объект массасы, r-шең бер радиусы. Осы формулағ а сү йеніп Бор сутек атомының қ ұ рылысың қ арастырды. Электрон орбитасының минималды радиусы, яғ ни минимальді потенциалды энергиясы бірге тең n мө лшеріне сә йкес келеді. n=2, 3, 4, …, мө лшерлеріне сә йкес сутегі атомының кү йі қ озғ ан деп аталады 2. Электрон бір стационар орбитадан екінші стационар орбитағ а ө ткен кезде энергия бө лінеді не сің іріледі. Квантталғ ан орбиталар радиустерінің мө лшерін, электрон қ озғ алысының жылдамдығ ын анық тайтын n саны бас кванттық сан деп аталады. 3. Энергия ү здіксіз емес, тек белгілі бір порция – квант тү рінде бө лінеді не сің іріледі. Теорияның кемшіліктері: 1. атомдар спектрлердің кейбір сипаттамаларын толық тү сіндірмейді. 2. Ө те қ арапайым молекулалардағ ы химиялық байланыстардың саң дық мә нін есептеуге мү мкіндік бермейді.
3. Зерттеулер классикалық механика заң дылық тарына ө те ұ сақ бө лшектердің бағ ынбайтының кө рсетті. Мұ ндай ө те ұ сақ микробө лшектердің қ асиеттерін кванттық немесе толқ ындық механика ғ ана тү сіндіре алады. Кванттық механика бойынша электронның толқ ындық жә не бө лшектікіндей қ асиеті болады. Яғ ни толқ ын сияқ ты оның толқ ындық жиілігі болады, ал бө лшек сияқ ты оның пішіні, массасы болады. Бө лшектік-толқ ындық дуализм математикалық тү рде Луи де Бройль тең деуімен ө рнектеледі: λ = h / mv, мұ нда m – бө лшек массасы, v - микробө лшек жылдамдығ ы.
4. Микробө лшектер дуализмін 1927 ж Вернер Гейзенбергпен ашылғ ан белгісіздік принципі тү сіндіреді: Бір уақ ытта микробө лшектердің жылдамдығ ын жә не координаторларын дә л анық тауғ а келмейді. Белгісіздік принципінің математикалық тү рі: ∆ g· ∆ v ≥ h/m. Атомда электрон ядроны толқ ын тү рінде, ядроғ п бірде жақ ындап, бірде алыстап белгілі бір толқ ын ұ зындық жә не жиілікпен айналып отырады, яғ ни ядро айналасында электрондық бұ лт тү зеді. Оның ядродан белгілі бір қ ашық тық та тығ ыздығ ы жоғ ары болады. Сонымен электрондық бұ лт – атомдағ ы электрон кү йінің кванттық -механикалық моделі. Атом айналасында электрон бұ лтының барлық жерде бірдей емес. Қ ай жерде электрон кө бірек болатын болса, сол жерде электрон бұ лтының тығ ыздығ ы жоғ ары болады. Атомдық орбиталь-электрондық бұ лт орналасқ ан ядро маң ындағ ы кеністік.
5. Кванттық механикада электрон толқ ындық функциямен сипатталады Ψ. толқ ын ядродан тарап, қ айтадан ядроғ а қ айтады, яғ ни тура жә не кері толқ ын болады. Екі толқ ын қ осылғ ан кезде (интерференция) тоқ тағ ан толқ ын тү зіледі. Австрия физигі Э. Шредингер 1926 ж тоқ тағ ан толқ ын формуласындағ ы толқ ын ұ зындығ ының орнына оның де бройль тең деуіндегі мә нін қ ойып, Шредингердің толқ ындық тең деуі деп аталатын тендеу алды:
∂ 2 Ψ / ∂ x2 + ∂ 2 Ψ / ∂ y2 + ∂ 2 Ψ / ∂ z2 = (8π 2m / h2)· (E-U)· Ψ
Мұ нда m-электрон массасы, x, y, z-электрон координаты, Е- электронның толқ ын энергиясы, U-потенциалды энергия. Толқ ындық функция оң, теріс жә не ноль мағ ыналарды қ абылдай алады. Толқ ындық функциясының квадраты Ψ 2 микробө лшектің кең істіктің белгілі бір жеріндегі болу ық тималдығ ын сипаттайды.
6. Электронның атомдағ ы кү йін тө рт тү рлі кванттық сандармен сипаттайды. 1. Бас кванттық сан п. Ол электронның ядродан қ ашық тығ ын, яғ ни энергиясын кө рсетеді. Оның мә ні тек нақ ты сан болады 1-ден ∞ дейін ө згереді. Бас кванттық санды цифрмен жә не ә ріппен белгілейді: п = 1, 2, 3, 4 немесе К, L, М жә не т. б. Дең гей саны артқ ан сайын электронның энергиясы да жоғ арлайды. Бас квант сан периодты жү йедегі период номеріне тең. 2. Орбиталь (қ осымша) квант сан l. Ол электронның энергиялық кү йін жә не орбитальдарының пішінін кө рсетеді. Орбиталь квант саны бас квант санына байланысты, оның мә ндері 0-ден n-1 дейін ө згеріп отырады. Мысалы n=3 болса l=0, 1, 2 болады. Орбиталь квант санын цифрмен немесе ә ріптермен белгілейді l=0, 1, 2, 3 немесе s-, p-, d-и f- орбитальдар. 3. Магнит квант сан m орбиталь квант санғ а байланысты болады да орбитальдардың кең істіктегі орнын кө рсетеді. Ол орбиталь квант санының l барлық мә ндеріне, 0-ді қ оса ие болады, яғ ни l=1 болса, онда m=-1, 0, +1. Ә р орбиталь квант санына сә йкес магнит квант санын жә не орбитальдар (ұ я) санын есептеуге болады: s орбитальда орбиталь саны 1, p орбитальда 3, d орбитальда 5, f орбитальда 7 электрондық кү й болады. 4. Спинді квант саны s электронның ө з осінен айналуын сипаттайды. Электрон ө з осі бойымен біріне-бірі қ арама-қ арсы бағ ытта айнала алатындық тан онын тек екі мә ні болады: + 1/2 жә не — ½. Егер екі электронның басқ а квант сандары бірдей болса, олардың спиндері ә р тү рлі болады. ондай электрондарды жұ птасқ ан деп атайды да, қ арама-қ арсы айналатынын былай ↑ ↓ белгілейді. Егер ұ яда бір электрон болса оны дара деп атап былай белгілейді ↑.
7. кө п электронды атомдарда электрондардың орналасу ережелері
| Ережелер | Мысалдары | ||||||||||||||||||||||||
| 1. Паули принципі. 1925ж. Атомда барлық квант сандары бірдей екі электрон болмайды | 7Li – 1s22s1
1s 2s
↑ ↓ ↑
| ||||||||||||||||||||||||
| 2. Гунд ережесі. Бір дең гейшеде орналасқ ан электрондардың спин квант сандарының қ осындысы максималь болуы шарт. | 14N – 1s22s22p3
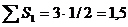 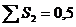
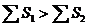
| ||||||||||||||||||||||||
| 3. Энергиясы аз дең гейшеге электрондардың алдымен орналасу принципі. Клечковский ережесі А) Электрондардың дең гейшелерге орналасуы бас жә не қ осымша квант сандарының қ осындысының (n+l) арту ретімен болады. Б) Егер бас жә не қ осымша квант сандарының қ осындысы бірдей болса, электрондарының дең гейшелерге толуы бас квант санының мә німен анық талады |
E (3p) < E (4s)
|
Ө зін ө зі бақ ылауғ а арналғ ан сұ рақ тар:
1. Атом ядросы 12 протон жә не 12 нейтроннан тұ рады, элементтің атомдық массасын, реттік номерін, валенттік электрондар санын анық таң дар.
2. Реттік номері 23 жә не 35 атомдардың электрондық дең гейлерінің санын анық та.
3. Бас квант саны 3-ке тең электрондық қ абатындағ ы электрондар саны нешеге тең?
4. Қ осымша квант саны 2, 3-ке тең болғ андағ ы дең гейлердегі магнит квант санының неше мә ні болады?
5. 3 бірдей квант саны атомдағ ы екі электронның спин квант санының мә ні қ андай?
6. Қ осымша квант санының мә ні l=0, 1, 2, 3 тең электрондар қ алай аталады?
7. Мыс атомының қ озбағ ан жағ дайдағ ы d-электрондарының қ осынды санын кө рсету керек.
8. Азот атомының электрондарының қ осынды спині нешеге тең?
9. Неліктен кө птеген элементтер атомдық массалары бө лшек мә ндерге ие болады?
10. Жаң а кө зқ арас бойынша периодтық жү йедегі аргон жә не кобальт элементтерінің орналасуын қ алай тү сіндіруге болады?
11. Қ андай элементтер ауыспалы деп аталады?
12. Гелий, неон, аргон, ксенон сияқ ты газдардың химиялық инерттілігі қ алай тү сіндіріледі?
13. Периодтық жү йедегі орнына байланысты калий, мыс, марганец, бромның қ асиеттерін салыстыр.
14. Хлорлысутек, бромдысутек, иодтысутек қ ышқ ылдарының қ айсысы кү штірек, неліктен?
15. Тө мендегі қ осылыстардағ ы химиялық байланыстың полюстілігін кө рсет: а)су немесе селенді сутек; б)хлорлысутек немесе иодты сутек; в)метан немесе аммиак?
16. Тө менде берілген элементтердің ішінен донорлар жә не акцепторларды кө рсетің дер: В, Сl, S, N (бор, хлор, кү кірт, азот).
17. Мына сұ йық тардың қ айсысы сутектік байланыс нә тижесінде ассоциацияланғ ан: кү кірттісутек қ ышқ ылы, су, балқ ытқ ыш қ ышқ ыл, тө ртхлорлы кө міртек? Бұ л қ ұ былыс осы сұ йық тардың қ асиеттеріне қ алай ә сер етеді?
18. Тө ртхлорлы кө міртек, бор хлориді, бериллий хлориді молекулаларында гибридтенудің қ андай тү рі болады, осы молекулалардың пішіні қ андай?
19. Сутектен 0, 8г атомдық сутекті алу ү шін 174, 4 кДж энергия жұ мсау керек, сутек молекуласындағ ы байланыс энергиясын есепте.
20. Сілтілік металдардың жұ мсақ тығ ының жә не балқ у температурасының тө мен болу себебі неде? Неліктен магнийдің қ аттылығ ы мен балқ у температурасы натрийге қ арағ анда жоғ ары?
Ұ сынылғ ан ә дебиеттер:
1. Омаров Т. Т., Танашева М. Р. Бейорганикалық химия (таң дамалы тараулар) Алматы, 2008ж, -543 б 2. Шоқ ыбаев Ж. Ә. Бейорганикалық жә не аналитикалық химия. Алматы, «Білім» 2004 ж, -316 б. 3. Ділманов Б. М., Ділманова З. Б. Жалпы химияның теориялық негіздері. Аматы, 2009ж, -194 б. 4. Яшкарова М. Г., Омарова Н. М., Кабдулкаримова К. К., Мусабаева Б. Х. Бейорганикалық хмиядан зертханалық жұ мыстар. Семей, 2007, -79б. 5. Шоқ ыбаев Ж. Ә., Ө нербаева З. О. т. б. Бейорганикалық химия практикумы. Алматы, 2004 ж, -164 б.
6. Бишімбаева Г. Қ. Жалпы химия. Студенттердің ө здік жұ мыстарына арналғ ан оқ у-ә дістемелік қ ұ рал. Алматы, 2007 ж, -39 б. 7. Кабдулкаримова К. К., Омарова Н. М. Студенттің ө здігінен орындауына арналғ ан ә дістемелік қ ұ рал. Семей, 2007, -39 б. 8. Д. Шрайвер., П. Эткинс. Неорганическая химия. 1, 2 том. Москва«Мир» 2009г
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|