
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ПРОГРАММНЫЕ ВОПРОСЫ ПО ДИСЦИПЛИНЕ «ХИМИЯ» 4 страница
2. 17 Показатель титрования ( рТ) отвечает тому значению рН, при котором наиболее резко изменяется окраска индикатора.
Изменение окраски индикатора происходит не при всяком изменении рН, а лишь внутри определенного интервала значений рН, которое называется интервалом перехода индикатора.
2. 18 Кривая титрования - график зависимости параметра системы, связанного с концентрацией титруемого вещества, титранта или продукта реакции, от степени протекания процесса титрования (например, от количества добавленного титранта). По оси абсцисс при построении кривых титрования обычно откладывают объём добавленного стандартного раствора титранта или степень оттитрованности (f).
f = 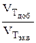 f =
f = 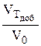 (если
(если  На оси ординат, в случае кривых титрования для кислотно-основного титрования, откладывают значение рН раствора. В зависимости от определяемого вещества и титранта различают 4 основных случая кислотно-основного титрования и, соответственно, 4 типа кривых титрования:
На оси ординат, в случае кривых титрования для кислотно-основного титрования, откладывают значение рН раствора. В зависимости от определяемого вещества и титранта различают 4 основных случая кислотно-основного титрования и, соответственно, 4 типа кривых титрования:
- титрование сильной кислоты сильным основанием, - титрование сильного основания сильной кислотой, - титрование слабой кислоты сильным основанием, - титрование слабого основания сильной кислотой.
Для выбора индикатора с помощью кривой титрования на графике кривой наносят интервал перехода индикатора. У правильно выбранного индикатора интервал перехода полностью или частично перекрывается скачком титрования. Если такого перекрывания нет, индикатор для данного титрования не подходит. На рис. 7. 1. нанесены интервалы перехода нескольких индикаторов. Тропеолин ОО имеет интервал перехода в области рН от 1, 4 до 3, 2 и для данного титрования является неподходящим. Метиловый оранжевый с интервалом перехода от 3, 1 до 4, 4 частично захватывает скачок титрования и может быть использован для этого титрования, однако для 0, 01 М HCl он уже не подходит, так как уменьшается скачок титрования с уменьшением концентрации HCl. Хорошо подходят бромтимоловый синий (9, 0–7, 6) и фенолфталеин (8, 2–10, 0).
2. 19 Методы, в которых рабочими растворами являются окислители (KMnO4, K2Cr2O7, I2и др. ), называют иначе оксидиметрией. С их помощью определяют количественное содержание веществ, обладающих восстановительными свойствами. Методы, в которых рабочими растворами или титрантами являются растворы восстановителей (аскорбиновой кислоты, гидразина, гидрохинона), называются редуктометрией. Они служат для количественного определения веществ, проявляющих окислительные свойства.
Следует отметить, что деление методов окислительно-восстановительного титрования на оксидиметрию и редуктометрию является условным, т. к. в рамках одного и того же метода в качестве титрантов могут быть использованы как восстановители, так и окислители. Так, например, в перманганатометрии рабочими растворами являются раствор KMnO4(окислитель) и растворH2C2O4илиNa2C2O4(восстановитель), а в иодометрии – растворI2(окислитель) и растворNa2S2O3(восстановитель). Обычно названия методов редоксиметрии происходят от названия используемых в них рабочих растворов. Чаще всего применяют на практике следующие методы окислительно-восстановительного титрования: а) перманганатометрию (титрант - растворKMnO4); б) иодометрию (титрант – растворI2); в) хроматометрию (титрант – растворK2Cr2O7); г) броматометрию (титрант – растворKBrO3);
д) нитритометрию (титрант – растворNaNO2). Окислительно-восстановительные процессы лежат в основе горения топлива, коррозии металлов, электролиза, металлургии и т. д.
С окислительно-восстановительными реакциями связаны дыхание, обмен веществ, гниение и брожение, фотосинтез и нервная деятельность живых организмов. В связи с этим редоксиметрия является одним из важнейших методов физико-химического исследования в химии, биологии, физиологии и медицине.
Следует, однако, отметить, что реакции окисления-восстановления протекают сложнее, чем реакции нейтрализации или ионного обмена. Во многих случаях они осуществляются в несколько стадий и с участием не только двух основных реагентов (окислителя и восстановителя), но и других соединений: воды, кислот или щелочей. Это приводит к тому, что скорость многих окислительно-восстановительных реакций значительно ниже скорости ионообменных реакций. При участии одних и тех же исходных веществ в зависимости от условий проведения реакции, кислотно-основного характера реакционной среды возможно образование разных конечных продуктов, одновременное протекание нескольких параллельных реакций, обратимость происходящих процессов.
Таким образом, далеко не каждая окислительно-восстановительная реакция может быть использована в титриметрии.
2. 20 Фиксирование точки эквивалентности при применении методов редоксиметрии в ряде случаев можно производить и без индикаторов, когда окраска титранта (титрующего раствора) заметно изменяется, как например при перманганатометрии. Также при использовании раствора элементарного иода или брома окраска анализируемого раствора меняется от бесцветной к желтой, но в случае иодометрии целесообразно применять крахмал, который в присутствии свободного иода окрашивается в интенсивно-синий цвет вследствие образования адсорбционного соединения синего цвета.
Редокс-индикаторы, как и рН-индикаторы, имеют интервал Δ Е перехода окраски и подбираются для титрования по значению Е в точке эквивалентности или по скачку на кривой титрования.
Специфические индикаторы – это вещества, которые образуют интенсивно окрашенное соединение с одним из компонентов окислительно-восстановительной системы. Например, при титровании иода используют крахмал, образующий темно-синее соединение с J3- - ионами. Окислительно-восстановительные (редокс) индикаторы – это соединения, в основном органические, способные к окислению или восстановлению, причем их окисленная и восстановленная формы имеют разную окраску. Фиксирование точки эквивалентности 1. По изменению окраски титруемого раствора, происходящего от добавления избыточной капли окрашенного титранта (KmnO4). 2. С помощью специфических индикаторов (йодометрия). 3. С помощью окислительно-восстановительных индикаторов, которые имеют различную окраску в окислительной и восстановленной формах (дифениламин -восстановленная форма бесцветная, окисленная сине-фиолетовая)
2. 21 Перманганатометрия – один из наиболее часто применяемых методов окислительно-восстановительного титрования. В качестве титранта используют раствор перманганата калия, окислительные свойства которого можно регулировать в зависимости от кислотности раствора. Окончание титрования устанавливается по отсутствию розовой окраски перманганат-иона или с помощью индикатора (например, дифениламина или ферроин). В качестве рабочего раствора применяют перманганат калия KMnO4. Перманганатометрия — это титриметрический (объёмный) метод определения веществ, основанный на реакциях окисления с участием перманганат-ионов. В основе перманганатометрического титрования лежит окислительно-восстановительный процесс с участием пары Mn(VII)/Mn(II) (Еo=+1, 52 В) в кислой среде:
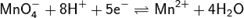
При использовании раствора перманганата калия в качестве титранта можно определять, например, ионы железа, пероксид водорода, оксалаты:
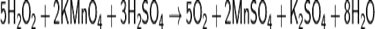
Конечную точку титрования определяют без индикатора по появлению собственной фиолетовой окраски ионов MnO4-.
Метод перманганатометрии можно применять для определения окислителей. В этом случае применяют обратное титрование, прибавляя и определяемому веществу заведомо избыточное точно отмеренное количество раствора восстановителя. Затем избыток восстановителя титруют раствором KMnO4.
2. 22 Методы осадительного титрования основаны на реакции количественного (полного) осаждения анализируемого вещества или иона. Методы осаждения, как и весовой анализ, основаны на теории осаждения и тесно связаны с понятием «ПР» - произведения растворимости. Точку эквивалентности определяют химическим путём – индикаторами на избыток титранта (или исчезновения титруемого вещества), а так же используют инструментальные методы, т. е. физико-химические свойства раствора в процессе титрования – электропроводность, поглощение, отражение света и д. р.
К реакциям осаждения предъявляются следующие требования:
1. Осадок, осаждаемый при титровании должен быть практически нерастворимым. Для достаточной точности осадительного титрования применяют реакции осаждения, при которых образуются осадки с ПР ≤ 10-10. 2. Скорость образования осадка должна быть большой.
3. Отсутствие процесса соосаждения. 4. Наличие подходящего индикатора. Классификация: Наиболее широкое применение нашли следующие виды осадительного титрования: 1. Аргентометрия. Титрант - нитрат серебра, используется для количественного анализа хлоридов, бромидов и йодидов. 2. Тиоцианометрия (Роданометрия или метод Фольгарда) титрант – тиоцианат аммония, используется для количественного определения ионов серебра. 3. Меркурометрия: титрант – нитрат ртути (I), используется для определения галоидов. Jnd[FeNCS]2+ обесцвечивается, дифенилмарбазонадсорбируясь образует осадок интенсивного синего цвета.
4. Сульфатометрия: титрант - серная кислота, используется для определения солей бария.
2. 23 Комплексиметрическое (комплексометрическое) титрование
В основе метода лежит реакция комплексообразования:
М + nL = MLn, где М – катион металла комплексообразователя; L – лиганд; MLn – продукт реакции (комплекс); n – число лигандов.
Требования к реакциям в комплексиметрии: 1. Стехиометричность. Побочные реакции должны отсутствовать. 2. Полнота протекания реакции. Реакция должна протекать практически до конца (не менее 99, 99%). 3. Реакция комплексообразования должна протекать быстро, практически мгновенно. 4. Реакция должна обеспечивать отчетливую фиксацию КТТ. Классификация методов комплексиметрии:
Взависимости от природы реагента или образующихся комплексов различают методы: а) Меркуриметрия – метод, основанный на реакции образования растворимых, устойчивых, слабо диссоциирующих комплексовртути(II); титрант – раствор Hg(NO3)2.
б) Цианометрия – метод, основанный на использовании реакций образования растворимых, устойчивых, слабо диссоциирующихцианидных комплексов металлов, содержащих в качестве лигандовцианогруппы CN–. в) Фторометрия – метод, основанный на реакциях образования фторидных соединений металлов (Al, Zr, Th). г) Комплексонометрия (хелатометрия) – метод, основанный на использовании реакций образования соединений катионов металлов с комплексонами.
23. 24 Комплексонометрия (трилонометрия) - титриметрический метод анализа, основанный на реакциях взаимодействия комплексонов (чаще всего трилона Б), катионами щелочноземельных и тяжелых металлов, которые приводят к образованию растворимых в воде бесцветных прочных внутрикомплексных соединений. Трилон Б (комплексон III) образует внутрикомплексные соединения с катионами металлов за счет валентных связей с карбоксильными группами, вытесняя из них атомы водорода, а также за счет координационных связей ионов-комплексообразователей с атомами азота. Комплексоны являются полидентатнымилигандами, которые образуют со многими катионами (Са2+, Ва2+, Sr2+, Mg2+, Со2+, Сu2+, Bi3+, Al3+, Zn2+, Fe3+, Ni2+ и др. ) очень прочные, хорошо растворимые в воде, бесцветные внутрикомплексные (хелатные) соединения. Внутрикомплексные соли образуются всегда в тех случаях, когда катионы металла - комплексообразователя замещают активные атомы водорода функциональных групп органического соединения, а также с определенными его группами образуют координационные (донорно-акцепторные) связи.

2. 25 Способы фиксирования конечной точки титрования. При комплексонометрическом титровании используют металлохромные индикаторы (металлоиндикаторы). Металлоиндикаторы - это органические красители (мурексид, эриохром черный Т, эриохром сине-черный Б, цинкон и др. ), которые образуют с определяемыми ионами растворимые в воде окрашенные комплексные соединения, менее прочные, чем комплекс катиона металла с трилоном Б.
2. 26 Самым распространенных способов определения жесткости воды является трилонометрический метод (метод титрования), при котором для титрования пробы воды используется трилон Б (комплексон III). Определяют общую жесткость титрованием анализируемой пробы воды при определенном значении рН трилоном Б в присутствии индикатора. Метод основан на свойстве ионов кальция и магния образовывать с индикатором окрашенные индикаторные комплексные соединения. В качестве индикатора используют кислотный хромтемно-синий, или кислотный хромсиний К, или эриохром-черный Т. При наличии в пробе воды ионов кальция и магния индикатор окрашивает воду в розовый цвет. Добавление трилона Б к окрашенной пробе воды разрушает эти комплексные соединения, т. к. прочность комплексов ионов кальция и магния с трилоном Б выше индикаторных. При этом восстанавливается цвет свободного индикатора, что свидетельствует о завершении реакции. Так как каждый миллилитр 0, 1 н раствора трилона Б (комплексона III) соответствует 0, 1 мг-экв/кальция и магния (жесткости), то общая жесткость анализируемой пробы воды может быть вычислена по формуле, мг-экв/л
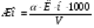 , где а - объем раствора трилона Б (комплексона III), пошедшего на титрование, мл; К - коэффициент децинормальности этого раствора; н - нормальность раствора, мг-экв/л; V – объем анализируемой пробы воды, мл. Жесткость воды, обусловленная присутствием в ней только ионов кальция, называется кальциевой жесткостью Жса> мг-экв/л. Ионы кальция Са2+ в маломинерализированных водах по количеству занимают первое место. Определение Жса производится по тому же методу, что и определение Ж0. Разница заключается только в том, что проба воды должна быть сильнощелочная, поэтому к ней добавляют раствор КОН, в присутствии которого ионы Мд2+ практически полностью выпадают из раствора, а в качестве индикатора используют мурексид, окрашивающий щелочной раствор в присутствии ионов Са-+ в красный цвет, а при отсутствии ионов кальция в лиловый. Магниевая жесткость Жмд, мг-экв/л, обусловливается наличием в пробе воды только ионов магния Мg 2+. Эта жесткость характерна для высокоминерализированных вод, где концентрация ионов Мд2+ может достигать нескольких граммов на литр.
, где а - объем раствора трилона Б (комплексона III), пошедшего на титрование, мл; К - коэффициент децинормальности этого раствора; н - нормальность раствора, мг-экв/л; V – объем анализируемой пробы воды, мл. Жесткость воды, обусловленная присутствием в ней только ионов кальция, называется кальциевой жесткостью Жса> мг-экв/л. Ионы кальция Са2+ в маломинерализированных водах по количеству занимают первое место. Определение Жса производится по тому же методу, что и определение Ж0. Разница заключается только в том, что проба воды должна быть сильнощелочная, поэтому к ней добавляют раствор КОН, в присутствии которого ионы Мд2+ практически полностью выпадают из раствора, а в качестве индикатора используют мурексид, окрашивающий щелочной раствор в присутствии ионов Са-+ в красный цвет, а при отсутствии ионов кальция в лиловый. Магниевая жесткость Жмд, мг-экв/л, обусловливается наличием в пробе воды только ионов магния Мg 2+. Эта жесткость характерна для высокоминерализированных вод, где концентрация ионов Мд2+ может достигать нескольких граммов на литр.
2. 27 Органическая химия – это химия углеводородов и их функциональных производных. Специфика углеводородов в сравнении с водородными соединениями других элементов заключается в особых свойствах атома углерода. Находясь в четвертой группе второго периода периодической системы, углерод при образовании химических связей не имеет на валентной оболочке ни электронных пар, ни вакантных орбиталей; это обстоятельство обусловливает высокую химическую устойчивость соединений. Кроме атомов углерода и водорода в состав органических соединений входят и другие атомы периодической системы – O, S, N, P, атомы галогенов и другие. Производные углеводородов, в которых один или несколько атомов водорода замещены на другие атомы или группы атомов (функциональные группы), называют функциональными производными. Теория химического строения А, М. Бутлерова Теория химического строения А. М. Бутлерова (1861) явилась фундаментом, на котором строилась теоретическая органическая химия. Основные ее положения в современной формулировке сводятся к следующему: 1) Атомы в молекулах соединены друг с другом в определенной последовательности в соответствии с их валентностью. Углерод во всех органических соединениях четырехвалентен. Химические формулы, отражающие порядок соединения атомов, называют структурными. Структурные формулы могут быть изображены и в сокращенном виде, например, CH3− CH2− NH2 илиC2H5NH2. 2) Свойства веществ зависят не только от того, атомы каких элементов и в каком количестве входят в состав молекул, но и от последовательности соединения атомов в молекулах, т. е. от химического строения молекул. 3) Атомы или группы атомов, образующие молекулу, взаимно влияют друг на друга.
4) Строение молекул может быть установлено на основе изучения их химических свойств. 3. Изомерия органических веществ
Явление изомерии – наглядная иллюстрация второго положения теории А. М. Бутлерова. Изомеры – вещества, имеющие одинаковый качественный и количественный состав, но различающиеся по строению, и, вследствие этого, по физическим и химическим свойствам. Различают структурную и пространственную изомерию. Структурная изомерия связана с различным порядком соединения атомов в молекулах. Разновидности структурной изомерии: 1. Изомерия углеродного скелета. Этот тип изомерии обусловлен возможностью построения различных углеродных скелетов из n углеродных атомов, если n больше или равно четырем. Например, молекулярной формуле C4H10соответствуют два вещества – бутан и 2-метилпропан (изобутан): CH3− CH2− CH2− CH3; CH3− CH− CH32-метилпропан бутан | CH3 2. Изомерия положения
Атомы или группы атомов (заместители), не входящие в состав скелета, могут быть соединены с различными углеродными атомами цепи: Cl− CH2− CH2− CH2− CH3 1-хлорбутан К такому типу изомерии можно отнести изомерию, обусловленную различным положением кратных связей: CH2=CH− CH2− CH3; CH3− CH=CH− CH3 бутен-1 бутен-2 3. Межклассовая изомерия Изомерами могут быть соединения, содержащие различные функциональные группы и относящиеся к различным классам органических соединений, например: CH3− CH2− NO2; H2N− CH2− COOH нитроэтанаминоуксусная кислота. Пространственная изомерия обусловлена различным расположением в пространстве атомов и групп атомов в молекулах с одинаковой последовательностью соединения атомов. Разновидности пространственной изомерии: 1. Геометрическая изомерия
Этот вид изомерии характерен для соединений, содержащих двойную связь или цикл. В таких молекулах часто можно провести условную плоскость таким образом, что заместители у различных атомов углерода могут оказаться по одну сторону (цис-) или по разные стороны (транс-) от этой плоскости 2. Оптическая изомерия
Оптическими изомерами называют молекулы, зеркальные изображения которых не совместимы друг с другом. Таким свойством обладают молекулы, имеющие асимметрический центр – атом углерода, связанный с четырьмя различными заместителями.
2. 28 Мономеры -низкомолекулярное вещество, образующее полимер в реакции полимеризации. Полимеры или высокомолекулярные соединения (ВМС) – это сложные вещества с большими молекулярными массами, молекулы которых (макромолекулы) состоят из большого числа регулярно или нерегулярно повторяющихся структурных единиц (звеньев) одного или нескольких типов. Молекулярные массы полимеров могут быть от нескольких тысяч до миллионов. Получение полимеров К образованию ВМС приводят три процесса: 1. Реакция полимеризации – процесс, в результате которого молекулы низкомолекулярного соединения (мономеры) соединяются друг с другом при помощи ковалентных связей, образуя полимер. Эта реакция характерна для соединений с кратными связями. 2. Реакция поликонденсации – процесс образования полимера из низкомолекулярных соединений, содержащих 2 или несколько функциональных групп, сопровождающийся выделением за счет этих групп, таких веществ, как вода, аммиак, галогеноводород и т. п. (Капрон, нейлон, фенолформальдегидные смолы). 3. Реакция сополимеризации – процесс образования полимеров из двух или нескольких разных мономеров. (Получение бутадиенстирольного каучука).
Химические свойства полимеров зависят от их состава, молекулярной массы и структуры, вследствие наличия двойных связей и функциональных групп. Отдельные макромолекулы могут ² сшиваться² поперечными связями. Это процесс вулканизации и перевод линейных макромолекул термореактивных полимеров в сетчатые структуры. При вулканизации происходит взаимодействие каучука с серой (0. 5 - 5% серы) с образованием резины или эбонита (20% и более серы ). К реакциям взаимодействия функциональных групп с низкомолекулярными веществами относятся галогенирование, гидролиз и д. р. Полимеры могут подвергаться деструкции, т. е. разрушению под действием кислорода, света, теплоты, радиации. В результате деструкции уменьшается молекулярная масса макромолекул, изменяются физические и химические свойства полимеров и он становится непригодным для дальнейшего применения, Этот процесс называется старением полимеров. Чтобы замедлить этот процесс вводят стабилизаторы, чаще всего антиоксиданты. Механические свойства полимеров определяются элементным составом, молекулярной массой, структурой и физическим состоянием макромолекул. С ростом молекулярной массы механическая прочность возрастает, а также при переходе от линейных к разветвленным и далее к сетчатым структурам.
Стереорегулярные структуры имеют большую прочность, чем полимеры с разупорядоченной структурой. Самая высокая прочность у полимеров наблюдается в кристаллическом состоянии. Механическую прочность можно повысить добавлением наполнителей - сажи, мела, армированием стекловолокном.
Электрические свойства полимеров. Вещества делятся на диэлектрики, полупроводники и проводники. Диэлектрики имеют очень низкую проводимость (< 10ˉ 8 Омˉ 1× смˉ 1), которая увеличивается с повышением температуры. Внешнее электрическое поле поляризует диэлектрики, т. е. определенно ориентирует молекулы. Внутри возникает собственное электрическое поле, которое ослабляет воздействие внешнего поля. Характеризуется это диэлектрической проницаемостью. При высоком напряжении внешнего электрического поля диэлектрик теряет свои электроизоляционные свойства. Это напряжение называется напряжением пробоя, а отношение напряжение пробоя к толщине диэлектрика - электрической прочностью. Большинство полимеров относится к диэлектрикам и определяются эти свойства наличием полярных групп в макромолекулах (Clˉ, OHˉ, COOHˉ, и т. п. ) - они ухудшают их диэлектрические свойства. Полимеры, не имеющие этих групп: фторопласт, полиэтилен - хорошие диэлектрики. Увеличение молекулярной массы улучшает диэлектрические свойства. При переходе от стеклообразного к высокоэластичному и вязкотекучему состояниям удельная электрическая проводимость возрастает. Для улучшения диэлектрических свойств необходимо удалять из полимеров ионы и примеси. OHˉ обуславливает гидрофильность полимеров. Они поглощают воду. В результате чего увеличивается электропроводность. OHˉ необходимо связывать между собой или с другими группами. Диэлектрики применяются в электротехнике и радиотехнике как материалы различных электротехнических изделий, защитных покрытий кабелей, проводов, изоляционных эмалей ионы и лаков. Некоторые полимеры обладают полупроводниковыми свойствами (проводимость 10ˉ 10 - 10ˉ 4 Ом–1. см–1), это полимеры с сопряженными двойными связями, у них есть делокализованные p - электроны. К ним относят полиацетилен ( -CH = CH - ) n, поливинилен и др.
ПРОГРАММНЫЕ ВОПРОСЫ ПО ДИСЦИПЛИНЕ «ХИМИЯ»
Раздел I.
1. Введение. Основные понятия химии: атом, молекула, химический элемент, атомная и молекулярная массы, моль, эквивалент. Закон сохранения массы. Закон Авогадро и следствия из него. Закон эквивалентов. Правила вычисления эквивалентов элементов и соединений.
2. Основные классы неорганических соединений. Оксиды. Основания. Кислоты. Соли. Классификация, номенклатура, способы получения и химические свойства.
3. Строение атома. Составные части атома: ядро (протоны, нейроны), электроны, их заряд и масса. Квантовые числа. Атомные орбитали. Принцип Паули. Распределение электронов по энергетическим уровням и подуровням. Принцип наименьшей энергии. Правило Клечковского. Электронные формулы, их графическая запись. Правило Хунда (Гунда).
4. Периодическая система химических элементов и электронное строение атома. Современная формулировка ПЗ. Физический смысл порядкового номера элемента в ПС. Структура ПС. Характер изменения свойств элементов в ПС: радиус атомов; энергия ионизации, сродство к электрону, электроотрицательность; металлические и неметаллические, окислительно-восстановительные свойства элементов, кислотно-основные свойства гидроксидов.
5. Химическая связь и строение молекул. Основные типы химической связи. Ковалентная связь. Основные положения метода валентных связей. Способы образования ковалентных связей. Ионная связь. Водородная связь. Металлическая связь.
6. Элементы термохимии. Основные понятия: термохимия, тепловой эффект, энтальпия (стандартная энтальпия), энтропия, энергия Гиббса, термохимические реакции (экзотермические, эндотермические). Закон Гесса. Следствия из закона Гесса.
7. Химическая кинетика и равновесие. Скорость химической реакции. Химическая кинетика. Зависимость скорости реакции от концентрации и природы реагирующих веществ. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Зависимость скорости реакции от присутствующих катализаторов. Необратимые и обратимые реакции. Химическое равновесие. Смещение равновесия. Принцип Ле Шателье.
8. Растворы. Общая характеристика. Растворимость веществ. Способы выражения концентрации растворов. Пересчеты концентрации.
9. Растворы электролитов. Электролитическая диссоциация. Сила электролитов. Степень и константа диссоциации. Закон разбавления Оствальда. Диссоциация кислот, оснований, амфотерных гидроксидов, солей. Ионно-молекулярные уравнения. Диссоциация воды. Ионное произведение воды. Водородный показатель. Способы вычисления рН в растворах кислот и оснований. Гидролиз солей. Степень и константа гидролиза. Смещение гидролиза.
10. Комплексные соединения. Основные положения координационной теории Вернера. Классификация комплексных соединений. Номенклатура комплексных соединений. Диссоциация комплексных соединений. Константа нестойкости. Константа устойчивости.
11. Окислительно-восстановительные процессы. Окислительно-восстановительные реакции (сущность, типы). Составление уравнений о-в реакций. Важнейшие окислители и восстановители.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|