
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ПРОГРАММНЫЕ ВОПРОСЫ ПО ДИСЦИПЛИНЕ «ХИМИЯ» 3 страница
2. 2 Реакции, применяемые в качественном химическом анализе, чащё всего проводят в растворах. Анализируемое вещество сначала растворяют, а затем действуют на полученный раствор соответствующими реактивами. Для растворения анализируемого вещества применяют дистиллированную воду, уксусную и минеральные кислоты, царскую водку, водный раствор аммиака, органические растворители и т. п. Чистота применяемых растворителей является важным условием для получения правильных результатов.
Переведенное в раствор вещество подвергают систематическому химическому анализу. Систематический анализ состоит из ряда предварительных испытаний и последовательно выполняемых операций. Химический анализ исследуемых веществ в растворах называют анализом мокрым путем. В некоторых случаях вещества анализируют сухим путем, без перевода их в раствор. Чаще всего такой анализ сводится к испытанию способности вещества окрашивать бесцветное пламя горелки в характерный цвет или придавать определенную окраску плаву (так называемому перлу), полученному при нагревании вещества с тетраборатом натрия (бурой) или фосфатом натрия («фосфорной солью») в ушке из платиновой проволоки. Например, соединения хрома окрашивают перл тетрабората или фосфата натрия в изумрудно-зеленый цвет. Реакции окрашивания пламени и получение окрашенных перлов проводят с небольшим количеством вещества, которое вносят на платиновой или нихромовой проволоке в пламя газовой горелки или паяльной лампы. К реакциям сухим путем относят также реакции, протекающие при растирании порошков исследуемых веществ с твердыми реагентами. Большинство таких реакций протекает при участии влаги, содержащейся в воздухе.
2. 3 Качественный химический анализ - это определение химических элементов, ионов, атомов, атомных групп, молекул и функциональных групп (например: карбоквильной – СООН и т. д. ) в анализируемом веществе. Для удобства анализа, схожие по свойствам катионы и анионы объединяют в аналитические группы. Существует несколько вариантов классификации катионов и анионов.
Один из вариантов классификации катионов, который разработал еще Н. А. Меншуткин, основан на применении групповых реактивов: соляной кислоты, растворов сероводорода, сульфида и карбоната аммония. В соответствии с взаимодействием этих реактивов с катионами, выделено пять аналитических групп.
1-ая аналитическая группа: Ионы натрия, аммония, калия, рубидия, цезия, лития, магния. Группового реактива нет.
2-ая группа: Ионы кальция, стронция, бария. Групповым реактивом данной группы является карбонат аммония (натрия), осаждающий эти катионы в виде нерастворимых карбонатов МеСО3.
3-ая группа: Ионы бериллия, железа, алюминия, хрома, кобальта, никеля, цинка, марганца. Групповой реактивы – сульфид аммония, осаждающий эти катионы в виде нерастворимых сульфидов или гидроксидов. Первая подгруппа: бериллий, алюминий, хром – осаждаются в виде гидроксидов. Вторая подгруппа: железо, кобальт, никель, цинк, марганец – осаждаются в виде сульфидов.
В отличие от катионов четвертой и пятой группы, эти катионы не осаждаются сероводородом в кислой среде. 4-ая группа: Ионы ртути, меди, висмута, кадмия, олова, сурьмы. Все указанные катионы осаждаются в виде сульфидов раствором сероводорода.
5-ая группа: Ионы свинца, серебра, золота, меди (+1), ртути (+1). Эти катионы образуют нерастворимые хлориды, выпадающие при взаимодействии солей указанных катионов с растворимыми хлоридами или соляной кислотой. В соответствии с положением элементов в периодической системе можно выделить три группы катионов: Катионы s-элементов: K, Na, Li, Cs, Fr, Rb, Ca, SrBa.
Катионы p-элементов: Bi, Sb, Al, Pb, Sn. Катионы d-элементов: переходные элементы. (другая классификация). Классификация анионов базируется на растворимости бариевых солей. Анионы, входящие в первую группу анионов, образуют растворимые соли бария, анионы второй группы – нерастворимые.
2. 4 Химические методы основаны на использовании количественно протекающих, различных по типу химических реакций: обменных, осадительных, окислительно-восстановительных и реакций комплексообразования. К химическим относятся гравиметрический и титриметрический (объемный) методы анализа. Гравиметрический метод анализа основан на измерении массы определяемого компонента после его выделения в виде гравиметрической формы. Метод характеризуется высокой точностью, но длителен и трудоемок. В фармацевтическом анализе его применяют в основном для определения влажности и зольности лекарственных препаратов.
Титриметрический метод анализа основан на введении в точно измеренный объем раствора анализируемого вещества точно отмеренного объема раствора известной концентрации — титранта. Титрант вводится до тех пор, пока анализируемое вещество полностью прореагирует с ним. Этот момент называют конечной точкой титрования и устанавливают с помощью специальных химических индикаторов или инструментальными методами.
2. 5 По своему характеру ошибки анализа подразделяются на систематические, случайные и промахи. 1. Систематические– погрешности, одинаковые по знаку и влияющие на результат в сторону его увеличения, либо в сторону уменьшения.
а) Методические – это ошибки, которые зависят от особенности применяемого метода (неполное протекание реакции, частичное растворение осадка, свойство индикатора).
б) Оперативные – недостаточное промывание осадка на фильтре, ошибки приборные или реактивов, неравноплечность весов.
в) Индивидуальные – ошибки лаборантов (способность точно определятьокраску при титровании, психологические ошибки).
г)Приборные или реактивные (эти ошибки связаны с недостаточной точностью используемых приборов, ошибки лаборанта).
2. Случайные- они неизбежны при любом определении. Они могут быть значительно уменьшены при увеличении числа параллельных определений. 3. Промахи- грубые ошибки, которые обусловлены от неправильного подсчета разновесок, поливания части раствора, просыпания осадка. Способы устранения ошибок- использование качественных реактивов, исправно работающих приборов, так же способствует устранению ошибки увеличение числа опытов.
2. 6 Гравиметрическим анализом называют метод количественного химического анализа, основанный на точном измерении массы определяемого вещества или его составной части, выделенной в элементарном виде, или в виде малорастворимого соединения определенного состава. Гравиметрические методы делятся на три группы: методы осаждения, методы отгонки и методы выделения. Наиболее распространены методы осаждения, поэтому можно встретить и такую формулировку: гравиметрия – метод количественного анализа, в котором переведенную в раствор составную часть пробы осаждают в виде малорастворимого соединения, по массе которого на основе законов стехиометрии находят количество (массу, массовую долю) определяемого компонента. Гравиметрические методы разработаны для большинства неорганических анионов и катионов, для нейтральных соединений таких, как вода, диоксид серы, углекислый газ, йод а также для целого ряда органических соединений. Достоинством гравиметрических методов является их высокая точность: при анализе простых образцов с содержанием определяемого аналита более 1% погрешность анализа можно снизить до 0. 1 – 0. 2 % что редко удается другими методами. При увеличении сложности состава образца погрешности неизбежно возрастают или приходится затрачивать массу времени на их преодоление. Недостатками гравиметрических методов являются, во – первых, то, что реагенты, используемые в гравиметрии, за редким исключением, не очень специфичны, поскольку они способны образовывать осадки с группой ионов. Следовательно, требуется предварительное отделение или маскирование мешающих ионов. Во – вторых, как следует из схемы 3. 1, в которой представлена последовательность операций гравиметрического анализа в самом общем случае, его длительность и трудоемкость. Поэтому эти методы оправдывают себя, как правило, при анализе единичных образцов, когда требуется высокая точность анализа. Для вычислений результатов в гравиметрическом анализе нередко применяют фактор пересчета Ф (аналитический фактор), представляющий собой отношение молярной массы определяемого вещества к молярной массе вещества, находящегося в осадке:
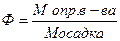 Используя фактор пересчета, можно рассчитать массовую долю (%) элемента (или другой составной части вещества) по готовой формуле:
Используя фактор пересчета, можно рассчитать массовую долю (%) элемента (или другой составной части вещества) по готовой формуле:
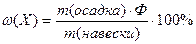
2. 7 Под растворимостью понимают концентрацию вещества в насыщенном растворе. Факторы, влияющие на растворимость осадков. Растворимость малорастворимых соединений, в отличие от ПР, не является постоянной величиной. На ее значение могут влиять:
Температура. Растворимость большинства малорастворимых соединений с увеличением температуры увеличивается.
Присутствие в растворе ионов, одноименных с ионами осадка. Как правило, в подобных ситуациях растворимость понижается. Это легко объясняется с позиций теории химического равновесия. Любой малорастворимый электролит в растворе диссоциирует:
MmAn«mMn++nAm-. Солевой эффект. Это увеличение растворимости малорастворимого соединения в присутствии индифферентного электролита (электролита, не имеющего с осадком общих ионов). Явление солевого эффекта объясняется увеличением ионной силы раствора и изменением активности ионов в растворе. .
Кислотность среды. Величина рН раствора влияет на растворимость в тех случаях, когда малорастворимое соединение – это кислота или гидроксид, а также если в состав осадка входят гидролизующиеся катион или анион.
2. 8 Метод осаждения – это метод, при котором навеску анализируемого вещества растворяют и прибавляют 1, 5-кратный избыток реагента-осадителя, соблюдая необходимые условия осаждения. Полученный осадок называют осаждаемой формой. Осадок отделяют от раствора (чаще всего фильтрованием), промывают, затем высушивают или прокаливают, получая гравиметрическую (весовую) форму. Массу определяемого компонента mа рассчитывают по формуле:
ma =mBF •100/а (%)
где mа — масса высушенного или прокаленного осадка, г; F — гравиметрический фактор, определяемый по химической формуле гравиметрической формы; а — навеска анализируемого вещества, г. Выбор осадителя. Осадитель выбирают, исходя из ряда требований, предъявляемых к осадку. 1. Получающийся осадок (так называемая осаждаемая форма) должен прежде всего обладать как можно меньшей растворимостью в воде. Например, ион Ba2+образует несколько малорастворимых солей: карбонат, оксалат, хромат и сульфат. Очевидно, что при гравиметрическом определении ионы Ва2+ следует осаждать в виде сульфата BaSO4, имеющего наименьшую величину произведения растворимости. 2. Кроме того, получаемый осадок должен легко отфильтровываться и хорошо отмываться от примесей. Эти свойства наиболее характерны для крупнокристаллических осадков. 3. Наконец, осаждаемая форма должна при прокаливании полностью превращаться в весовую форму. Состав весовой формы должен точно соответствовать определенной химической формуле иначе невозможно провести вычисление результатов анализа. Например, осадок гидроокиси железа Fe(OH)3 в результате прокаливания полностью переходит в оксид железа Fe2O3. Последнюю и называют весовой формой и именно ее взвешивают в конце анализа. Помимо этого, весовая форма не должна изменять своей массы на воздухе из-за поглощения паров воды и двуокиси углерода или вследствие частичного разложения. Для точности определения желательно также, чтобы весовая форма имела возможно большую молекулярную массу и содержала как можно меньше атомов определяемого элемента в молекуле. При этом погрешности определения (ошибки взвешивания, потери при перенесении осадка на фильтр и т. п. ) меньше сказываются на результате анализа. 4. Кроме всех этих требований, предъявляемых к осадку при выборе осадителя, учитывают летучесть последнего. В качестве осадителя всегда предпочитают более летучее вещество, если примеси его не будут полностью удалены из осадка промыванием, то они улетучатся при последующем прокаливании. Например, для осаждения Ba2+ в виде сульфата бария пользуются серной кислотой, а не ее растворимыми солями (К2S04), так как кислота более летуча. По тем же соображениям ион Fe3+ осаждают из раствора действием летучего NH4OH, а не NaOH или KOH. 5. Выбираемый осадитель должен в той или иной мере обладать селективностью по отношению к осаждаемому иону. В противном случае приходится предварительно удалять другие ионы, мешающие определению. Такая селективность особенно характерна для органических реагентов, находящих применение не только в качественном, но и в количественном анализе.
2. 9 При протекании реакций обмена осадок трудно- и среднерастворимых электролитов образуется в том случае, если произведение концентраций (произведение активностей) ионов в растворе превышает величину его произведения растворимости при данной температуре. Однако выпадение осадка может начаться не сразу, а спустя некоторое время, так как при сливании растворов могут образоваться пересыщенные растворы, которые лишь при стоянии или при потирании стенок пробирки стеклянной палочкой выделяют осадок. Также следует знать интервал рН, в котором происходит образование и полное осаждение осадка.
Образование первичного кристалла возможно только при столкновении довольно большого количества реагирующих ионов в определённом соотношении и при определённом расположении в пространстве. Кроме того, в растворах электролиты окружены гидратной оболочкой и довольно прочно связаны с ней. Большинство осадков не содержит воды или содержит её значительно меньше, чем было связано с ионами в растворе. Очевидно, при образовании осадков одновременно разрушается гидратная оболочка реагирующих ионов. Процесс образования осадка протекает в несколько стадий. Вначале образуются центры кристаллизации, первичные кристаллы. Затем эти первичные кристаллы или их небольшие агрегаты соединяются в значительно более крупные частицы и выпадают в осадок. Эта последняя стадия может проходить разными путями, в зависимости от которых получается тот или иной вид осадка.
Аморфный осадок. Быстрое прибавление осадителя к концентрированному раствору вызывает образование мелких агрегатов, которые соединяются в более крупные объёмистые частицы, слабо связанные между собой. Существенной характеристикой аморфного осадка является большая общая поверхность. В связи с этим на поверхности аморфного осадка происходит адсорбция посторонних веществ. Аморфный осадок образуют многие сульфиды металлов, гидрооксиды металлов, кремниевая кислота и др. Аморфные осадки отделяют сразу после осаждения. Кристаллический осадок. Постепенное медленное прибавление осадителя к разбавленному раствору вызывает образование новых центров кристаллизации. Вещество некоторое время остается в пересыщенном растворе. При постепенном добавлении осадителя происходит рост образовавшихся ранее кристаллических центров. В результате образуется кристаллический осадок, состоящий из крупных кристаллов. Кристаллические осадки требуют времени для созревания от 30 мин до суток в зависимости от природы вещества. С кристаллическими осадками работать удобнее, чем с аморфными. Способы очистки осадков: фильтрование, промывание, высушивание и прокаливание.
2. 10 Титриметрия (титриметрический анализ) – это количественный химический метод анализа, основанный на точном измерении объема стандартного раствора (титранта), вступающего в реакцию с определяемым веществом. Стандартным называется раствор реагента с точно известной концентрацией. Стандартный раствор добавляется из бюретки по каплям к определенному объему анализируемого раствора. Этот процесс называется титрованием.
Состояние системы, когда количество добавляемого титранта эквивалентно количеству определяемого вещества, называется точкой эквивалентности, или теоретической точкой конца титрования. Для фиксирования точки эквивалентности используют различные индикаторы или инструментальные методы. Резкое изменение окраски индикатора соответствует конечной точке титрования, которая, строго говоря, не всегда совпадает с точкой эквивалентности. Титриметрия как метод анализа имеет ряд достоинств. Во-первых, этовысокая скорость и точность анализа, а также применимость для определения различных количеств веществ. Во-вторых, этим методом в одном и том же растворе часто можно определять одновременно несколько веществ. Еще одно достоинство –возможность автоматизировать титрование. В титриметрии применяются реакции, удовлетворяющие следующим требованиям.
1. Реакция должна протекать быстро. 2. Реакция должна быть стехиометрична и протекать строго по уравнению. 3. Она должна протекать количественно, почти до конца, т. е. константа равновесия реакции Кр ³ 108. 4. Основной реакции не должны мешать побочные реакции и посторонние вещества. 5. Должна четко фиксироваться точка эквивалентности с помощью подходящего индикатора.
2. 11 Титриметрические методы классифицируются по типам реакций, лежащих в основе метода, и приемам титрования.
Классификация по типу реакций. Методы, основанные на реакциях соединения ионов. К ним относятся следующие методы.
а) Кислотно-основное титрование (перенос протонов). В основе лежит реакция нейтрализации, т. е. реакция между кислотой и основанием, например: HA +OH– = H2O + A–. б) Осадительное титрование основано на образовании труднорастворимых веществ. в) Комплексометрическое титрование основано на реакциях комплексообразования как с неорганическими, так и с органическими лигандами, например, с комплексонами (комплексонометрия).
Методы, основанные на реакциях окисления-восстановления (перенос электронов) называют редокс-методами (или окислительно-восстановительное титрование). Каждый из окислительно-восстановительных методов получает название по стандартному раствору: перманганатометрия (титрант – раствор KМnO4); бихроматометрия (титрант – раствор K2Cr2O7) и т. д.
Классификация титриметрических методов по приемам титрования
Прямое титрование. Определяемое вещество непосредственно титруют раствором реагента или наоборот.
Обратное титрование. К анализируемому раствору приливают избыток раствора реагента, избыток его оттитровывают стандартным раствором. Способ замещения. Используют в случаях определения неустойчивых веществ или невозможности зафиксировать точку эквивалентности при прямом титровании. В этом случае к определенному объему А добавляют избыток вспомогательного реагента, стехиометрически взаимодействующего с веществом А, а получающийся в эквивалентном количестве продукт реакции оттитровывают рабочим раствором В. Используя различные способы титрования, можно значительно расширить область применения титриметрии.
2. 12 Прямое титрование – это такое титрование, когда определяемое вещество непосредственно титруется стандартным раствором титранта или наоборот. Расчет результатов прямого титрования проводится следующим образом. n(X) = n(T), или с(X)*V(X) = c(T)*V(T); m(X) = c(X)*M(X)*Vk = T(X)*Vk/1000, где n(Х), n(Т) – количество титруемого вещества и тиранта, с(X), с(Т) – нормальная концентрация титруемого вещества и титранта, V(X), V(T) – объемы соответственно титруемого вещества и титранта, М(Х) – молярная масса титруемого вещества Х, Vk– объем мерной колбы в литрах,
Т(Х) – титр вещества Х. Косвенное титрование (титрование по замещению)– титрование, при котором определяемое вещество не реагирует с титрантом непосредственно, а определяется косвенно в результате использования стехиометрически протекающей реакции с образованием другого вещества, реагирующего с титрантом.
К анализируемому раствору, содержащему определенный компонент Х, прибавляют реагент А в избытке (для обеспечения полноты протекания реакции) по сравнению со стехиометрическим количеством. При этом образуется вещество В – заместитель в количестве, эквивалентном прореагировавшему компоненту Х:
Х + А = В (избыток заместителя) Образовавшийся заместитель В оттитровывают стандартным раствором титранта Т:
В + Т = D. По результатам титрования рассчитывают молярную концентрацию эквивалента с(Х), титр Т(Х) и массу m(Х) определяемого компонента Х в анализируемом растворе, исходя из закона эквивалентов: n(X) = n(B) = n(T),
c(X)*V(X) = c(T)*V(T), c(X) = c(T)*V(T) / V(X), T(X) = c(X)*M(X) / 1000, m(X) =c(X)*M(X)*Vк, где n(Х), n(Т), n(B) – количество титруемого вещества, тиранта и заместителя, с(X), с(Т) – нормальная концентрация титруемого вещества и титранта, V(X), V(T) – объемы соответственно титруемого вещества и титранта, М(Х) – молярная масса титруемого вещества Х, Vk– объем мерной колбы в литрах,
Т(Х) – титр вещества Х, m(X) – масса титруемого вещества Х.
Таким образом, расчеты результатов анализа в методе косвенного титрования аналогичны таковым при прямом титровании.
2. 13 С пособы выражения концентрации растворов. 1. Массовая доля (или процентная концентрация вещества) – это отношение массы растворенного вещества m к общей массе раствора. Для бинарного раствора, состоящего из растворённого вещества и растворителя:
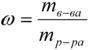 , где: ω – массовая доля растворенного вещества;
, где: ω – массовая доля растворенного вещества;
mв-ва – масса растворённого вещества;
mр-ра – масса растворителя. Массовую долю выражают в долях от единицы или в процентах. 2. Молярная концентрация или молярность – это количество молей растворённого вещества в одном литре раствора V:
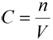 , где C – молярная концентрация растворённого вещества, моль/л (возможно также обозначение М, например, 0, 2 М HCl);
, где C – молярная концентрация растворённого вещества, моль/л (возможно также обозначение М, например, 0, 2 М HCl);
n – количество растворенного вещества, моль; V – объём раствора, л. Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0, 1 моля вещества, сантимолярным – растворено 0, 01 моля вещества, миллимолярным – растворено 0, 001 моля вещества. 3. Моляльная концентрация (моляльность) раствора С(x) показывает количество молей n растворенного вещества в 1 кг растворителя m:
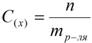 , где: С (x) – моляльность, моль/кг; n – количество растворенного вещества, моль; mр-ля – масса растворителя, кг. 4. Титр – содержание вещества в граммах в 1 мл раствора:
, где: С (x) – моляльность, моль/кг; n – количество растворенного вещества, моль; mр-ля – масса растворителя, кг. 4. Титр – содержание вещества в граммах в 1 мл раствора:
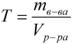 , где: T – титр растворённого вещества, г/мл;
, где: T – титр растворённого вещества, г/мл;
mв-ва – масса растворенного вещества, г; Vр-ра – объём раствора, мл. 5. Мольная доля растворённого вещества – безразмерная величина, равная отношению количества растворенного веществаn к общему количеству веществ в растворе:
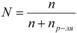 , где: N – мольная доля растворённого вещества;
, где: N – мольная доля растворённого вещества;
n – количество растворённого вещества, моль; nр-ля – количество вещества растворителя, моль. Сумма мольных долей должна равняться 1: N(X) + N(S) = 1, где N(X) - мольная доля растворенного вещества Х; N(S) - мольная доля растворенного вещества S.
Поправочный коэффициент F - величина, показывающая, во сколько раз практические концентрации титранта отличаются от соответствующих теоретических значений, заданных в методике:

2. 14 В титриметричном анализе используют растворы реагентов с точно известной концентрацией. Такие растворы имеют название стандартных растворов. Различают первичные и вторичные стандартные растворы. Первичные стандартные растворы готовят из фиксаналу или по точной навеской. Фиксаналы (стандарт-титры) - это приготовлены и запаяны в стеклянные ампулы точно взвешенные массы твердых или точно отмеренные объемы жидких веществ, необходимые для приготовления исключительно 1 л раствора определенной концентрации (например, 0, 1 н. ). Чтобы приготовить раствор из фиксаналу, ампулу тщательно моют и вытирают. В мерную колбу на 1 л вставляют лейку с вложенным в нее бойко таким образом, чтобы длинный конец его вошел в трубку воронки, а краткий (острый) был направлен вверх. Дно вымытой ампулы пробивают острым концом драка в воронке. Вторым бойко пробивают верхнее дно ампулы и сильной струей воды вымывают содержимое ампулы в колбу. Затем полученный раствор тщательно перемешивают и доводят его дистиллированной водой до отметки 1 л.
Приготовление стандартных растворов по точной навеской сводится к взвешивания на аналитических весах точной навески необходимого вещества с последующим ее растворением в колбе определенного объема. Не все вещества могут использоваться для приготовления первичных стандартных растворов, а только такие, которые отвечают определенным условиям. Требования к веществам для первичных стандартных растворов 1. Вещества, из которых готовят первичные стандартные растворы, должны иметь состав, который точно соответствует химической формуле. 2. Вещества должны иметь высокую степень очистки (ч. д. а. - чистый для анализа). 3. Вещества должны быть устойчивы при хранении (не разлагаться, не испаряться, не поглощать влагу и газы и т. д. ). 4. Желательно, чтобы вещества имели достаточно высокую эквивалентную массу для предотвращения значительной погрешности при взвешивании.
Вторичные стандартные растворы готовят из веществ, которые не соответствуют вышеперечисленным требованиям (например, летучие, гигроскопичны, поглощают газы и т. д. ). При приготовлении таких растворов нет нужды брать точную навеску вещества, потому что, при всей тщательности, не можно получить раствор с точной концентрацией. Итак навеску необходимого вещества взвешивают быстро и примерно на технохимических весах, растворяют ее и раствор разбавляют до определенного объема дистиллированной водой. Точную концентрацию вторичного стандартного раствора устанавливают титрованием этого раствора первичным стандартным раствором (или наоборот) до изменения окраски соответствующего индикатора. Процесс определения точной концентрации вторичного стандартного раствора по первичным стандартным раствором называется стандартизацией раствора.
2. 15 Метод нейтрализации — титриметрический метод определения концентрации кислот ( ацидиметрия ) и щелочей (алкалиметрия ) в растворах. В основе метода нейтрализации лежит использование реакции нейтрализации, т. е. соединения водородных и гидроксильных ионов с образованием малодиссоциирующего вещества - воды. Соответственно кислоты определяют щелочами, щелочи – кислотами. Титрант - активный реагент, используемый для титрования. Его используют для приготовления стандартного раствора(раствор, концентрация активного вещества в котором известна с высокой точностью). Стандартные растворы бывают первичными и вторичными. Первичные готовят путем растворения точной навески вещества в определенном объеме растворителя. Вторичные готовят вначале с приблизительной концентрацией растворенного вещества, близкой к требуемой, а затем определяют его точную концентрацию. Стандартное вещество - реагент, используемый для стандартизации раствора титранта. Бывают первичные и вторичные. Первичные- вещества высокой степени очистки, используемые для стандартизации титранта, либо для приготовления стандартного раствора, который в дальнейшем будет выступать в роли самостоятельного титранта. Вторичные- растворы веществ, способные реагировать с титрантом, концентрация растворенного вещества в которых установлена с помощью первичного стандартного вещества. В качестве первичных стандартных веществ используют соединения, обладающие следующими свойствами: • состав строго соответствует химической формуле; • выпускаются промышленностью в чистом виде (квалификация не ниже «ч. д. а. ») либо легко подвергаются очистке; • устойчивы при обычных условиях; • нелетучи и, по возможности, не содержат кристаллизационной воды (можно использовать и кристаллогидраты, если они устойчивы). • имеют большую молярную массу (меньше погрешность при измерении массы). Чтобы найти эквивалентную массу простого вещества, воспользуйтесь формулой: Mэкв = Mа/B, где Mэкв – масса эквивалента; Mа – атомная масса элемента; B – валентность
2. 16 Для фиксирования точки эквивалентности в раствор + специальное вещество индикатор. К индикаторам основно-кислотного титрования предъявляют следующие требования: 1. окраска индикатора должна быть интенсивной. 2. окраска индикатора при близких значениях рН должна сильно различаться. 3. изменение окраски должно происходить в узком интервале рН.
4. изменение окраски должно быть обратимым. Изменение окраски индикатора происходит не при всяком изменении рН, а лишь внутри определенного интервала значений рН, которое называется интервалом перехода индикатора. Середина этого интервала, при котором заканчивается титрование с данным индикатором называется его показателем титрования. Фенолфталеин 9, 0 рТ Лакмус 7, 0 рТ Метиловый красн. 5, 5 рТ Метиловый оранж. 4, 0 рТ. Ионная теория предложена В. Оствальдом в 1894 г. и основана на теории электролитической диссоциации С. Арениуса. Кислотно-основные индикаторы рассматриваются как слабые органические кислоты, основания и амфотерные соединения, подвергающиеся ионизации в водных растворах, причем нейтральная и ионизированная формы индикатора обладают различной окраской. Индикаторы-кислоты диссоциируют по уравнению:
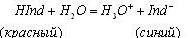 В кислой среде (рН < 7), равновесие в уравнении смещается влево, в сторону кислой формы индикатора НInd, окраска раствора красная. В щелочной среде (рН > 7), равновесие смещается вправо, в сторону основной формы индикатора Ind–, окраска раствора синяя. В нейтральной среде (рН = 7) число молекул НInd и ионов Ind–одинаково, смесь красной и синей окраски даст фиолетовый оттенок раствора. Хромофорная теория. Наличие окраски индикаторов, обусловлено присутствием в молекулах органических веществ хромофорных групп и ауксохромных групп.
В кислой среде (рН < 7), равновесие в уравнении смещается влево, в сторону кислой формы индикатора НInd, окраска раствора красная. В щелочной среде (рН > 7), равновесие смещается вправо, в сторону основной формы индикатора Ind–, окраска раствора синяя. В нейтральной среде (рН = 7) число молекул НInd и ионов Ind–одинаково, смесь красной и синей окраски даст фиолетовый оттенок раствора. Хромофорная теория. Наличие окраски индикаторов, обусловлено присутствием в молекулах органических веществ хромофорных групп и ауксохромных групп.
Хромофорные группы (хромофоры) содержат кратные связи и обеспечивают поглощение видимого света из-за сравнительно легкого возбуждения электронов π -связи. Ауксохромные группы сами по себе не придают окраску молекуле органического соединения, но влияют на свойства хромофоров (усиливают или ослабляют интенсивность окраски). Ауксохромные группы влияют на распределение электронной плотности в молекуле, что приводит к изменению оттенка или интенсивность окраски. Индикаторы в растворе могут присутствовать в виде разных таутомерных форм, находящихся в равновесии.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|