
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ПРОГРАММНЫЕ ВОПРОСЫ ПО ДИСЦИПЛИНЕ «ХИМИЯ» 2 страница
1. 7 Химические реакции протекают с различными скоростями. Некоторые из них полностью заканчиваются за малые доли секунды (взрыв), другие осуществляются за минуты, часы, дни и большие промежутки времени. Кроме того, одна и та же реакция может в одних условиях (например, при повышенных температурах) протекать быстро, а в других (например, при охлаждении) – медленно. При этом различие в скорости одной и той же реакции может быть очень большим. Раздел химии, изучающию скорости химических реакций, называется химической кинетикой. При рассмотрении вопроса о скорости реакций необходимо различать гомогенные и гетерогенные реакции. С этими понятиями тесно связано понятие фазы. Фазой называется часть системы, отделенная от других ее частей поверхностью раздела, при переходе через которую свойства изменяются скачком. Гомогенная реакция протекает в объеме фазы [пример – взаимодействие водорода и кислорода с образованием водяного пара: H2(г) + O2(г) → H2O(г)], а если реакция гетерогенна, то она протекает на поверхности раздела фаз [например, горение углерода: C(т) + O2(г) → CO2(г)]. Скоростью гомогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема фазы:
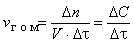 ,
,
где n – количество вещества, моль; V – объем фазы, л; τ – время; С – концентрация, моль/л. Скоростью гетерогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности фазы:
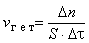 ,
,
где S – площадь поверхности раздела фаз. К важнейшим факторам, влияющим на скорость гомогенной реакции, являются следующие: природа реагирующих веществ, их концентрации, температура, присутствие катализаторов. Зависимость скорости реакции от концентраций реагирующих веществ. Реакция между молекулами происходит при их столкновении. Поэтому скорость реакции пропорциональна числу соударений которые претерпевают молекулы реагирующих веществ. Число соударений тем больше, чем выше концентрация каждого из исходных веществ. Например, скорость реакции A + B → C пропорциональна произведению концентраций А и В: v = k·[A]·[B], где k – коэффициент пропорциональности, называемый константой скорости реакции. По смыслу величина k равна скорости реакции для случая, когда концентрации реагирующих веществ равны 1 моль/л. Это соотношение выражает закон действия масс : при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
Гораздо реже реакция осуществляется в результате одновременного столкновения трех реагирующих частиц. Например, реакция 2А+В → А2В может протекать путем тройного столкновения:
А+А+В → А2В. Тогда в соответствии с законом действия масс концентрация каждого из реагирующих веществ входит в выражение скорости реакции в степени, равной коэффициенту в уравнении реакции: v = k·[A]·[A]·[B] = k·[A]2[B] Сумма показателей степенивуравнении закона действия масс называется порядком реакции. Например, в последнем случае реакция имеет третий порядок (второй - по веществу A и первый - по веществу B. Зависимость скорости реакции от температуры. Если воспользоваться результатами подсчета числа столкновений между молекулами, то количество столкновений окажется настолько большим, что все реакции должны будут протекать мгновенно. Это противоречие можно объяснить тем, что в реакцию вступают лишь молекулы, обладающие некоторой энергией. Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества, называется энергией активации. С ростом температуры количество активным молекул возрастает. Следовательно, скорость химической реакции должна увеличиваться с ростом температуры. Возрастание скорости реакции при нагревании принято характеризовать температурным коэффициентом скорости реакции (γ ) – числом, показывающим, во сколько раз возрастает скорость данной реакции при повышении температуры на 10 градусов. Математически эта зависимость выражается правилом Вант-Гоффа:
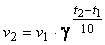 ,
,
где v1 – скорость при температуре t1; v2 – скорость при температуре t2. Для большинства реакций температурный коэффициент γ лежит в пределах от 2 до 4. Более строго зависимость скорости реакции (а точнее, константы скорости) от температуры выражается уравением Аррениуса:
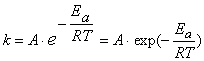 ,
,
где A – предэкспоненциальный множитель, зависящий только от природы реагирующих веществ; Ea – энергия активации, представляющая собой высоту энергетического барьера, разделяющего исходные вещества и продукты реакции (см. рисунок 2. 1); R- универсальная газовая постоянная; T- абсолютная температура. Снижение энергии активации по каким-либо причинам, согласно уравнению Аррениуса, приводит к увеличению скорости реакции. Влияние катализаторов на скорость реакции. Катализатор – это вещество, не расходующееся в процессе протекания реакции, но влияющее на ее скорость. Явление изменения скорости реакции под действием таких веществ называется катализом. Обычно катализаторами называют вещества, увеличивающие скорость реакции, а ингибитором – вещества, замедляющие протекание реакции. В большинстве случаев действие катализатора объясняется тем, что он снижает энергию активации реакции. В присутствии катализатора реакция проходит через другие промежуточные стадии, чем без него, причем эти стадии протекают с меньшими энергиями активации. Иначе говоря, в присутствии катализатора возникают другие переходные состояния, чем без него, и для их образования требуется меньше энергии, чем для образования переходных состояний, возникающих без катализатора. В результате скорость реакции возрастает. Химическое равновесие Химическое равновесие — состояние химической системы, в которой протекает одна или несколько химических реакций, причём скорости в каждой паре прямой-обратной реакции равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем. Принцип работы: если на систему воздействовать, то она противодействует. Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняется закономерности, которая была высказана в общем виде в 1885 году французским учёным ЛеШателье – если изменить одно из условий, при которых система находится в состоянии химического равновесия, то в системе протекают процессы, ослабляющие произведенное изменение. Факторы, влияющие на химическое равновесие: 1) температура. При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении — в сторону экзотермической (выделение) реакции. 2) давление. При повышении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении — в сторону большего объёма. Этот принцип действует только на газы, т. е. если в реакции участвуют твёрдые вещества, то они в расчёт не берутся. 3) концентрация исходных веществ и продуктов реакции. При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при понижении концентрации — в сторону исходных веществ. Катализаторы не влияют на смещение химического равновесия.
1. 8 Растворы– это гомогенные системы переменного состава, включающие два и более компонентов. Частицы компонентов раствора распределены по его объему в виде атомов, молекул или ионов (размер частиц 0, 1 – 0, 5 нм). Образование растворов, в отличие от механических смесей, сопровождается изменением энтальпии, энтропии и объема системы. По агрегатному состоянию различают газовые, жидкие и твердые растворы. Но обычно термин растворы относится к жидким системам. Способы выражения концентрации растворов. Относительное содержание компонентов в растворе определяется его концентрацией.
Молярная концентрация– это количество вещества, содержащееся в одном литре раствора (моль/л): Эквивалентная концентрация– это число молей эквивалентов вещества, содержащихся в одном литре раствора (моль/л): Эквивалент– это реальная или условная частица вещества, которая в кислотно-основной реакции эквивалентна одному иону водорода, а в окислительно-восстановительной эквивалентна одному электрону. Масса одного моля эквивалентов называется молярной массой эквивалента вещества (Э). В разных реакциях одно и то же вещество может иметь разные эквиваленты.
Моляльная концентрация– это количество вещества, содержащееся в одном килограмме растворителя (моль/кг). Массовая доля равна отношению массы растворенного вещества к массе раствора.
Молярная доля равна отношению количества растворенного вещества в общему количеству веществ в растворе. Как правило, вещество обладает определенной растворимостью в данном растворителе. Под растворимостью понимают концентрацию вещества в насыщенном растворе. При пересчете процентной концентрации в молярную и наоборот, необходимо помнить, что процентная концентрация рассчитывается на определенную массу раствора, а молярная и нормальная - на объем, поэтому для пересчета необходимо знать плотность раствора. Если мы обозначим: с - процентная концентрация; M - молярная концентрация; N - нормальная концентрация; э - эквивалентная масса, r - плотность раствора; m - мольная масса, то формулы для пересчета из процентной концентрации будут следующими: M = (c · r · 10) / m N = (c · r · 10) / э
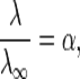
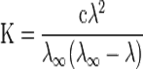
1. 9 Электролиты– это вещества, растворы которых проводят электрический ток посредством ионов, на которые они распадаются под действием полярных молекул растворителя. По типу диссоциации электролиты разделяют на кислоты, основания, амфотерные гидроксиды и соли. Количественной характеристикой диссоциации электролита является степень диссоциации a, которая равна отношению числа продиссоциировавших молекул к общему числу молекул:

По степени диссоциации различают сильные электролиты (a> 30%), слабые электролиты (a< 3%) и электролиты средней силы (3% < a< 30%). Степень диссоциации не является строгой характеристикой электролита, так как зависит не только от его природы, но и от концентрации, и увеличивается при разбавлении раствора. Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:
, где К — константа диссоциацииэлектролита, с — концентрация, λ и λ ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием закона действующих масс и равенства
где α — степень диссоциации.
Диссоциация оснований. Согласно теории электролитической диссоциации, основания – это электролиты, которые при диссоциации образуют только один вид анионов – гидроксид-ионы OH-:
NaOH®Na+ + OH-; Ca(OH)2 ®CaOH+ + OH-;
Диссоциация кислот. Кислоты – это электролиты, которые при диссоциации образуют только один вид катионов – катионы водородаH+.
HCl® H+ + Cl-; HNO3 ® H+ + NO3-; H2SO4 ® H+ + HSO4-;
H3PO4 ® H+ + H2PO4-; HPO42- ® H+ + PO43-.
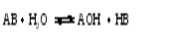 Диссоциация амфотерных гидроксидов. Амфотерные гидроксиды диссоциируют в водном растворе как по типу кислоты, так и по типу основания. При их диссоциации одновременно образуются катионы H+и гидроксид-анионы OH-: H+ + MeO- ⇄ MeOH⇄ Me+ + OH-. К ним относятся гидроксиды цинка Zn(OH)2, алюминияAl (OH)3, хромаCr (OH)3, свинцаPb (OH)2 и др. Например, диссоциация Zn(OH)2:
Диссоциация амфотерных гидроксидов. Амфотерные гидроксиды диссоциируют в водном растворе как по типу кислоты, так и по типу основания. При их диссоциации одновременно образуются катионы H+и гидроксид-анионы OH-: H+ + MeO- ⇄ MeOH⇄ Me+ + OH-. К ним относятся гидроксиды цинка Zn(OH)2, алюминияAl (OH)3, хромаCr (OH)3, свинцаPb (OH)2 и др. Например, диссоциация Zn(OH)2:
2H++ZnO22-⇄ H2ZnO2⇄ Zn(OH)2⇄ Zn2++2OH-.
Диссоциация солей 1. Средние соли – это электролиты, при диссоциации которых в водных растворах образуются катионы металла и анионы кислотного остатка. Напри-мер, Na2SO4 ® 2 Na+ + SO42-;
Ca3(PO)4 ® 3 Ca2+ + 2 PO43-. Кислые соли при растворении в воде образуют катион металла и сложный анион из атомов водорода и кислотного остатка: KHSO3 ® K+ + HSO3- (a = 1). Сложный анион диссоциирует частично: HSO3- ⇄ H+ + SO32- (a< < 1). Основные соли при диссоциации образуют анионы кислотного остатка и сложные катионы, состоящие из атомов металла и гидроксо-групп OH-:
Al(OH)2Cl®Al(OH)2+ + Cl- (a = 1). Сложный катион диссоциирует частично: Al(OH)2+ ⇄ AlOH2+ + OH- (a< < 1); AlOH2+ ⇄ Al3+ + OH- (a< < 1). В результате диссоциации водный раствор двойной соли содержит два катиона и анион кислотного остатка: KAl(SO4)2 ® K+ + Al3+ + 2 SO42-; Na2NH4PO4 ® 2 Na+ + NH4+ + PO43-. Сложные соли диссоциируют на катион металла и анионы кислотных остатков.
Например: ZnClNO3 ®Zn2+ + Cl- + NO3-; AlSO4Cl®Al3+ + SO42- + Cl-. Водородный показатель (рН) величина, характеризующая активность или концентрацию ионов водорода в растворах. Водородный показатель обозначается рН. Водородный показатель численно равен отрицательному десятичному логарифму активности или концентрации ионов водорода, выраженной в молях на литр:
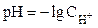 В воде концентрация ионов водорода определяется электролитической диссоциацией воды по уравнению:
В воде концентрация ионов водорода определяется электролитической диссоциацией воды по уравнению:
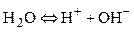 Для воды и ее растворов произведение концентраций ионов Н+ и ОН- величина постоянная при данной температуре. Она называется ионным произведением воды
Для воды и ее растворов произведение концентраций ионов Н+ и ОН- величина постоянная при данной температуре. Она называется ионным произведением воды 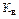 и при 25° С составляет
и при 25° С составляет 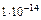 . В общем случае гидролизом называется разложение какого-либо вещества под действием воды. Рассмотрим частный случай гидролиза – гидролиз солей. Так, если гидролизуется соль, состоящая из катиона А и аниона В (для простоты примем их однозарядными), то имеет место обратимая реакция:
. В общем случае гидролизом называется разложение какого-либо вещества под действием воды. Рассмотрим частный случай гидролиза – гидролиз солей. Так, если гидролизуется соль, состоящая из катиона А и аниона В (для простоты примем их однозарядными), то имеет место обратимая реакция:

В результате гидролиза солей образуется либо кислота (кислая соль) и основание, либо основание (основная соль) и кислота. Следовательно, процесс гидролиза соли можно рассматривать как процесс, обратный реакции нейтрализации. Так как реакции нейтрализации обычно идут практически до конца (практически необратимо), то равновесие реакции гидролиза смещено в сторону реагирующих веществ. Концентрация продуктов гидролиза соли, как правило, мала. Гидролизу могут подвергаться только те соли, ионы которых способны связывать Н+ или ОН--ионы воды в малодиссоциированные соединения, т. е. соли, образованные слабыми кислотами и (или) слабыми основаниями. Соли, образованные сильными кислотами и сильными основаниями, гидролизу не подвергаются. Количественно процесс гидролиза можно характеризовать степенью гидролиза и константой гидролиза. Степень гидролиза соли (h) – отношение количества соли, подвергшейся гидролизу, к общему количеству соли в растворе. Степень гидролиза может быть выражена в долях от единицы или в процентах
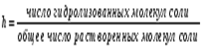
Константа гидролиза соли ( Кh ) – это константа равновесия процесса гидролиза соли. Константа гидролиза – это величина постоянная для данной соли при данной температуре.
1. 10 Комплексными называются определенные молекулярные соединения, при сочетании компонентов которых образуются положительно или отрицательно заряженные ионы, способные к существованию, как в кристалле, так и в растворе. Комплексные соединения – это самый обширный класс неорганических соединений, имеющих огромное биологическое значение: хлорофиллы в растениях, гемоглобин у животных, различные цитохромы, витамины. Основные положения координационной теории (1893г. Альфред Вернер). 1. В комплексном соединении один из ионов или атомов считается центральным, его называют комплексообразователем.
2. Вокруг центрального иона (атома) – комплексообразователя расположено (координировано) определенное число противоположно заряженных ионов или полярных молекул, называемых лигандами.
3. Центральный ион (атом) с лигандами образует внутреннюю координационную сферу соединения, которую при написании заключают в квадратные скобки. 4. В большинстве случаев число лигандов, непосредственно связанных с центральным ионом (атомом), называется координационным числом, которое чаще всего принимает значения 2, 4, 6, 8. 5. Ионы, которые располагаются на более далеком расстоянии от центрального иона (атома), образуют внешнюю координационную сферу. Номенклатура комплексных соединений. 1)Комплексные соли называются также как обычные - анион, потом катион [Cr(NH3)6](NO3)3 - нитрат гексамминхрома(III) 2) Лиганды называются следующим образом: нейтральные - как молекулы, кроме H2O - аква, NH3 - аммин; анионы - суффикс “o” - хлоро, нитро; сульфито; сульфато катионы - суффикс “иум” - гидразиниум. 3) Порядок лигандов: сначала анионы, потом нейтральные молекулы, и наконец, катионы. Внутри каждой группы в порядке увеличения сложности. [Pt(NH3)4(NO2)Cl]SO4 - сульфат хлоронитротетрамминплатины (IV) (NH4)[Cr(NH3)2(NCS)4] – тетраизотиоцианатодиамминхромат (III) аммония. 4) Числовые приставки - ди-, три-, тетра-, пента-, гекса- … Но если в названии лиганда присутствует уже диилитри-, (этилендиамин), для благозвучия договорились количество лигандов обозначатьбис-, трис-, тетракис-.
K3[Al(C2O4)3] - триоксалатоалюминат(III) калия, но
[Co(en)2Cl]SO4 - сульфатхлоро-бис-этилендиаминкобальта(III) 5) Окончания - анионные комплексы кончаются на -ат, как обычные анионы, катионные - как обычные катионы, нейтральные - как металл.
Сa2[Fe(CN)6] - гексацианоферрат(II) кальция, [Fe(H2O)6]SO4 - сульфат гексаакважелеза(II), [Ni(СО)4] - тетрокарбонилникель(II) 6) Степень окисления металла (высчитывается из общей электронейтральности всей молекулы комплексного соединения) - римские цифры в скобках. Но в комплексах бывают и необычные степени окисления металлов - 0, -1. Они пишутся арабскими цифрами.
Na[Co(CO)4] –тетракарбонилкобальтат (-1) натрия. Классификация комплексных соединений Большое многообразие комплексных соединений и их свойств не позволяет создать единую классификацию. Однако можно группировать вещества по некоторым отдельным признакам.
1) По составу.
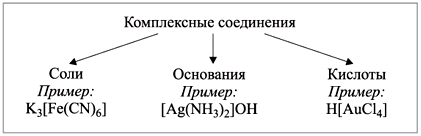
2) По типу координируемых лигандов. а) Аквакомплексы – это комплексные катионы, в которых лигандами являются молекулы H2O. Их образуют катионы металлов со степенью окисления +2 и больше, причем способность к образованию аквакомплексов у металлов одной группы периодической системы уменьшается сверху вниз.
Примеры аквакомплексов: [Al(H2O)6]Cl3, [Cr(H2O)6](NO3)3. б)Гидроксокомплексы – это комплексные анионы, в которых лигандами являются гидроксид-ионы OH–. Комплексообразователями являются металлы, склонные к проявлению амфотерных свойств – Be, Zn, Al, Cr. Например: Na[Al(OH)4], Ba[Zn(OH)4]. в) Аммиакаты – это комплексные катионы, в которых лигандами являются молекулы NH3. Комплексообразователями являются d-элементы. Например: [Cu(NH3)4]SO4, [Ag(NH3)2]Cl. г) Ацидокомплексы – это комплексные анионы, в которых лигандами являются анионы неорганических и органических кислот. Например: K3[Al(C2O4)3], Na2[Zn(CN)4], K4[Fe(CN)6]. 3) По заряду внутренней сферы. В растворах комплексных соединений существует сложная система динамических равновесий, зависящая как от природы комплекса, так и природы растворителя. Водные растворы комплексных соединений являются электролитами. Диссоциацию комплексных соединений следует рассматривать с двух сторон: а) первичная диссоциация. Комплексное соединение под действием растворителя распадается на комплексный ион и ионы внешней сферы. Диссоциация протекает по типу сильных электролитов, например K3[AlF6] ↔ 3K+ + [AlF6]3- б) вторичная диссоциация. Комплексный ион диссоциирует по типу слабых электролитов, то есть в незначительной мере [AlF6]3- ↔ Al3+ + 6F- Применяя закон действующих масс, запишем выражение для константы равновесия, которая для данной системы будет называться константой нестойкости (Кн)комплексного иона Кн =[Al3+]× [F –]6/ [[AlF6]3–]. Константа нестойкости характеризует каждый комплексный ион и является мерой устойчивости комплекса. Чем устойчивее комплексный ион, тем меньше его константа нестойкости. Так, среди однотипных соединений, обладающих различными значениями констант нестойкости [Ag(NO2)2]- Kн =1. 3× 10-3 [Ag(NH3)2]+ Kн =6. 8× 10-8 [Ag(CN)2]- Kн =1× 10-21, наиболее устойчив комплекс [Ag(CN)2]-. В последнее время для характеристики комплексных соединений предпочитают пользоваться величиной, обратной константе нестойкости, называемой константой устойчивости (Ку) Ку = 1/Кн. У ряда соединений, которые рассматриваются как комплексные, константы нестойкости настолько высоки, что концентрации составляющих частиц оказываются больше концентрации комплексного иона. К таким соединениям относятся двойные соли, которые в твердом состоянии имеют координационную структуру, а в растворе в значительной мере распадаются на составные ионы, например K2[CuCl4] ↔ 2K+ + [CuCl4]2- ↔ 2K+ + Cu2+ + 4Cl-.
1. 11 Окислительно-восстановительные процессы принадлежат к числу наиболее распространенных химических реакций и имеют огромное значение в теории и практике. Окисление-восстановление—один из важнейших процессов природы. ТИПЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ 1. Реакции межатомного и межмолекулярного окисления-восстановления -обмен электронами происходит между различными атомами, молекулами или ионами. 2. Реакции диспропорционирования (самоокисления-самовосстановления) харакктерны для соединений или простых веществ, отвечающих одному из промежуточных значений степени окисления данного элемента. 3. Реакции внутримолекулярного окисления-восстановления. В этих реакциях одна составная часть молекулы выполняет функцию окислителя, а другая восстановителя. Простейшими примерами таких реакций могут служить процессы термического разложения сложного вещества на более простые составные части. МЕТОДИКА СОСТАВЛЕНИЯ УРАВНЕНИЙ ОВР Для составления уравнений окислительно-восстановительных реакций следует знать окислительные и восстановительные свойства вступающих и образующихся в результате реакции соединений; они обычно усиливаются экспериментально или на основе известных свойств элементов. Применяются в основном два метода составления уравнений окислительно-восстановительных реакций: 1) электронного баланса – основан на определении общего количества электронов, перемещающихся от восстановителя к окислителю; 2) ионно-электронный – предусматривает раздельное составление уравнений для процесса окисления и восстановления с последующим суммированием их в общее ионное уравнение-метод полуреакции. В этом методе следует найти не только коэффициенты для восстановителя и окислителя, но и для молекул среды. В зависимости от характера среды число электронов, принимаемых окислителем или теряемых восстановителем, может изменяться. В некоторых случаях среда обуславливает даже изменение направления процесса, например: в щелочной среде ( рН > 7 ) HIO3 +5HI = 3I2 + 3H2O в кислой среде (pH< 7). В нейтральной и слабощелочной среде (рН > 7) As2O3 + 2I2 + 2H2O = As2O5 + 4HI. В кислой среде (рН< 7 ).
При рН < 1 пероксид водорода является окислителем по отношению к элементарному иоду: 5Н2О2 + I2 = 2HIO3 + 4H2O;
рН > 2, наоборот, HIO3 окисляет пероксид водорода:
5Н2О2 + 2НIO3 = I2 + 5O2 + 6H2O. Регулируя среду, можно заставить реакцию количественно протекать в желаемом направлении. Это изменение зависит также от концентрации реагирующих веществ. Уравнения реакций окисления-восстановления изображаются тремя последовательными стадиями: 1) начальные продукты; 2) промежуточные продукты и их стяжение; 3) конечные продукты.
2. 1 Аналитическая химия – наука о методах определения состава веществ. Предмет - решение общих проблем теории химического анализа, совершенствование существующих и разработка новых, более быстрых и точных методов анализа (т. е теория и практика хим. анализа). Задача - развитие теории химических и физико-химических методов анализа, процессов и операций в научном исследовании, совершенствование старых методов анализа, разработка экспрессных и дистанционных м. а, разработка методов ультра- и микроанализа.
Аналитическая реакция — хим. реакция, используемая для разделения, обнаружения и количественного определения элементов, ионов, молекул. Она должна сопровождаться аналитическим эффектом (выпадением осадка, выделением газа, изменением окраски, запаха) Реагент — химический термин. То же, что и реактант, т. е. исходное вещество, участвующее в химической реакции. То же, что и химический реактив. При обнаружении какого-либо компонента вещества обычно фиксируют появление аналитического сигнала – образование осадка, изменение окраски, появление линии в спектре и т. д. При этом аналитический сигнал наблюдают, главным образом, визуально. Например, если при добавлении к раствору исследуемой соли раствора гексацианоферрата(ІІ) калия появляется темно-синяя окраска, то это служит аналитическим сигналом на наличие в исследуемом растворе ионов Fe+3. Другой пример: если при внесении кристаллов некоторой соли в пламя оно окрашивается в желтый цвет, то это является аналитическим сигналом на наличие в составе соли ионов Na+. Для правильного использования в аналитике реакций следует учитывать чувствительность реакции. Она определяется наименьшим количеством искомого вещества, которое может быть обнаружено данным реактивом в капле раствора (0, 01-0, 03 мл). Чувствительность выражается рядом величин:
1. Открываемый минимум— наименьшее количество вещества, содержащееся в исследуемом растворе и открываемое данным реактивом при определенных условиях выполнения реакции.
2. Минимальная (предельная) концентрация показывает при какой наименьшей концентрации раствора данная реакция позволяет еще однозначно открывать обнаруживаемое вещество в небольшой порции раствора. 3. Предельное разбавление— максимальное количество разбавителя, при котором еще определяется вещество.
Специфичными реакциями называют реакции, при помощи которых можно в определенных условиях обнаружить одни ионы в присутствии других ионов по специфическому изменению цвета, образованию характерного осадка, выделению газа и т. п.
При качественном анализе в основном имеют дело с избирательным и селективными реакциями. Избирательность определяется характерными особенностями реагента и иона металла, условиями проведения реакции. В аналитической химии приходится иметь дело главным образом с селективными и групповыми реагентами. Селективный реагент взаимодействует с небольшим числом ионов. Групповой реагент применяется для одновременного выделения многих ионов. Селективные аналитические реагенты представляют собой преимущественно сложные органические соединения, способные к образованию характерных внутрикомплексных соединений с ионами металлов. Большое значение в неорганическом анализе имеют такие органические реагенты, как 8-оксихинолин, дифенилтиокарбазон («дитизон»), a-бензоиноксим, 1-нитрозо-2-нафтол, диметилглиоксим, триокси-флуороны, комплексон III (см. Комплексоны), некоторые оксиазосоединения, дитиокарбаминаты, диэтилдитиофосфат, диантипирилметан и др. производные пиразолона. Известно много реагентов для органического функционального анализа. Например, фенилгидразин, 2, 4-динитрофенилгидразин, семикарбазид и тиосемикарбазид применяются для качественного и количественного определения альдегидов и кетонов.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|