
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Классификация СА и основные механизмы их возникновения. Таблица 1
Развитию СА (ПТ, ТиФ) обычно предшествуют различные аритмогенные биохимические изменения в М, к наиболее значимым из которых относятся: 1) ↑ внеклеточной концентрации ионов К+; 2) ↓ pH в КМ с развитием метаболического ацидоза; 3) Накопление в КМ избытка цАМФ; 4) ↑ содержания ВЖК в КМ. К ↑ содержания K+ в интерстициальной жидкости приводят: ♦ Дефицит АТФ и КФ в КМ; ♦ ↓ активности К+-Na+-АТФазы цитолеммы; ♦ Аномалии мембран КМ. К аритмогенным эффектам ↑ содержания K+ в интерстиции , сопровождающихся развитием СА, включая ПТ и фибрилляцию желудочков, относятся: 1. ↓ величины МП; 2. ↓ порога возбудимости КМ; 3. Замедление проведения импульса возбуждения; 4. Укорочение АРП; 5. ↑ периода аритмогенной уязвимости; 6. Возникновение электрического тока (импульса) повреждения в микроучастках М. Развитие ацидоза обусловливают: ♦ Активация анаэробного гликолиза, который приводит к накоплению избытка молочной кислоты в КМ и в интерстиции уже в течение нескольких секунд после ↓ КК; ♦ торможение процессов аэробного тканевого дыхания(наблюдается при КН в связи с дефицитом О2 и субстратов обмена веществ). Аритмогенные эффекты ацидоза сходны с таковыми при ↑ концентрации ионов K+ в интерстиции, только выраженность их меньше. К накоплению в ишемизированных КМ избытка цАМФ приводят: ♦ Активация аденилатциклазы (при острой КН или стрессе значительно ↑ содержание КхА в М, что сопровождается активацией аденилатциклазы и ↑ уровня цАМФ); ♦ Подавление активности фосфодиэстераз, разрушающих цАМФ (при ишемии М, миокардитах, кардиомиопатиях). Аритмогенные эффекты избытка цАМФ реализуются благодаря стимуляции под влиянием цАМФ так называемого медленного входящего Ca2+- го тока. ПД при этом развивается за счёт медленного транспорта Ca2+ через мембрану клеток М и характеризуется малой скоростью нарастания деполяризации, что в свою очередь обусловливает замедление проведения возбуждения по сердцу. Высокая концентрация внутриклеточного цАМФ стимулирует медленный Ca2+-й ток и создаёт тем самым условия для формирования гетеротопных очагов ритмической активности (антагонисты Ca2+ верапамил, нифедипин и др. ↓ частоту СА путем блокады входа Ca2+ в клетку). Основными причинами ↑ ВЖК в КМ являются: ♦ ↑ содержания в МКхА, обладающих выраженной липолитической активностью; ♦ ишемияМ (характеризуется ↑ содержания КхА в М и активацией липолиза); ♦ ↑ захвата ВЖК повреждённымиКМ (обусловлено альтерацией мембран КМ и ↑ их проницаемости, в том числе для ВЖК); ♦ активация гидролиза мембранных фосфолипидов (напр. под действием катехоламинов и Ca2+). К аритмогенным эффектам ВЖК относятся ♦ разобщение ими ОФ (которое приводит к потенцированию дефицита АТФ и выходу ионов K+ в межклеточную жидкость); ♦ подавление ресинтеза АТФ в процессе гликолиза (дефицит АТФ гликолитического генеза, широко используемого катионными насосами при формировании МП, а также при развитии ПД, нарушает мембранный электрогенез, что сопровождается СА).
Согласно современным представлениям, в основе возникновения всех нарушений ритма могут лежать три механизма: I. Нарушения образования импульсов: 1) Нарушения автоматизма клеток, обладающих пейсмекерной активностью (СУ, латентные водители ритма); 2) Возникновение анормального автоматизма в клетках сократительного М или в частично деполяризованных клетках сГП; 3) Триггерная активность в проводящей системе и сократительном М, основанная на ранних и задержанных постдеполяризациях. II. Нарушения проведения импульсов: 1) Блокада проведения; 2) Однонаправленная блокада проведения с механизмом повторного входа импульса (reentry); 3) Отражение импульса (reflection). III. Одновременные нарушения образования и проведения импульсов. Влияние СА на гемодинамику и состояние больного определяется характером аритмии, ЧСС при нарушении ритма, исходным состоянием сократительногоМ. Так, ФиТ желудочков приводят сразу же к остановке кровообращения (внезапная смерть) и требуют неотложных мероприятий. Единичные Э у больного с умеренно измененным сократительным М существенно не сказываются на гемодинамике. Однако иногда даже одиночная Э (ранние экстрасистолы - R на Т) может спровоцировать нарушения ритма, несовместимые с жизнью пациента (ФиТ желудочков). Частые Э у больного с измененным М могут вызвать или усугубить предшествовавшую СН. ПТ суправентрикулярная у больного интактным сократительным М обычно не вызывает СН, но при патологии М возможно развитие острой СН. В плане развития СН более неблагоприятны желудочковые тахикардии, поскольку при них изменения гемодинамики связаны не только с ↑ числа сокращений Ж, но и с асинхронизмом сокращения П и Ж, а также с нарушением свойственной здоровому сердцу последовательности возбуждения сокращения различных отделов миокарда Ж. Кроме того, ПТ желудочковая, в отличие от супраентрикулярных форм, чаще возникает у лиц с резко измененным М. Влияние ФиТ предсердий на гемодинамику зависит от числа сокращений Ж, длительности СА и состояния сократительного М. Число сокращений Ж при данных СА определяется способностью АВс проводить на Ж поступающие к нему мпульсы. Неблагоприятные влияния МА на гемодинамику прямо связаны с отсутствием сокращения П, тахисистолией и неритмичностью сокращения Ж. При анализе нарушений ритма важным является не только выяснение характера СА и возможных механизмов ее возникновения, но и оценка прогностического значения СА в плане ее возможного влияния на гемодинамику, поскольку в этом отношении роль одного и того же нарушения ритма и проводимости далеко не одинакова. Так, полная поперечная блокада сердца с числом окращений Ж 50-60 в мин., как правило, существенно сказывается на прогнозе больных, в то же время редкий ритм Ж при развитии полной АВ-блокады приводит к НК органов и обычно является показанием для неотложного перевода больного на искусственную кардиостимуляцию. При всех формах нарушений ритма варианты, протекающие с резкой тахикардией, являются прогностически особенно неблагоприятными . Обычно скорость присоединения СН в этой ситуации в значительной мере определяется состоянием сократительного М. Однако даже у пациентов с интактным М при условии резкой стойкой ТК возможно развитие тяжелой СН, которая может быть показанием к трансплантации сердца.
VI. СА вследствие нрушения образования импульсов подразделяют на: 1) СА, возникающие при изменении активности клеток, способных к генерации импульсов в физиологических условиях (нормального автоматизма); 2) СА, обусловленные механизмами анормального автоматизма. СА первого типа, связанные с изменениями автоматизма клеток, обладающих пейсмекерной активностью, могут возникать как в СУ ( номотопные СА или автоматические аритмии СУ ), так и в нижерасположенных отделах проводящей системы ( эктопические автоматические СА или гетеротопные ). Автоматизм – это свойство ткани сердца спонтанно генерировать ПД. Он определяется своеобразием формирования МП в клетках-водителях ритма, которое заключается в спонтанном медленном ↓ величины диастолической поляризации - разности потенциалов, возникающей вследствие ↓ выхода из клетки ионов К+ и медленного поступления в неё ионов Na+ во время диастолы, в конце концов резко ↑ проницаемость мембраны для Na+, что вызывает формирование ПД. Изменение нормального автоматизма обусловлено нарушением функций СУ, водителей ритма второго и третьего порядков. ЭФ основой изменений автоматизма СУ является нарушение скорости СДД Р-клеток, что может быть обусловлено изменениями величин максимального диастолического и порогового потенциалов и скорости (наклона) 4-й фазы ПД (деполяризации). Наиболее частыми клиническими проявлениями нарушений ритма этого типа являются ♦ СТ, ♦ СБ, ♦ СинА (дыхательная) и ♦ некоторые вариантысиндрома слабости синусового узла (СССУ). СТ характеризуется ↑ в покое частоты генерации в СУ импульсов возбуждения (как правило, более 100 в минуту) с одинаковыми интервалами между ними. ЭФ механизмее развития - ускорение СДД плазмолеммы клеток СУ. Причины: ♦ активация эффектов симпатической н. с. на М (стресс, ФН, неврозы, гипертермии, лихорадка и др. ); ♦ ↓ влияния на М парасимпатической н. с. (при повреждении регулирующих М структур парасимпатической н. с., ↓ холинореактивных свойств М); ♦ прямое действие повреждающих факторов различной природы на клетки СУ (миокардиты, ИМ, перикардиты, травмы, кардиосклероз). СБ проявляется ↓ в покое частоты генерации СУ импульсов возбуждения ниже N (40–60 в минуту) с одинаковыми интервалами между ними. Ведущий ЭФ механизм ее развития - замедление процесса СДД мембран клеток СУ. Причины: ♦ активация эффектов парасимпатической н. с. на М (при раздражении ядер вагуса вследствие ↑ внутричерепного Р при менингитах, энцефалитах и т. п. или его окончаний, ↑ внутрижелудочкового Р и тонуса М, надавливании на глазные яблоки (рефлекс Ашнера‑ Даньини), а также в зоне проекции бифуркации сонной артерии (рефлекс Геринга) и в области солнечного сплетения); ♦ ↓ симпатикоадреналовых эффектов на М (при невроах, повреждении регулирующих М структур симпатической н. с., ↓ адренореактивных свойств М); ♦ непосредственное воздействие повреждающих факторов на клетки СУ. Указанные факторы могут обусловить не только развитие СБ, но при их значительной силе или длительности и существенное ↓ частоты (менее 50 в мин. ) или прекращение генерации СУ импульсов - соответственно СССУ или «остановку СУ» (синоатриальная блокада стадии III). СинА - нарушение ритма, характеризующееся неравномерными интервалами между отдельными ПД, исходящими из СУ. ЭФ механизм - колебания скорости ( ↑ , ↓ ) медленной СДД пейсмейкерных клеток. Наиболее частые причины: ♦ флуктуация (усиление/ослабление) парасимпатических влияний на М; ♦ нарушение соотношения симпатикоадреналовых и парасимпатических воздействий на М; ♦ колебание содержания в крови О2 и CO2 и/или метаболитов (лактата, пирувата, жёлчных кислот); ♦ применение отдельных ЛС(наперстянки, опиатов, холино‑ и симпатолитиков, холино‑ и симпатомиметиков); ♦ действие физических факторов непосредственно на СУ. СинА наблюдается при различных формах невроза, энцефалитов, стенокардии, отравлений и проявляется сменой периодов нормального ритма периодами тахи‑ и брадикардии или медленным восстановлением синусового ритма после эпизода тахикардии (последнее характерно для СССУ). СССУ или синдром брадикардии–тахикардии - неспособность СУ обеспечивать ритм сердца, адекватный уровню жизнедеятельности организма. Основной ЭФ механизм: нарушение (нередко временное прекращение) автоматизма СУ, особенно фаз реполяризации и СДД и возникновение на этом фоне гетеротопных (эктопических) очагов ритмической активности. Причины: ♦ преобладание парасимпатических влияний на М (психастения, истерия, невроз навязчивых состояний, передозировка антагонистов Сa2+, ряда противоаритмических средств); ♦ нарушение адрено‑ и холинореактивных свойств клеток СУ (чаще ↓ их адрено‑ и/или ↑ холинореактивности); ♦ прямое повреждение СУ. СССУ проявляется периодической или постоянной СБ, сменяющейся СТ, ФиТ предсердий; ♦ медленным восстановлением синусового ритма после прекращения СТ, эпизодами остановки СУ. Для СССУ характерные: ♦ при СТ и в аналогичном периоде СинА наблюдается ↑ СВ (за счёт ↑ ЧСС) и незначительный ↑ систолического АД; ♦ приСБ и в аналогичном периоде СинА возможно ↓ СВ; при этом ударный выброс несколько ↑ в связи с удлинением диастолы и возрастанием кровенаполнения камер сердца; ♦ ↓ АД и потеря сознания в связи с ишемией мозга при ЧСС 35 и ниже. При синдроме остановки СУ (прекращении генерации импульсов СУ более чем на 10-20 с) на фоне ишемии мозга развивается синдром Морганьи‑ Адамса‑ Стокса, заключающийся в потере сознания и развитии судорог. Выраженная СБ может значительно ↓ СВ, что нередко приводит к ↓ перфузионного Р в КА с развитием КН. Длительная и выраженная СТ, особенно при наличии коронаросклероза, также может привести кКН вследствие ↑ потребностей М.
Возникновение патологического автоматизма (эктопическая активность) может наблюдаться в ткани П, Ж, пГ, вП при частичной деполяризации КМ. Эктопические автоматические ритмы могут возникать ♦ при подавлении пейсмекерной активности СУ или же ♦ при усилении ее в нижерасположенных клетках проводящей системы сердца, активность которых в физиологических условиях подавлена импульсами, поступающими из СУ, и ♦ электротоническим взаимодействием с клетками сократительного М. Еще одно условие, при котором может проявляться автоматизм латентных Пкр - это замедление или невозможность проведения синусового импульса в той или иной группе клеток. Возникающие при этих условиях нарушения ритма принято называть замещающими или выскальзывающими. Это эктопические ритмы. Они возникают вне СУ и обусловлены преобладанием автоматизма нижележащих центров ритмогенеза. ↓ активности или прекращение деятельности СУ в результате его функционального или органического повреждения создаёт условия для включения автоматических центров второго и третьего порядков. Эктопический (по отношению к СУ) очаг с его более редким ритмом принимает на себя функцию Пкр. В связи с этим нарушения ритма такого типа и носят название гетеротопных, пассивных или замещающих (синусовый ритм) аритмий. Проявляются гетеротопные СА: ♦ миграцией наджелудочкового водителя ритма; ♦ предсердным медленным ритмом; ♦ АВ (узловым) ритмом; ♦ идиовентрикулярным редким (желудочковый) ритмом (водитель ритма расположен в М желудочков); ♦ идиовентрикулярным ускоренным ритмом сердца, когда ЧСС равна 60-120 в 1 мин (возникает при патологической циркуляции возбуждения по М желудочков), ♦ АВ диссоциацией: полным прекращением проведения возбуждения от П к Ж, когда П и Ж сокращаются независимо друг от друга (полный поперечный блок), ♦ «выскакивающими» импульсами. Предсердный медленный ритм наблюдается, когда эктопический водитель ритма находится в левом П. На ЭКГ выявляются редкие (менее 70–80 в мин. ) импульсы возбуждения. Наблюдается при неврозах, ревматических или врождённых пороках сердца и кардиомиопатиях. Атриовентрикулярный ритм (узловой) наблюдается в случаях, когда импульсы в СУ или вообще не возникают или генерируются с меньшей частотой, чем в клетках АВ-узла. Источником ПД может быть верхняя, средняя или нижняя часть АВ-узла. Чем выше локализация Пкр, тем более выражено его влияние и тем больше частота генерируемых им импульсов. Миграция наджелудочкового водителя ритма характеризуется перемещением Пкр из СУ в нижележащие отделы (преимущественно в АВ-узел) и обратно. Это, как правило, происходит при подавлении автоматизма СУ в результате преходящего ↑ влияний вагуса. Ритм сердца при этом зависит от нового источника импульсов и потому становится неправильным. Идиовентрикулярный желудочковый ритм развивается как замещающий при подавлении активности центров первого и второго порядка. Импульсы генерируются, обычно, в пГ верхней части межжелудочковой перегородки, в одной из его ножек и их разветвлениях (ритм ножек пГ) и реже в вП. В связи с этим выделяют клинически значимые разновидности идиовентикулярного ритма: •редкий (желудочковый) ритм: гетеротопный ритм сердца, при котором водитель ритма расположен в М желудочков. •ускоренный ритм(ЧСС 60-120 в 1 мин. )возникает при патологической циркуляции возбуждения по М желудочков. Как ускоренный идиовентрикулярный ритм расценивают при наличии трёх и более желудочковых комплексов с частотой 50–100 в минуту. Обычно он возникает при ИМ, протекает бессимптомно и не требует вмешательства. Атриовентрикулярная диссоциация - полное прекращение проведения возбуждения от П к Ж. При этом П и Ж сокращаются независимо друг от друга (полный поперечный блок). Диссоциация с интерференцией заключается в одновременной, но несогласованной работе двух генераторов сердечного ритма: как правило, номотопного (синусового) и гетеротопного (чаще атриовентрикулярного, реже желудочкового). «Выскакивающие» сокращения: регистрация отдельных (замещающих) сокращений сердца под влиянием импульсов, генерируемых центрами автоматизма второго или третьего порядка на фоне временного ↓ автоматической функции СУ (напр., наджелудочковые экстрасистолы).
Значительно более сложным является механизм приобретения способности к генерации импульсов клетками сократительного М - нарушения образования импульсов по механизму анормального автоматизма. Для приобретения клетками сократительного М способности к генерации импульсов необходимо ↓ в них максимального МП до -65-30 mV и более медленный подъем 1-й фазы ПД. Характер биохимических изменений в клетках, приводящий к подобному изменению их ЭФ свойств, до настоящего времени не выяснен. Некоторые исследователи связывают его с замедлением поступления Na+ и Са2+ в КМ, другие - с выходом К+. Одной из особенностей эктопических ритмов, обусловленных анормальным автоматизмом, является их меньшая чувствительность к подавляющему действию синусовых импульсов по сравнению с аритмиями, возникающими в проводящей системе сердца. Третий механизм нарушения образования импульсов связан с приобретением клеткой способности генерировать постпотенциалы (так называемые триггерные ритмы ). В отличие от автоматизма здесь возникновению дополнительного импульса обязательно предшествует обычный ПД (рис. 8).


Триггерная активность. Рис. 9
А - ранние постдеполяризации, Б - поздние постдеполяризации.
При целом ряде ситуаций прекращение возбуждения клетки не приводит к стабильной 4-й фазе (потенциалу покоя), и величина потенциала продолжает колебаться в определенных пределах ( поздние постпотенциалы ). Эти колебания величины потенциала могут наступать также до завершения полной реполяризации ( ранние постпотенциалы ). Ранние постпотенциалы чаще возникают во 2-й фазе потенциала действия (фаза плато), реже - в 3-й фазе (медленная деполяризация) на фоне ↑ интервала Q-T на ЭКГ. Механизмы возникновения постпотенциалов окончательно не выяснены. Постпотенциалы, возникающие в фазе плато, связывают с усилением поступления Са2+в клетку, в третьей фазе - с реактивацией быстрых натриевых каналов, поздние постпотенциалы - с ↑ содержания Са2+в клетке. Во всех случаях придается значение острому ↓ содержания К+ в КМ. При ранней постдеполяризации эктопические импульсы формируются в фазу ранней реполяризации на фоне медленного ритма. Механизм постдеполяризации запускается в результате ↑ продолжительности ПД, напр., при удлинении интервала QT, низком внутриклеточном содержании ионов К+; именно так развивается желудочковая тахикардия типа «пируэт» (torsade de pointes, произносится как «торсад дё пуант») в условиях доминирования парасимпатических влияний на сердце (при неврозах или гипотиреозе). При поздней постдеполяризации эктопические импульсы возникают на фоне ускоренного ритма. Основной причиной их считают перегрузку КМ ионами Са2+ в результате избыточных адренергических влияний на них при гипертрофии М и СН, интоксикации сердечными гликозидами, реперфузии (восстановление нарушенного кровотока в сосудах сердца с помощью тромболитиков). Примерами возникновения СА в результате поздней постдеполяризации являются желудочковые Э и тахикардии при гликозидной интоксикации, желудочковые Э при СН, катехоламинзависимые предсердные и желудочковые тахикардии. Наиболее часто постпотенциалы, как причина СА, отмечаются при ишемии М, терапии сердечными гликозидами и действии на измененный М высоких концентраций КхА. Особенностью триггерных аритмий является их значительная резистентность к антиаритмическим препаратам и сверхчастой стимуляции для купирования.
VII. СА вследствие нрушения проведения импульсов являются следствием нарушения способности КМ проводить импульсы возбуждения. Выделяют следующие разновидности расстройств проводимости: I. По изменению скорости проведения импульса: 1 ) Сопровождающиеся замедлением и/или блокадой проведения импульсов; 2) Сопровождающиеся ускорением проведения импульсов возбуждения. II. По продолжительности нарушения проводимости: 1) Временное; 2) Постоянное. III. По локализации нарушения: 1) Синоатриальное; 2) Интраатриальное; 3) Атриовентрикулярное; 4) Интравентрикулярное.
В основе возникновения СА могут лежать несколько типов нарушения проведения импульсов. Нередко СА возникают вследствие замедления или полной блокады проведения импульса к определенному участку М. Это приводит к замедлению основного ритма вплоть до асистолии и проявлению автоматизма латентных водителей ритма в виде медленных замещающих или выскальзывающих ритмов (брадикардии, брадиаритмии). Вторая причина - проведение синусового импульса не нарушено, но изменены электрофизиологические свойства клеток, к которым он поступает (↓ максимального диастолического потенциала, удлинение рефракторного периода). Возможна и такая ситуация, когда ЭФ свойства клеток, к которым своевременно поступает импульс, не изменены, но сила импульса настолько слаба, что она не в состоянии возбудить клетку. В этих условиях способность распространяющегося импульса стимулировать возбудимые клетки постепенно ↓ по мере его движения, хотя скорость распространения импульса остается нормальной - затухающее (декрементное)проведение. Обычно во всех этих случаях возникают брадиаритмии. Наконец, в основе СА, обусловленных нарушениями проведения, может лежать однонаправленная блокада с повторным входом импульса (reentry). Петля макро-reentry возникает в дополнительных проводящих путях (при синдроме преждевременного возбуждения желудочков) или в АВ-соединении. Для возникновения reentry необходима однонаправленная блокада проведения импульса и анатомический или функциональный барьер для формирования петли reentry. Кроме того, развитие reentry характеризуется замедлением проведения импульса и коротким рефрактерным периодом. СА по типу reentry возникают при наличии в М зоны с ЭФ свойствами, способными поддерживать круговое движение импульса. При этом в сердце сосуществуют два или несколько путей проведения импульсов, различающихся по рефракторному периоду и скорости возбуждения клеток проводящей системы. В этих условиях импульс не затухает, достигнув определенной зоны М, а встречает там участок ткани, способный к возбуждению с проведением импульсав необычном направлении. Для появления этого феномена необходима однонаправленная блокада проведения импульса (импульс распространяется только в одном направлении), импульс должен рециркулировать - возвращаться к месту его начального происхождения, циркуляция импульса осуществляется вокруг определенной области М. Наконец, феномен повторного входа чаще всего возникает при замедлении скорости проведения дополнительного (кругового) импульса, когда он на своем пути не встречает рефракторного участка. Однако медленное проведение не является обязательным условием. Reentry вполне возможен и при нормальной скорости проведения, если путь кругового движения импульса достаточно длинен (рис. 9). Наиболее достоверной и доказаннойпричинойreentry являются аномальные дополнительные проводящие пути, соединяющие предсердия и желудочки. ЭФ особенностью дополнительного проводящего пути является больший, по сравнению с основным проводящим путем, рефрактерный период и более быстрое проведение импульса. Обычно возникающее в предсердии дополнительное возбуждение распространяется на желудочки по АВс (рис. 10) и возвращается в предсердия ретроградно по дополнительному пути (ортодромная тахикардия). Значительно реже так называемые реципрокные тахикардии могут быть обусловлены антеградным проведением по дополнительному и ретроградным - по основному проводящему пути (антидромная тахикардия.
Б В
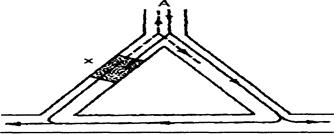
Повторный вход возбуждения (reentry) в периферических вП. Рис. 9
АБ и АВ - периферические разветвления, БВ - миокард Ж, Х - однонаправленная блокада проведения.
|
|
|
|
Ортодромная реципрокная АВ тахикардия с участием дополнительного пути проведения. Рис. 10
На схеме слева: 1 - АВ узел, 2 - дополнительный путь проведения. На ЭКГ справа стрелками указаны отрицательные зубцы Р после желудочковых комплексов.
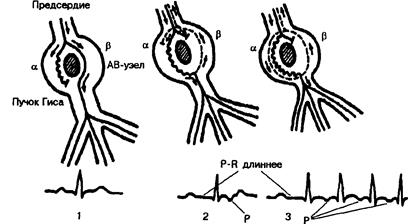
Механизм reentry в АВ узле при его продольной диссоциации на 2 канала проведения. Рис. 11
а - медленный канал, р - быстрый канал, 1 - нормальное проведение по быстрому (р) каналу АВ узла, 2 - проведение по медленному (а) каналу АВ узла; увеличение P-R и ретроградное возбуждение предсердий по механизму повторного входа (отрицательный Р после желудочкового комплекса), 3 - пароксизм реципрокной атриовентрикулярной (узловой) тахикардии.
Нарушения проведения импульса, приводящие к возникновению СА по механизму reentry, могут быть обусловлены не только наличием дополнительных проводящих путей. Аналогичная ситуация возникает при функциональной продольной диссоциации АВ узла на два канала (рис. 11), различающихся по рефракторному периоду и скорости проведения импульса (а- и р-каналы ). Однонаправленная блокада проведения может возникнуть и в других отделах проводящей системы при наличии различий в возбудимости расположенных рядом участков. В этих условиях любые факторы, приводящие к удлинению рефракторного периода в определенной зоне М, могут явиться источником кругового движения. По-видимому, феномен повторного входа возбуждения является одним из наиболее частых механизмов возникновения разнообразных СА. Отражение (reflection) можно отнести к разновидности reentry , поскольку для его возникновения также необходим участок замедленного проведения импульса, а время, в течение которого импульс возвращается к месту своего происхождения, должно превышать рефрактерный период проксимальных участков его распространения. Особенностью отражения является то, что импульс распространяется не по кругу, а по одному и тому же пути в обоих направлениях. При начальном движении в одном направлении он встречает на своем пути зону с резко замедленным проведением. К моменту появления возбуждения в этом участке восстанавливается возбудимость дистального участка пути, позволяющая импульсу совершить обратное движение. При однократном движении импульса возникает одиночное дополнительное сокращение сердца - Э. Если же зоны замедленной возбудимости имеются в обоих концах этого участка, то возможно повторное многократное " отражение" импульса от этих участков, что приведет к возникновению ПТ. Возможны и другие электрофизиологические нарушения, приводящие к СА. Например, различия к рефрактерности разных отделов проводящей системы создают условия для феномена сверхнормальной проводимости или феномена " щели" (дар) в проведении. Предпосылками для одного из вариантов супернормального проведения является более длинный ЭРП в сГП, чем ФРП в АВ узле. При этом возможно, что более ранний предсердный экстрастимул (экстрасистола) задерживается в период относительной рефрактерности АВ узла, но далее может быть проведено п о сГП, так как в ней успевает восстановиться проводимость. Более поздний импульс через АВс проводится быстрее, но может быть блокирован ниже. О сверхнормальной возбудимости говорилось раньше. Напомню, что попадание даже подпорогового импульса в фазу супернормальной возбудимости ПД (конец 3-й фазы ПД или нисходящее колено зубца Т на ЭКГ) может вызвать распространяющееся возбуждение (ПД). Замедление и блокада проведения возбуждения возникают вследствие функциональных или органических изменений в проводящей системе сердца. Основными причинами являются: ♦ ↑ эффектов парасимпатических влияний на сердце и/или его холинореактивных свойств, приводящих к замедлению скорости волны возбуждения по проводящей системе, особенно на уровне АВ–узла (отрицательный дромотропный эффект АХ); ♦ Непосредственное повреждение клеток проводящей системы различными факторами. Нарушение синоатриального проведения импульса характеризуетсяторможением или блокадой передачи импульса возбуждения от СУ к предсердиям, что обусловливает выпадение отдельных сердечных сокращений, замедление частоты и нарушение регулярности сердечных сокращений. Расстройства внутрипредсердного проведения, как правило, обусловлены возрастанием в условиях патологии неодномоментного возбуждения П в связи с несимметричным расположением по отношению к ним СУ (их возбуждение и в N протекает с разницой во времени - вначале правое и с некоторым запозданием левое). Нарушения АВ–проведенияразвивается в результате удлинения рефракторного периода после ПД клеток П и АВ-системы и характеризуются замедлением или блокадой проведения возбуждения из П в Ж (различают несколько разновидностей АВ блокад). Внутрижелудочковые (интравентрикулярные) нарушения проведения чаще возникает в одной из ножек пГ, затем распространяется по неповреждённой системе ножек пучка и только после этого к другому желудочку (главным образом через межжелудочковую перегородку), что обусловливает неодновременное, дискордантное сокращение Ж. Замедление или кратковременная блокада синусно‑ предсердного проведения обусловливают ↓ СВ, ↓ АД, развитие ишемии органов и тканей. Если блокада длится несколько минут и не сопровождается развитием замещающего гетеротопного (узлового или желудочкового ритма), то это ведёт к асистолии и гибели пациента. Нарушение внутрипредсердного и внутрижелудочкового проведения импульса возбуждения само по себе существенно не изменяет частоты и ритма сердечных сокращений. В связи с этим системные гемодинамические расстройства определяются основным заболеванием сердца (миокардитами, пороками клапанов, ИМ и т. п. ). При полной АВ-блокаденарушения гемодинамики обусловлены главным образом степенью желудочковой брадикардии и основной сердечной патологией. В результате значительной брадикардии часто отмечается застой венозной крови и ↓ СВ. Блокада проведения импульса на любом уровне проводящей системы (чаще при полной АВ-блокаде) может осложниться развитием синдрома Морганьи‑ Адамса‑ Стокса с внезапной потерей сознания, отсутствием пульса, сердечных тонов, эпилептиформными судорогами, продолжительностью 5–20с, редко 1–2 мин. ↓ КК при замедлении или блокаде проведения импульсоввыявляются в тех случаях, когда имеется существенное ↓ системного АД, что обусловливает ↓ перфузионного Р в КА и может привести к КН. Ускорение проведения возбуждения между П и Ж или отдельными участками сердца возникает благодаря дополнительным (минуя АВ-узел) путям проведения возбуждения (Венкебаха, Кента, Бахмана, Джеймса и др. ) и повышенной возбудимости гетеротопных очагов. В последнем случаев М желудочков имеются участки, способные к преждевременному, опережающему возбуждению, которые иногда под воздействием импульса возбуждения, распространяющегося по проводящей системе, электрического или механического (при растяжении М избытком притекающей крови) раздражения, активации симпатикоадреналовых влияний на сердце и др факторов становятся очагами гетеротопной ритмической активности. Что касается дополнительных путей проведения импульсов, то благодаря им синусовые импульсы поступают в Ж как по основному атриовентрикулярному, так и и дополнительным путям. В этих у словиях возбуждение по дополнительным пучкам распространяется быстрее и достигает Ж раньше того же импульса, проходящего через АВ-узел, в результате чего преждевременно активируется часть Ж, а остальная их часть возбуждается позднее импульсом, проходящим через АВ-узел, что обусловливает развитие тахикардии. Клинически укорение проведения импульсов проявляется синдромом Вольффа‑ Паркинсона‑ Уайта, который характеризуется развитием ПТ (примерно, в 50-80%), ФиТ (в 20-30%) П и/или Ж и синдромом Клерка‑ Леви‑ Кристеско с преждевременным возбуждением Ж, ускорением интервала P‑ R/Q и ↑ ЧСС. Ускорение проведения импульсов обычно сопровождается ♦ ↓ ударного и СВ (вследствие ↓ наполнения камер сердца кровью в условиях тахикардии, МА, трепетания П), ♦ ↓ АД, вызванного ↓ СВ и ОПСС и в большей или меньшей степени ↓ КК, что чревато развитием КН.
VIII. Классическим примером комбинированных СА (КСА), развивающихся вследствие одновременного нарушения образования и проведения импульсов(комбинированных расстройств возбудимости, проводимости и автоматизма) является парасистолия. Возникновение парасистолии не связано с основным ритмом сердца. В ее основе лежит постоянное или временное прекращение поступления импульса в определенный участок М (блокада входа), способный к генерации импульса. Исследования, выполненные в последние годы, свидетельствуют о том, что парасистолия одно из достаточно часто встречающихся нарушений ритма. При парасистолии сердце сокращается как за счет импульсов из основного водителя ритма, так и из парасистолического центра. При этом в парасистолическом центре импульсы возникают ритмично, но с меньшей частотой, чем основной ритм. Возникающие в парасистолическом центре импульсы могут периодически блокироваться (блокада выхода), что может создавать впечатление неритмичности генерации импульсов. Возбудимость - свойство клеток воспринимать сигнал и реагировать на него реакцией возбуждения (генерацией ПД). Следует отличать от автоматизма, заключающегося в спонтанной генерации импульсов возбуждения. Свойством возбудимости обладают как рабочие (сократительные) КМ, так и КМ проводящей системы. Возбудимость лежит в основе распространения электрического импульса по сердцу. Возбудимость сердца описывается законом «всё или ничего»: подпороговые раздражители не инициируют ПД, тогда как раздражители пороговой величины вызывают максимальный по величине и скорости распространения ПД; ↑ силы раздражения (надпороговые величины) не меняет характеристик ПД. Возбудимость КМ изменяется в отдельные периоды сердечного цикла: во время систолы они не возбуждаются, т. е. рефрактерны к раздражению; во время диастолы возбудимость КМ восстанавливается. Существуют два коротких интервала сердечного цикла, когда возбудимость М повышена: уязвимый период и период сверхнормальной возбудимости. Уязвимый период - терминальная часть фазы реполяризации, компонент ОРП. В уязвимый период величина порогового МП снижена, а возбудимость повышена. В связи с этим даже сравнительно слабые электрические импульсы и другие раздражители могут вызвать возбуждение и аритмию. Этот период совпадает с пиком волны T на ЭКГ и соответствует 3-й фазе реполяризации клетки. Период сверхнормальной возбудимости следует непосредственно после окончания ОРП, находится в начале диастолы и совпадает с волной U на ЭКГ. В этот период ПД могут вызвать даже подпороговые импульсы. Причинами КСА чаще всего являются: функциональные расстройства и органические поражения н. с.; поражения М; нарушения электролитного баланса; влияние токсических веществ; ннтоксикация ЛС; гипоксемия (при СН, «лёгочном сердце»). В развитии КСА учавствуют следующие механизмы: 1) Анормальный автоматизм (Комбинированные механизмы нарушений ритма характеризуются наличием эктопического центра, генерирующего собственный ритм, который защищён так называемой блокадой входа - зоной нарушенной проводимости, препятствующей подавлению эктопического очага синусовыми импульсами; Создаются условия для одновременного сосуществования двух источников активации сердца: нормального (синусового) и работающего в автономном режиме альтернативного (парасистолического), что проявляется парасистолией); 2) Постдеполяризационная и триггерная активность; 3) Повторный вход (reentry) и круговое движение импульса; 4) Нарушения проводимости. КСА подразделяют на: 1) Экстрасистолии (синусовая, предсердная [наджелудочковая], из СУ [узловая, атриовентрикулярная], желудочковая); 2) Пароксизмальные тахикардии (предсердная, из предсердно-желудочкового соединения, желудочковая, трепетание и мерцание предсердий); 3) Трепетание и мерцание желудочков. Э (наиболее часто регистрируемый вид СА) - единичный преждевременный импульс возбуждения и, как правило - единичное сокращение сердца или отдельных его камер. Нередко Э регистрируются повторно. Если три и более Э следуют одна за другой, то говорят об экстрасистолии, которая подразделяется на: ♦ аллоритмии и ♦ парасистолии. Аллоритмия - это сочетание в определённой последовательности нормальных (своевременных) сокращений с экстрасистолами. Различают бигеминию (Э после каждого одного, очередного импульса возбуждения), тригеминию (Э после каждых двух импульсов), квадригеминию (Э после трёх очередных импульсов). Парасистолия - сосуществование двух или более независимых, одновременно функционирующих очагов генерации импульсов, вызывающих сокращение всего сердца или отдельных его частей. Один из очагов, как правило, СУ, определяет основной ритм сердца, другой очаг - эктопический (парасистолический) обычно расположен в желудочках. ПТ - приступообразное и внезапное ↑ частоты импульсации правильного ритма из эктопического очага сердца. О пароксизме ТК говорят, когда число эктопических импульсов превышает 3-5, а частота их колеблется обычно от 160 до 220 в мин. (при расположении гетеротопного очага в П) или от 140 до 200 (при расположении в Ж). Трепетание предсердий и желудочков проявляется высокой частотой импульсов возбуждения и, как правило, сокращений сердца правильного ритма (предсердий обычно 220–350 в мин., желудочков - 150-300 в мин. ). Характеризуется отсутствием диастолической паузы и поверхностными, гемодинамически неэффективными сокращениями М. При трепетании предсердий, как правило, развивается АВ-блокада. В связи с этим в Ж проводится только каждый 2-4 предсердный импульс, поскольку функциональные особенности АВ-узла таковы, что он способен проводить обычно не более 200-250 импульсов в мин. Фибрилляция (мерцание) предсердий и желудочков представляет нерегулярную, беспорядочную электрическую активность предсердий и желудочков, сопровождающуюся прекращением эффективной насосной функции сердца. Мерцание П развивается при частоте эктопических импульсов более 400–500 в мин., Ж - более 300-500. При такой частоте возбуждения клетки М не могут ответить синхронным, координированным сокращением, охватывающим весь М. Отдельные волокна или микроучастки сердца сокращаются беспорядочно по мере выхода их из рефрактерного периода.
1. Task Force on the management of ST-segment elevation acute myocardial infarction of the European Society of Cardiology (ESC), Steg P. G., James S. K., et al. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation (англ. ) // European Heart Journal (англ. )русск. : journal. — 2012. — October (vol. 33, no. 20). — P. 2569—2619. — doi: 10. 1093/eurheartj/ehs215. — PMID 22922416.
2. Hamm C. W., Bassand J. P., Agewall S., et al. ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: The Task Force for the management of acute coronary syndromes (ACS) in patients presenting without persistent ST-segment elevation of the European Society of Cardiology (ESC) (англ. ) // European Heart Journal (англ. )русск. : journal. — 2011. — December (vol. 32, no. 23). — P. 2999—3054. — doi: 10. 1093/eurheartj/ehr236. — PMID 21873419. Архивировано 16 января 2013 года. Архивная копия от 16 января 2013 на Wayback Machine
3. ↑ Lars Wallentin, Freek Verheugt, Frans Van de Werf, Massimo F. Piepoli, Franz-Josef Neumann. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevationThe Task Force on the management of ST-segment elevation acute myocardial infarction of the European Society of Cardiology (ESC) (англ. ) // European Heart Journal. — 2012-10-01. — Vol. 33, iss. 20. — P. 2569—2619. — ISSN0195-668X. — doi: 10. 1093/eurheartj/ehs215.
4. ↑ Alexandra P. Bremner, Judith Finn, Linda L. Coventry. Sex differences in symptom presentation in acute myocardial infarction: A systematic review and meta-analysis (англ. ) // Heart & Lung: The Journal of Cardiopulmonary and Acute Care. — 2011-11-01. — Vol. 40, iss. 6. — P. 477—491. — ISSN 1527-3288 0147-9563, 1527-3288. — doi: 10. 1016/j. hrtlng. 2011. 05. 001.
5. ↑ Федюкович Н. И. Внутренние болезни. Учебник. — Ростов-на-Дону: Феникс, 2012. — С. 230.
6. ↑ Smith SC Jr, Benjamin E. J., Bonow R. O., et al. AHA/ACCF Secondary Prevention and Risk Reduction Therapy for Patients with Coronary and other Atherosclerotic Vascular Disease: 2011 update: a guideline from the American Heart Association and American College of Cardiology Foundation (англ. ) // Circulation (англ. )русск. : journal. — Lippincott Williams & Wilkins (англ. )русск., 2011. — November (vol. 124, no. 22). — P. 2458—2473. — doi: 10. 1161/CIR. 0b013e318235eb4d. — PMID 22052934. (недоступная ссылка)
7. ↑ ISIS-2 Collaborative group. Randomized trial of intravenous streptokinase, oral aspirin, both, or neither among 17, 187 cases of suspected acute myocardial infarction: ISIS-2 (англ. ) // The Lancet: journal. — Elsevier, 1988. — Vol. 2, no. 8607. — P. 349—360. — PMID 2899772.
8. ↑ Main C, Palmer S, Griffin S, Jones L, Orton V, Sculpher M, et al. Clopidogrel used in combination with aspirin compared with aspirin alone in the treatment of non-STsegment-elevation acute coronary syndromes: a systematic review and economic evaluation. Health Technol Assess 2004; 8(40). Архивная копия от 6 мая 2012 на Wayback Machine
9. ↑ B. Ibanez, C. Macaya, V. Sanchez-Brunete, G et al. (2013) Effect of Early Metoprolol on Infarct Size in ST-Segment-Elevation Myocardial Infarction Patients Undergoing Primary Percutaneous Coronary Intervention: The Effect of Metoprolol in Cardioprotection During an Acute Myocardial Infarction (METOCARD-CNIC) Tri. Circulation, 128 (14): 1495 OI: 10. 1161/%u200BCIRCULATIONAHA. 113. 003653
10. ↑ Пятая ежегодная конференция «Стволовые клетки и перспективы их использования в здравоохранении». Архивная копия от 8 марта 2012 на Wayback Machine
11. ↑ Clifford DM, Fisher SA, Brunskill SJ, Doree C, Mathur A, Watt S, Martin-Rendon E. Stem cell treatment for acute myocardial infarction. Cochrane Database of Systematic Reviews 2012, Issue 2. Art. No.: CD006536. DOI: 10. 1002/14651858. CD006536. pub3. Архивная копия от 25 февраля 2012 на Wayback Machine
12. ↑ Arslan, F., Lai, R. C., Smeets, M. B et al. & de Kleijn, D. P. (2013) Mesenchymal stem cell-derived exosomes increase ATP levels, decrease oxidative stress and activate PI3K/Akt pathway to enhance myocardial viability and prevent adverse remodeling after myocardial ischemia/reperfusion injury. Stem cell research, 10(3), 301—312. https: //dx. doi. org/10. 1016/j. scr. 2013. 01. 002
13. ↑ Lai, R. C., Yeo, R. W. Y., Tan, K. H., & Lim, S. K. (2013) Mesenchymal stem cell exosome ameliorates reperfusion injury through proteomic complementation. Regenerative medicine, 8(2), 197—209. doi: 10. 2217/rme. 13. 4
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|

