
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Варианты изменений зубца T при ишемии Рис. 3
I. Недостаточность кровообращения (НК) - это состояние, при котором система кровообращения не обеспечивает текущие потребности тканей и органов в кровоснабжении. Система крово‑ и лимфообращения - одна из интегрирующих систем организма, в которую входят сердце, кровеносные, лимфатические сосуды (ССС), кровь и лимфа. В ней различают центральное и периферическое звенья. Периферическое кровообращение (органно‑ тканевое, местное, регионарное) обеспечивает кровоток в отдельных органах и тканях в соответствии с их постоянно меняющейся функциональной активностью и уровнем пластических процессов. Включает кровообращение в сосудах микроциркуляторного русла. Центральное кровообращение осуществляется на уровне сердца и крупных сосудов и обеспечивает поддержание системного АД, направление движения крови из артериального русла в венозное и далее к сердцу, демпфирование значительных колебаний АД при выбросе крови из желудочков сердца. Большинство расстройств сердечной деятельности объединяют в 3 группы типовых форм патологии (ТФП): •коронарная недостаточность (КН), •сердечные аритмии (СА) и • сердечная недостаточность (СН). К основным причинам НК относят расстройства сердечной деятельности, нарушения тонуса стенок кровеносных сосудов, изменения ОЦК и/или реологических свойств крови. В зависимости от уровня поражения выделяют недостаточность центрального кровообращения (обусловлена патологией сердечной деятельности и магистральных сосудов) и периферического, включая нарушения микроциркуляции. По компенсированности расстройств различают компенсированные (признаки расстройств выявляются при нагрузке) и некомпенсированные виды НК (в покое). По остроте развития и течения выделяютострую НК, которая развивается в течение часов и суток (ИМ, острая СН, пароксизмальная тахикардия, мерцательная аритмия (МА), выраженная брадикардия, острая кровопотеря, шок) и хроническую - развивающуюся на протяжении нескольких месяцев или лет (перикардиты, длительно текущие миокардиты, миокардиодистрофии, кардиосклероз, пороки сердца, гипер‑ и гипотензивные состояния, анемии, гиперволемии). По выраженности признаков выделяют три стадии НК: •Стадия I (начальная) или НК 1-й степени, признаки которой (↓ скорости сокращения миокарда (М), ↓ фракции выброса, одышка, сердцебиение, быстрая утомляемость) выявляются при физической нагрузке (ФН) и отсутствуют в покое; •Стадия II или НК 2-й степени (умеренно или значительно выраженная НК), при которой указанные для начальной стадии признаки НК обнаруживаются не только при ФН, но и в покое и •Стадия III (конечная) или НК 3-й степени, характеризующуюся значительными нарушениями сердечной деятельности и гемодинамики в покое, а также развитием дистрофических и структурных изменений в органах и тканях. Сердечно‑ сосудистые заболевания (ССЗ) занимают 1-е место среди причин инвалидизации и гибели человека и считаются убийцами № 1. 15-20% населения страдает ИБС, которая является причиной внезапной смерти у 2/3 пациентов. Около 50% из них становятся инвалидами в трудоспособном возрасте. Выделяют до 50 факторов риска (ФР) ССЗ, к которым относятся: •повторные и затяжные стрессы; •хр. гиподинамия; •интоксикация алкоголем, курение, избыточное потребление чая, кофе и др. «бытовых допингов»; •некачественное, несбалансированное питание, переедание, •ожирение и др.
II. КН - ТФП сердца, характеризующаяся превышением потребности миокарда (М) в O2 и субстратах метаболизма над их притоком по коронарным артериям (КА), а также нарушением оттока от (М) метаболитов, БАВ, ионов и др. агентов. Ведущими патогенетическими факторами КН являются ишемия и реперфузия М. Различают обратимые и необратимые виды КН. Клинически КН проявляется как ИБС. Обратимые (транзиторные) виды КН проявляются различными клиническими формами стенокардии (СК) и состояниями после реперфузии (реваскуляризации) М. Состояния после реперфузии М развиваются у пациентов с ИБС в результате хирургического возобновления или значительного ↑ коронарного кровотока (напр., после аортокоронарного шунтирования, чрескожной внутрисосудистой ангиопластики, стентирования КА) или медикаментозного восстановления тока крови (напр., тромболизиса, дезагрегации ФЭК с помощью тромбо‑ и фибринолитиков или дезагрегантов). Необратимое прекращение или длительное значительное ↓ притока крови по КА в каком‑ либо регионе М завершается, как правило, инфарктом миокарда (ИМ). При СК стабильного течения длительность ишемии М, предшествующей реперфузии достигает 20-28 мин. и сопровождается обратимым повреждением кардиомиоцитов (КМ) в зоне реперфузии; при СК нестабильного течения и вариантной СК она может доходить до 40-60 мин. и сопровождаться необратимым для многих КМ повреждением; при состояниях после реваскуляризации М у пациентов с ИБС - достигает > 60-120 мин., сопровождаясь необратимым для большинства КМ повреждением в зоне реперфузии; при ИМ наблюдается необратимое для всехКМ повреждение с исходом в кардиосклероз. Причины КН подразделяют на коронарогенные и некоронарогенные. Коронарогенными являются факторы, приводящие к абсолютному ↓ и/или прекращению притока крови к М по КА (встречаются чаще), некоронарогенными - ♦ состояния, которые ↑ расход O2 и/или субстратов метаболизма М и ♦ приводящие к значительному ↓ в крови и КМ O2 и/или субстратов обмена в-в. К факторам, приводящим к абсолютному↓ коронарногого кровотока (КК): 1) Атеросклероз КА(выявляется у96% пациентов ИБС); 2) Агрегация ФЭК и коронаротромбоз, обусловленных ♦ атеросклерозом КА, ♦ турбулентным характером КК и ♦ ↑ содержания и активности факторов гемокоагуляции, высвобождающихся из повреждённых клеток крови и стенки сосуда, дополнительно стимулирующих агрегацию и адгезию ФЭК, высвобождение из них БАВ, потенцирующих, клеточную агрегацию и тромбообразование в просвете и на внутренней поверхности КА; 3) Спазм КА, развивающийся вследствие значительного ↑ в крови катехоламинов (КхА), тромбоксана А2, ПгF2α. и др. вазоконстрикторов или ↑ адренореактивости КА; 4) ↓ притока крови к М и ↓ в связи с этим перфузионного Р в КА (значительной бради- или тахикардии, трепетания и мерцания предсердий и/или желудочков, аортальной недостаточности, коллапса, сдавления КА опухолью, рубцом, инородным телом). Согласно концепции о динамическом стенозе КА, КН является результатом комбинированного действия комплекса взаимосвязанных факторов: сужения просвета КА вследствие утолщения их стенок, сокращения ГМК КА и ↓ их просветапод влиянием КхА и др. вазоконстрикторов и сужения или закрытия просвета сосуда агрегатами ФЭК и тромбами. К основным факторам, вызывающим значительное ↑ потребления М O2 и субстратов метаболизма, приводящим к КН, относятся: 1) существенное ↑ в сердце уровня КхА (при стрессе или феохромоцитоме) и 2) значительное ↑ работы сердца вследствие ♦ чрезмерной ФН, ♦ длительной тахикардии, ♦ острой артериальной гипертензии (АГ), ♦ выраженной гемоконцентрации и ♦ значительной гиперволемии, которые приводят к активации САС с высвобождением избытка КхА и реализацией ими кардиотоксического действия. К механизмам кардиотоксического действия избытка КхАв Мотносят: 1) Чрезмерное потребление М O2 и субстратов метаболизма за счет положительного хроно‑ и инотропного эффектов КхА и значительного ↑ в связи с этим функции сердца; 2) ↓ эффективности ресинтеза АТФ и, в связи с этим, расхода O2 и субстратов окисления, что вызвано ♦ повреждением мембран (плазматической мембраны, митохондрий); ♦ инактивацией ферментов тканевого дыхания, гликолиза, пентозофосфатного шунта СР, продуктами метаболизма и ПОЛ, образование которых стимулируют КхА и активированные гидролазы лизосом; ♦ разобщением ОФ вследствие избыточного накопления в КМ (под влиянием КхА) ВЖК и ионов Ca2+; 3) ↓ в сравнении с потребным V КК, что является результатом укорочения в условиях катехоламиновой тахикардии диастолы, в течение которой приток крови к М максимален, ↑ напряжения М и сдавления в связи с этим КА, усиления агрегации клеток крови в просвете микрососудов; 4)Образование избытка активных форм O2 и перекисей липидов. К основным состояниям, вызывающим значительное ↓ в крови и клеткахМO2 и/или субстратов метаболизма, с развитием КН, относятся 1) Общая гипоксия с дефицитом O2 в КМ и 2) СД с дефицитом глюкозы в клетках М. Недостаток O2 и субстратов метаболизма в М, а также нарушение оттока метаболитов в условиях КН приводят к активации ряда типовых механизмов повреждения М (1. Расстройству энергообеспечения КМ; 2. Повреждению их мембран и ферментов; 3. Дисбалансу ионов и жидкости; 4. Расстройствам механизмов регуляции сердца; 5. Изменению электрофизиологических (ЭФ) параметров и нарушению функции, пластических процессов и структуры клеток), которые реализуются как в зоне ишемии, так и за её пределами (в последней в существенно меньшей мере). Механизмы расстройств энергообеспечения КМ при КН представлены на рис. 1.

Механизмы нарушения энергообеспечения М при КН (период ишемии и начальный этап реперфузии). Рис. 1.
В аэробных условиях основными субстратами для синтеза АТФ служат жирные кислоты (65–70%), глюкоза (15–20%) и МК (10–15%). Роль аминокислот (АК), кетоновых тел (КТ) и пирувата в энергообеспечении М сравнительно невелика. В условиях нарастающей ишемии в М истощается связанный с миоглобином (МHb) «резерв» O2 и ↓ интенсивность окислительного фосфорилирования (ОФ). В 1 г ткани М содержит 40 мг МHb. Каждый грамм МHb связывает в среднем 1, 34 мл O2. На 300 г М приходится 16 мл «резервного» O2. Этих запасов хватает на 3-4 секунды непрерывной работы. КМ левого желудочка (ЛЖ) в фазе систолы (0, 33 с при ритме 70 уд/мин) не получают крови. За этот период частичная компенсация в O2 происходит с помощью МHb. В диастолу запасы восстанавливаются. В результате указанных изменений в КМ ↓ содержание АТФ и креатинфосфата (КФ). ↓ уровня АТФ уже начинается при продолжительности ишемии в несколько секунд; при продолжительности в 1-2 мин – происходит нарушение сократительной функции; в 10 мин. - ↓ уровня АТФ до 50% от нормального; в 20 мин. - ↓ уровня АТФ до 90%; в 20-40 мин. – необратимое повреждение КМ. Нарушение аэробного синтеза АТФ сопровождается активацией гликолиза и накоплением лактата. Одновременно быстро ↓ запасы гликогена. Активация гликолиза приводит к метаболическому ацидозу. Развитие внутри- и внеклеточного ацидоза существенно изменяет проницаемость мембран для метаболитов и ионов, подавляет активность ферментов энергообеспечения, синтеза клеточных структур, транспорта субстратов метаболизма и катионов. Расстройство энергообеспечения КМ приводит к ♦ ↓ сократительной функции М, ♦ нарушениям кровообращения в органах и тканях, ♦ развитию СА. Последние нередко становятся причиной внезапной смерти пациентов с КН. К механизмам повреждения мембран и ферментов относятся: 1)Интенсификация СПОЛ; 2) Активация лизосомальных, мембраносвязанных и солюбилизированных гидролаз; 3) Нарушение конформации молекул белка, липопротеидов, фосфолипидов; 4) Торможение процессов ресинтеза поврежденных компонентов мембран и ферментов, синтеза их de novo; 5) Растяжение и разрывы мембран гипергидратированных КМ. Интенсификация СПОЛ и активация гидролаз приводят к накоплению избытка продуктов ПОЛ, гидролиза липидов и фосфолипидов - свободных радикалов (СР), активных форм О2, альдегидов, гидро- и липоперксидов, патогенное действие которых, в условиях ингибирования процессов репарации и синтеза (de novo) компонентов мембран и ферментов, нарастающего растяжения и разрывов мембран гипергидратированных КМ, обусловливают модификацию физико-химических свойств, биохимического состава и структуры ферментов и мембран. Дисбаланс ионов и жидкости развивается вслед за расстройствами энергообеспечения КМ и повреждением их мембран и ферментов или одновременно с ними. Нарушается общее содержание ионов и жидкости в клетках и ткани М, внутри- и внеклеточное соотношение и распределение (компартментализация) отдельных ионов (прежде всего Na+, K+, Cl–, Ca2. Общее содержание ионов в клетках ишемизированного М существенно ↑. Вследствие ↓ активности Na+, K+‑ АТФазы, дефицита АТФ, ↑ проницаемости плазматической мембраны происходит ♦ ↑ [K+] вне КМ, ♦ ↑ содержания ионов Na+, Ca2+ внутри КМ, что обусловливает накопление избытка жидкости в клетках М и существенное ↑ их V. Потеря КМ K+ сопровождается ↑ его содержания в интерстиции и гиперкалиемией, что является одним из характерных признаков КН, особенно ИМ. Дисбаланс ионов и жидкости вызывает нарушениемембранного электрогенеза (возбудимости, автоматизма ритмогенеза, проводимости), сократимости, электромеханического сопряжения и регуляции сердечной деятельности, что нередко сопровождается развитием СА!! К повреждению КМ, изменению функций М приводят и расстройства механизмов регуляции сердца. КН характеризуется стадийными изменениями активности симпатического и парасимпатического механизмов регуляции. На начальном этапе ишемии М, как правило, наблюдается значительная активация симпатико-адреналовой системы (САС), что сопровождается ↑ содержания в М норадреналина (НА) и особенно адреналина (Адр), вследствие чего развивается тахикардия (ТК), ↑ величина СВ, как правило, снижающегося сразу после начала эпизода КН. Параллельно с этим могут усиливаться и парасимпатические влияния, о чем свидетельствует ↑ в М содержания ацетилхолина (АХ), но степень их усиления меньше, чем симпатических. На более поздних сроках КН (через несколько десятков мин., иногда часов) нередко регистрируется ↓ содержания в М НА и сохранение повышенного уровня АХ. Одновременно отмечаются (БК), ↓ СВ, скорости сокращения и расслабления М. В условиях КН (особенно при длительной ишемии и на начальном этапе реперфузии М) развивается феномен гормоно‑ нейромедиаторной диссоциации КхА(соотношение нейромедиатора НА и гормона Адр), сопровождающийся потенцированием ишемического и реперфузионного повреждения М, который заключаетсяв значительном ↑ в ишемизированном М Адр, реализации его кардиотоксических эффектов при одновременном ↓ содержания НА. Механизм прооксидантного действия избытка Адр в сердце приведён на рис. 2.

Механизм прооксидантного эффекта избытка адреналина в М. Рис. 2
В покое у половины пациентов КН характерных изменений ЭКГ не выявляется. В момент болевого приступа СК, как правило, регистрируются ↓ (депрессия) сегмента ST (он становится горизонтальным либо дугообразным) и инверсия зубца T (часто); при вариантной СК выявляется преходящий подъём сегмента ST. ♦ Ударный и СВ, как правило, ↓, степень ↓ которого коррелирует со степенью ишемии М, размером и топографией повреждённой зоны М, что связано «выключением» ишемизированного региона М из сократительного процесса. Одним из механизмов компенсации ↓ ударного выброса является ТК, обусловленная активацией САС (в ответ на ↓ величины СВ), а также ↑ Р крови в полых венах и предсердиях. ♦ Скорость систолического сокращения и диастолического расслабления М существенно↓ вследствие дефицита АТФ, повреждения мембран миофибрилл, саркоплазматической сети и саркоплазмы, ↓ активности Ca2+‑ зависимых АТФаз. ♦ Конечное диастолическое Р в полостях сердца ↑ вследствие ↓ сократимости повреждённого М и ↓ степени диастолического расслабления М, что вызвано субконтрактурным состоянием его в связи с избытком Ca2+ в цитозоле и миофибриллах КМ (на начальном этапе КН в связи с выходом Ca2+из митохондрий и саркоплазматической сети; на более поздних - в связи с поступлением ионов Ca2+ из внеклеточной жидкости через повреждённую плазмолемму). СК характеризуется спонтанной или вызванной медикаментозно сменой периода ишемии М периодом возобновления КК – реперфузией. Постишемическая (постокклюзионная, постстенотическая) реперфузия (РП) М (ПИРМ) ♦ препятствует развитию ИМ, ♦ предотвращает формирование аневризмы в ранее ишемизированной зоне сердца, ♦ способствует образованию соединительной ткани в стенке аневризмы, если она развилась и ♦ потенцирует восстановление сократительной функции сердца. Вместе с тем установлено, что начальный этап ПИРМ нередко сопровождается существенными расстройствами функции сердца: ♦ развитием СА, чреватых смертью пациента; ♦ преходящей дестабилизацией центрального и органно‑ тканевого кровообращения; ♦ дисбалансом биохимических параметров М; ♦ нарушением ЭФ свойств сердца. ПИРМ оказывает, наряду
с основным репаративным, восстановительным эффектом, также и патогенное действие на М. Последнее является суммарным следствием пролонгирования его ишемического повреждения и дополнительной альтерации М факторами реперфузии и реоксигенации. К основным механизмам реперфузионного повреждения КМ относят: 1) Усугубление нарушения энергообеспечения клеток реперфузируемогоМ на этапах ресинтеза, транспорта, утилизации энергии АТФ, обусловленного ♦ гипергидратацией, набуханием и разрушением митохондрий в реперфузируемом М (вследствие осмотического отёка органелл, перерастяжения и разрыва их мембран в связи с избыточным накоплением в них Ca2+ и жидкости); ♦ разобщающим эффектом избытка Ca2+; ♦ выходом АДФ, АМФ и др. пуриновых соединений из митохондрий КМ в межклеточную жидкость. 2) ↑ степени повреждения мембран и ферментов клетокМ вследствие ♦ реперфузионной (О2-зависимой) интенсификации липопероксидного процесса; ♦ кальциевой активации гидролаз; ♦ осмотического набухания и разрыва мембран КМ и их органелл. 3) ↑ дисбаланса ионов и жидкости в КМ вследствие ♦ реперфузионных расстройств энергообеспечения и ♦ повреждения мембран и ферментов, обусловливающих накопление избытка Na+, Ca2+ и жидкости в клетках М. 4) ↓ эффективности регуляторных (нервных, гуморальных) воздействий на сердце (в N способствующих интеграции и нормализации внутриклеточных процессов). 5) ↑ степени гормоно‑ нейромедиаторной диссоциации. Рациональная терапия постишемических реперфузионных состояний позволяет: ♦ предотвратить развитие ИМ или значительно ↓ V поражённого участка М; ♦ стимулировать процессы репарации в М; ♦ нормализовать сократительную функцию сердца, ♦ восстановить оптимальные параметры кровообращения в организме.
III. ИБС – это поражение М, обусловленное расстройством коронарного кровообращения, возникающее вследствие нарушения равновесия между потребностью М в О2 и субстратах метаболизма и их доставкой к нему. Термин «ишемическая болезнь сердца» (от лат. morbus ischaemicus cordis - «задерживаю, сдерживаю») был впервые предложен Комитетом экспертов ВОЗ в 1962 году; в англоязычной литературе используется как «коронарная БС». ИБС развивается вследствие локальной ишемии М, обусловленной нарушениями КК в бассейне той или иной КА. Величина КК, как и в любом др. органе, определяется перфузионным Р и R, оказываемым кровотоку сосудами . Но в отличие от др. органов в сердце эти параметры постоянно изменяются в зависимости от фазы сердечного цикла. Так, во время систолы интрамиокардиальные артерии суживаются из-за сдавления сокращающимся М, что создает неблагоприятные условия для кровоснабжения субэндокардиальных слоев М. В то же время именно эти зоны испытывают максимальное напряжение во время систолы. Одновременно в период быстрого изгнания крови в аорту и присасывающего действия струи (venturi эффект) перфузионное Р в КА ↓. Поэтому наиболее благоприятные условия для перфузии М имеются в диастолическую фазу сердечного цикла. Укорочение диастолы (ТК) существенно ухудшает возможности адекватной перфузии М, сочетающиеся со значительным ↑ потребности М в O2. Но у здорового человека даже при значительной ТК не развивается ишемия субэндокардиальных слоев М из-за дилатации субэндокардиальных артерий, что и обеспечивает одинаковую величину перфузии субэпикардиальных и субэндокардиальных слоев М применительно к каждому сердечному циклу. Однако эти же факторы определяют и меньший резерв вазодилатации в субэндокардиальных участках М. Величина сопротивления КК зависит не только от напряжения и расслабления М во время сердечного цикла. Многочисленные нейрогенные, гормональные, метаболические и миогенные факторы оказывают существенное влияние на тонус КА. Изменения концентрации катионов в цитоплазме ГМК являются конечной точкой приложения действия большинства экстраклеточных факторов, регулирующих тонус сосудов. К вазоконстрикции приводит ↑ в цитоплазме ГМК Ca2+, к вазодилатации - К+ и Мg+. Сложное взаимодействие всех этих влияний и определяет состояние тонуса КА как в физиологических условиях, так и при различных патофизиологических состояниях. Основной причиной ИБС является органический стеноз КАвследствие атеросклероза [по данным А. М. Вихерта до 96%], реже - коронарита (коллагенозы, васкулиты), амилоидоза, расслаивающейся аневризмы аорты, врождённых аномалий артерий, эмболий КА. Реже ИБС обусловливают функциональный коронароспазм, ↑ тонуса КА, преходящие нарушения микроциркуляции и коронаротромбоз. Атеросклероз КА считают морфологической основой ИБС. Под атеросклерозом понимают морфологические изменения во внутреннем слое артерии, проявляющиеся в локальном накоплении липидов (чаще холестерина и его эфиров) с развитием соединительной ткани и пролиферацией ГМК. Неосложненная атеросклеротическая бляшка (АБ) имеет покрышку, состоящую из элементов соединительной ткани, ГМК, покрытых эндотелием. Холестерин и его эфиры, а также пенистые клетки (макрофаги) содержатся в центре АБ. Хотя атеросклеротические изменения КА имеются почти у всех людей пожилого возраста, тем не менее их выраженность, сроки появления и темпы прогрессирования варьируют в широких пределах. В решающей мере они определяются уровнем липидов в крови, состоянием эндотелия, а также функциональной активностью ряда клеток (моноцитов, ГМК, Тr). Повреждение эндотелия приводит к скоплению на его поверхности моноцитов и Т r. Моноциты проникают под эндотелий и постепенно превращаются в пенистые клетки. Поврежденный эндотелий, макрофаги и адгезированные Тr выделяют большое количество БАВ, изменяющих состояние стенки сосуда. Резко усиливается синтез эндотелина, вызывающего локальный ангиоспазм и способствующего дальнейшему ↑ проницаемости эндотелия; адгезированными Тr выделяеся тромбоксан с аналогичным действием и тромбоцитарный фактор роста, стимулирующий пролиферацию ГМК и их миграцию к очагу повреждения. Поврежденным эндотелием продуцируется фактор роста с подобным действием. Макрофаги и эндотелий выделяют метаболиты, стимулирующих продукцию фибробластами основных компонентов соединительной ткани (протеогликаны, эластин, коллаген). Эти же факторы изменяют функциональную активность ГМК, которые также приобретают способность к синтезу основных компонентов соединительной ткани. Часть пенистых клеток постепенно разрушается, и содержащиеся в них холестерин и его эфнры оказываются вне клеток, образуя " липидное ядро" будущей АБ, которое постепенно покрывается соединительнотканными элементами, ГМК и эндотелием. Полного параллелизма между выраженностью коронарного атеросклероза и тяжестью клинических проявлений ИБС нет. Нередко единственная АБ может быть причиной фатального ИМ. В то же время у больных с распространенным атеросклерозом КА могут отсутствовать клинические проявления ИБС. При прогрессирующем сужении просвета КА участок, расположенный дистальнее места стеноза, расширяется, что способствует ↑ градиента Р в месте сужения, благодаря чему до определенного времени обеспечивается сохранение адекватного поступления крови к М. С ↑ стеноза растёт выраженность дилатации. В конечном итоге исчерпание возможности расширения коронарного резерва приводит к развитию несоответствия между потребностью М в О2 и его доставкой, что обычно наблюдается при ↓ просвета КА до 70% и >. Постепенное значительное сужение КА и эпизоды ишемии М способствуют раскрытию нефункциональных и образованию новых прекапиллярных анастомозов - коллатералей (между/вокруг КА), обеспечивающих минимальный кровоток для сохранения жизнеспособности скомпрометированного участка М в состоянии покоя. Не предотвращая развития ишемии М или последующего ИМ в условиях повышенной его потребности в О2, коллатерали, тем не менее, способствуют ↓ очагов некроза и улучшению выживаемости больных. Эпикардиальные сегменты КА являются излюбленной локализацией атеросклеротических бляшек, которые крайне редко имеют «кольцевидную форму». В 80% случаев они выстилают лишь одну стенку сосуда, обызвествляются, становятся жёсткими («стабильные» бляшки). Свободная от них стенка сосуда нередко спазмируется, усугубляя ишемию М (преходящий коронароспазм регистрируется в 5% случаев). Спазм КА, тромбообразование в них с ранним спонтанным фибринолизом и преходящие нарушения микроциркуляции приводят к развитию так называемого динамического (неустойчивого), обратимого стеноза КА, которому принадлежит не менее важная роль в патогенезе ИБС, чем органическому. Коронароспазм часто приводит к нарушению микроциркуляции. Критическое сужение просвета субэпикардиальной КА с развитием эпизодов ишемии М может возникать вследствие образования неустойчивых тромбоцитарных агрегатов, подвергающихся спонтанной дезагрегации. Последние ↑ в размерах благодаря тромбоксану A2, синтез которого при стенозе сосуда бляшкой и её спазме ↑. Коронаротромбоз развивается в области относительно небольшого, гемодинамически незначимого (< 50%) стеноза КА, спровоцированного бляшкой с изъязвлённой поверхностью. Важное значение имеет местная активность фибринолитической системы (баланса между тканевыми активаторами плазминогена и его ингибиторами). Если она сохранена, спонтанный тромболизис (в 32 % случаев) и реперфузия наступают быстро, предупреждая развитие необратимой ишемии М и некроза. Факторы риска (ФР) ИБС подразделяют на модифицируемыеи немодифицируемые. К первым относятся ♦ курение, ♦ дислипидемия, ♦ АГ, ♦ нарушения углеводного обмена (толерантности к глюкозе, ИНСД), ♦ абдоминальное ожирение, ♦ употребление алкоголя, ♦ нерациональное питание, ♦ гиподинамия, ♦ низкий социальный и образовательный статус, ♦ психосоциальный стресс. Немодифицируемыми являются ♦ пол (выделяют мужской), ♦ возраст (старше 45 лет у мужчин и 55 лет - у женщин) и ♦ отягощённый наследственный анамнез (раннее начало ИБС у ближайших родственников, ИМ).
Различают следующие виды ИБС. 1) Внeзапная коронарная смерть (ВКС) или первичная остановка сердца (или кровообращения); 2) Стенокардия. 3) ИМ: 4) Кардиосклероз постинфарктный. 5) Нарушения сердечного ритма (могут быть дебютом болезни и одним из осложнений). 6) СН ( ишемическая кардиопатия ). 7) Безболевая («немая») ишемия (проявлений болезни нет, выявляется только при обследовании). 8) Микроваскулярная (дистальная) ИБС. 9) Новые ишемические синдромы («оглушение» М, «гибернация» М, ишемическое повреждение М). Стенокардия или «грудная жаба» – это клиническое проявление транзиторной ишемии М (обратимой КН), которая возникает в результате остро наступающего несоответствия между потребностью М в О2 и его доставкой, характеризующееся в типичных случаях приступообразными болями за грудиной (или в области сердца) сжимающего, давящего (реже иного) характера от терпимых до весьма выраженных, заставляющие пациентов стонать и кричать, испытывать страх близкой смерти, иррадиирующие преимущественно в левую руку, плечо, нижнюю челюсть, под левую лопатку, в эпигастральную область; в атипичных случаях – правую половину туловища, ноги. Является самой распространенной формой ИБС, чаще встречается у мужчин (5-20% против 1-15% у женщин). С возрастом частота резко ↑ .
По международной классификации, принятой ВОЗ (1979) и Всесоюзным кардиологическим научным центром АМН СССР (1984 г. ), выделяют следующие виды СК: 1) СК напряжения; 2) Спонтанную (СК Принцметала, особую, вазоспастическую, вариантную); 3) Безболевую ишемию М и 4) Коронарный синдром Х (микроваскулярную СК). СК напряжения протекает в виде преходящих приступов загрудинных болей, вызываемых эмоциональными или физическими нагрузками, повышающими метаболические потребности М, которые обычно исчезают в покое или купируются приемом нитроглицерина. Она включает: 1. Впервые возникшую; 2. Стабильную; 3. Прогрессирующую (нестабильную) СК. Впервые возникшая - СК продолжительностью до 1 мес. от первого болевого приступа. Может: ·регрессировать, ·перейти в стабильную или ·прогрессирующую СК. Прогрессирующая СК - ↑ тяжести, продолжительности и частоты приступов в ответ на привычную для пациента нагрузку, часто с ↑ ФК и достижением в течение 2 месяцев 3-4 ФК). Стабильная СК – СК продолжительностью свыше 1 мес. По способности переносить ФН подразделяется на функциональные классы (ФК): ФК-I характеризуется отсутствием приступов СК при «Обычной повседневной физической активности» (ходьбе или подъеме по лестнице); приступы возникают при выполнении очень интенсивной, или очень быстрой, или продолжительной ФН. Для ФК- II характерно «Небольшое ограничение обычной физической активности» - возникновение СК в результате быстрой ходьбы на расстояние больше 200 м по ровной местности или быстрого подъема по лестнице, после еды или на холоде, или в ветреную погоду, или под влиянием стресса, или в первые несколько часов после подъема с постели; Для ФК-III характерно «Выраженное ограничение обычной физической активности» – приступ СК возникает в результате ходьбы на расстояние до 100-200 м по ровной местности или при подъеме по лестнице на один пролет в обычном темпе. Для ФК-IV характерна «Невозможность выполнять любой вид физической деятельности без возникновения неприятных ощущений» – приступ СК может возникнуть в покое. Спонтанная - СК, обусловленная локальным спазмом КА при отсутствии явных атеросклеротических поражений. Возникает в покое в одни и те же утренние часы, обычно незадолго до пробуждения больного; боли интенсивные, нередко сопровождаются СА; на ЭКГ в момент болей типичные инфарктоподобные изменения, исчезающие через несколько мин. после прекращения приступа - преходящий подъемом сегмента ST; боли иногда появляются на фоне выполнения ФН, которая в другое время хорошо переносится (так называемый вариабельный порог возникновения СК), возникают после ФН, выполняемой в утренние часы, но не в дневное и вечернее время. Эпизоды безболевой (немой) ишемии М обычно диагностируют во время проб с ФН и при суточном мониторинге ЭКГ, а также при плановых регистрациях ЭКГ. Безболевая ишемия М подразделяется на: ·I тип - изменения ишемического типа, выявляемые при ФН или суточном мониторировании ЭКГ у лиц с отсутствием болевого синдрома. ·II тип - безболевая ишемия, регистрируемая у больных, имеющих приступы СК. ·III тип - безболевая ишемия у пациентов с отсутствием СК после перенесенного ИМ. Синдром Х (микроваскулярная СК) - типичные приступы СК напряжения и/или изменения ЭКГ ишемического типа при ФН у больных с неизмененными по данным коронарографии магистральными КА, у лиц с отсутствием признаков спазма КА, АГ и СД. Прогрессирующая, постинфарктная, некоторые варианты спонтанной и впервые возникшей СК объединяются в понятие « нестабильная СК». Характеризуется нарастающими по частоте, длительности и тяжести эпизодами СК (нередко даже в покое), которые пролонгированы во времени и часто завершаются ИМ, в связи с чем их называют прединфарктными состояниями. Ранняя постинфарктная СК – появление ангинозных приступов в сроки от 24 часов до двух недель после перенесенного ИМ (критерии NYHA). В отечественной кардиологии традиционно используется более продолжительный временной интервал - от 3-х суток до 4-х недель (по 28-й день включительно) от начала ИМ. «Оглушение» М - это состояние постишемической локальной дисфункции М, которое сохраняется на протяжении нескольких часов или дней после наступления РП, несмотря на отсутствие необратимых изменений в М и восстановление коронарного кровотока (В. И. Маколкин, 2000). «Оглушение» М может наблюдаться при тяжелом приступе СК, остром ИМ (после успешно проведенного тромболизиса и восстановления КК), после баллонной ангиопластики КА, при нестабильной СК. Гибернирующий («спящий») М - это локальное ↓ сократительной способности М ЛЖ, вызванное его длительной гипоперфузией, которое полностью (или частично) ликвидируется после улучшения КК или ↓ потребности М в О2 (В. И. Маколкин, 2001). Продолжительность состояния гибернации от нескольких дней до нескольких мес. и даже лет. Гибернация М может развиваться при стабильной и нестабильной СК, безболевой ишемии М, хронической НК, у больных после перенесенного ИМ (внутри и вокруг постинфарктного повреждения М). Диагноз СК выставляется на основании типичной клинической картины, подробного анализа болевого синдрома. Боль при СК чаще возникает в момент ходьбы, подъема по лестнице, усилия, стресса, может возникать в ночные часы. Приступ продолжается от 1 до 15-20 мин. (2-5 мин. ). Факторами, облегчающими приступ СК, являются прием нитроглицерина, положение стоя или сидя. Приступы СК в покое – те же характеристики, за исключением связи с ФН, но более длительные (до 20 мин. ), эффект нитроглицерина менее выражен. Во время приступа пациент испытывает нехватку воздуха, старается остановиться и замереть, прижимает руку к груди, бледнеет; лицо принимает страдальческое выражение, верхние конечности холодеют и немеют. Ишемические изменения ЭКГ в момент приступа ( депрессия сегмента ST, инверсия зубца Т в грудных отведениях, элевация ST, нарушения проводимости и ритма) исчезают сразу после купирования болей. Лабораторная диагностика включает исследование в крови общего холестерина, АСТ, АЛТ, ЛПНП, ЛПВП, триглицеридов, ЛДГ, глюкозы, коагулограммы и электролитов крови, кардиальных тропонинов I и Т - маркеров, свидетельствующих об ИМ.
К болевым формам ИБС относят СК, острую КН и ИМ. Механизм болей определяется: ·Степенью повреждения тканей и уровнем освобождения основных медиаторов боли (серотонина, гистамина, брадикинина и др. ). ·Индивидуальной чувствительностью специфических болевых рецепторов, которая регулируется содержанием Пr, ионов К и Н. ·Содержанием в н. с. эндогенных опиоидов, препятствующих высвобождению субстанции Р и проведению болевых импульсов к коре головного мозга (затылочную центральную извилину). ·Наличием или отсутствием нарушений нервной афферентной проводимости. М имеет обильную афферентную иннервацию. Большое количество окончаний немиелизированных нервов расположены в М между миофибриллами и вокруг мелких КА. Афферентные импульсы от рецепторов по чувствительным волокнам в составе указанных нервов поступают к соответствующим симпатическим ганглиям, далее в корково-подкорковые структуры ЦНС (гипоталамус и др. ). Наличие и выраженность болевого синдрома при ИБС определяются порогом восприятия болевых ощущений. У пожилых лиц и больных СД на фоне изменений периферических нервов, дисфункции автономной н. с. (АНТ), изменений ряда структур центральной н. с., способность воспринимать болевые ощущения снижена (порог ↑ ), вследствие чего нередко наблюдается безболевая (немая) ишемия. Не менее существенными в возникновении болей являются и особенности изменений метаболизма М в зоне ишемии. Наиболее значимыми из них являются ацидоз, ↓ парциального напряжения О2, ↑ концентрации внеклеточного К+ из-за потери его кардиомиоцитами, ↑ в зоне ишемии концентрации аденозина, серотонина, гистамина, брадикинина и др. Изменение концентрации этих соединений, равно как и ↓ рН, могут восприниматься хеморецепторами М и трансформироваться в болевые ощущения. Локализация и иррадиация болей обусловлены передачей импульсов, поступающих от афферентных рецепторов на эфферентные нервы, отходящие от тех же самых сегментов спинного мозга и иннервирующие соответствующие дерматомы. Иррадиация боли обусловлена ее распространением от сердца к VII шейному и I—V грудным сегментам спинного мозга и далее по центробежным нервам к иннервируемым зонам. У большинства больных со СК напряжения, в условиях постоянной фиксированной обструкции (сужения) КА в покое КА обеспечивают адекватную перфузию М, несмотря на наличие сужения, а болевые ощущения возникают лишь при ФН , что связано с ↑ работы М и неспособностью атеросклеротически измененного участка КА к адекватной вазодилатации. Патогенез СК, возникающей в покое на фоне э моционального напряжения особо не отличается от СК напряжения. В ее основе лежит ↑ работы сердца из-за ↑ АД, ↑ ЧСС и неблагоприятного влияния КхА на метаболизмМ – ведь в условиях фиксированной коронарной обструкции перфузия участка М, кровоснабжаемого измененной КА, существенно не возрастает. Но у большинства больных со СК покоя болевые ощущения возникают вне связи с эмоциональным напряжением, чаще ночью. У части из них развитию ишемии предшествует резкое ↓ АД с одновременным ↓ ЧСС, которые по всей видимости в условиях фиксированной коронарной обструкции обусловливают гипоперфузию участка М, кровоснабжаемого измененной КА. Фиксированная коронарная обструкция определяет появление болевых ощущений еще у одной группы больных со СК покоя, возникающей во время сна . В этих случаях развитию эпизодов ишемии предшествует ↑ ЧСС, ↑ АД, а при регистрации движения глазных яблок отмечается ↑ их двигательной активности (т. е ↑ работа сердца). В то же время имеется достаточно большая группа больных СК покоя с фиксированной коронарной обструкцией, у которых болевые ощущенияне связаны с ↑ работы сердца, что подтверждается отсутствием у них существенных изменений ЧСС и АД, перед появлением ишемических изменений на ЭКГ. В основе ишемии у пациентов этой группы лежит временное ухудшение КК при постоянной работе сердца - так называемая динамическая обструкция, чаще обусловленной локальным спазмом КА в месте АБ (вазоспастическая СК). Степень спазма может быть от полного прекращения КК в месте сужения до минимальных изменений просвета КА в области локализации бляшки. В редких случаях спазм КА не ограничивается местом локализации АБ, а вовлекает ту или иную крупную ветвь КА. К механизмам, определяющим развитие вазоспазма, относятся изменения нейрогенной регуляции, функционального состояния Тr в местах атеросклеротического сужения (временная агрегация с освобождением тромбоксана), функционального состояния эндотелия (дисбаланс между концентрацией эндотелина и релаксирующего фактора), изменения локальной концентрации соединений, влияющих на тонус КА (АТ-II, брадикинин, серотонин и др. ). Существует еще одна форма СК, патогенез которой до настоящего времени до конца не выяснен, - так называемый коронарный синдром-Х. Его особенностью является возникновение типичных ангинозных приступов у больных с интактными КА ( по данным коронарографии). Предполагается, что возникновение СК у них обусловлено временными нарушениями кровообращения на уровне микроциркуляции. Под острой КН (острой очаговой дистрофией М или промежуточным коронарным синдромом ) понимают болевой синдром, обусловленный ишемией М, продолжающийся около 30 мин. и сопровождающийся изменениями ЭКГ (депрессия или подъем сегмента ST), которые исчезают через сутки после болевого приступа. По патогенезу и клиническим проявлениям она занимает промежуточное положение между СК и ИМ. В ее развитии могут иметь значение как вазоспазм, так и временное прекращение КК из-за своеобразных микроэмболий циркулирующими в крови тромбоцитарными агрегатами. Внезапная сердечная смерть (ВСС) определяется как смерть, которая развивается неожиданно, внезапно, в течение одного часа с момента появления признаков заболевания М у здоровых лиц, либо у пациентов с патологией сердца, не имевших до этого опасных для жизни симптомов. ВСС может наступать практически при любом заболевании сердца. Но чаще всего она наблюдается у пациентов с ИБС. В этом случае ВСС может рассматриваться как внезапная коронарная смерть (ВКС). У большинства лиц ВСС возникает в покое, во время сна или при минимальной ФН, и только у 1/3 пациентов - во время физической работы. Непосредственными причинами ВКС являются: ♦ фибрилляция желудочков ( 85%); ♦ асистолия; ♦ электромеханическая диссоциация. Главным механизмом развития электромеханической диссоциации является выраженное нарушение систолической и диастолической функции ЛЖ. Развитие ацидоза, ↓ в М АТФ и КФ, а также нарушение внутриклеточного обмена Са2+ имеют непосредственное отношение к возникновению электромеханической диссоциации, которая чаще развивается при нижних ИМ, и ее развитию может предшествовать резкое ↑ парасимпатического тонуса.
IV. Термин инфаркт означает омертвение (некроз) ткани, которое может возникнуть в любом органе. Некроз всегда сопровождается воспалением, в исходе которого образуется соединительная ткань с уплотнением пораженного органа (отсюда и происхождение термина«инфаркт» от лат. infarcio – набиваю). Различают инфаркты ( ишемические (чаще) и геморрагические. В обыденной жизни под «инфарктом» подразумевается омертвение мышечной ткани сердца. Согласно МКБ-10 ИМ - это самостоятельное заболевание, имеющее свой код (I21). В тоже время, большинство клиницистов и исследователей рассматривают его как одну из клинических форм ИБС. ИМ - это ТФП КН, которая представляет собой очаговый некроз М в результате острого и значительного дисбаланса между потребностью его в O2, субстратах метаболизма и их абсолютно или относительно недостаточной доставкой. Впервые был описан в 1910 году В. П. Образцовым. В наши дни ИМ является одной из наиболее частых причин смерти. Он расценивается как неотложное состояние и служит показанием к экстренной госпитализации в кардиологическую реанимацию. Встречается у 300 - 500 человек на 100000 населения в год (0, 5% или один из 200 человек), у мужчин в 4 - 5 раз чаще (в связи с более ранним развитием атеросклероза). Несмотря на то, что ИМ постепенно «молодеет», он все еще чаще развивается после 50 - 60 лет. Показатель летальности при ИМ составляет 30-35%! Чаще развивается ИМ ЛЖ, потому что его стенка толще, чем в остальной части сердца, подвергается наибольшим нагрузкам и требует большего кровоснабжения. Изолированные инфаркты предсердий (П) и правого желудочка (ПЖ) встречаются значительно реже. Обычно они возникают одновременно с ИМ ЛЖ, когда ишемия переходит с ЛЖ на ПЖ или на П. ИМ классификацируют по следующим критериям. I. По анатомии поражения: 1) Трансмуральный; 2) Интрамуральный; 3) Субэндокардиальный; 4) Субэпикардиальный. II. По объёму поражения: 1) Крупноочаговый (трансмуральный) или Q-инфаркт с формированием патологического зубца Q, иногда желудочкового комплекса QS; 2) Мелкоочаговый, не Q-инфаркт (не сопровождается появлением зубца Q, проявляется отрицательными Т-зубцами). На долю мелкоочаговых ИМ приходится около 20% клинических случаев, однако мелкие очаги некроза в сердечной мышце могут трансформироваться в крупноочаговый ИМ (у 30% пациентов). В отличие от крупноочаговых, при мелкоочаговых ИМ не возникают аневризма и разрыв сердца, течение реже осложняется СН, фибрилляцией Ж, тромбоэмболией. III. По локализации очага некроза: 1) ИМ ЛЖ (передний, боковой, задний, нижний); 2) Изолированный ИМ верхушки сердца или верхушечный ; 3) ИМ межжелудочковой перегородки (септальный или перегородочный ); 4) ИМ ПЖ; 5) Сочетанные локализации: переднеперегородочный ; передневерхушечный; переднебоковой; распространенный передний; заднедиафрагмальный; заднебоковой; заднебазальный; распространенный задний и др. IV. По течению: 1) ИМ моноциклический; 2) Затяжной (появление новых очагов некроза либо расширение существующего в течение 2 - 3 дней после начала приступа); 3) Рецидивирующий (формирование новых очагов некроза в бассейне той же КА, подтвержденных клинически, ЭКГ или положительными биомаркерами в пределах 4-х недель текущего ИМ); 4) Повторный - новый очаг некроза через 28 дней от предыдущего ИМ в бассейне другой КА. V. По развитию осложнений: 1) О сложненный и 2) Неосложненный. VI. По клинической классификации, подготовленной объединённой рабочей группой Европейского общества кардиологов, Американского кардиологического колледжа, Американской ассоциации сердца и Всемирной кардиологической федерации (2007), выделяют: 1) Спонтанный ИМ или тип 1, связанный с ишемией, развивающейся вследствие первичного коронарного события - эрозии бляшки, разрушения, растрескивания или расслоения сосуда; 2) Вторичный ИМ ( тип 2 ), связанный с ишемией, вызванной ↑ потребности в О2 либо ↓ его поступления (напр., при коронароспазме, эмболии КА, анемии, аритмии, гипер- или гипотензии); 3) ВКС ( тип 3 ), включая остановку сердца, часто с симптомами, указывающими на ишемию М, сопровождающимися предположительно новой элевацией ST и новой блокадой левой ножки пучка Гиса, выявлением свежего тромба КА при ангиографии и/или вскрытии, наступившей смертью до получения образцов крови или перед ↑ концентрации маркеров; 4) Связанный с чрескожным коронарным вмешательством ( тип 4а ); 5) Связанный с тромбозом стента ( тип 4б ), который подтверждён ангиографией или посмертно; 6) Связанный с АКШ ( тип 5 ). Иногда у пациентов может возникать несколько типов ИМ одновременно или последовательно. Этиология. ИМ развивается в результате обтурации просвета одной из КА. Причинами могут стать (по частоте встречаемости): 1) Атеросклероз КА (тромбоз, обтурация бляшкой) в 93-96% случаев; 2) Хирургическая обтурация (перевязка артерии или диссекция при ангиопластике); 3) Эмболизация КА (тромбоз при коагулопатии, жировая эмболия и т. д. ); 4) Спазм КА; 5) Отдельно выделяют ИМ при пороках сердца (аномальное отхождение КА от аорты). ФР ИМ являются: ♦ Табакокурение и пассивное курение; ♦ АГ; ♦ Ревмокардит; ♦ Перенесённые стафилококковые и стрептококковые инфекции; ♦ ↑ ЛПНП в крови; ♦ ↓ ЛПВП в крови; ♦ ↑ уровень триглицеридов в крови; ♦ Гиподинамия; ♦ Возраст; ♦ Загрязнение атмосферы; ♦ Пол (мужчины страдают чаще); ♦ Ожирение; ♦ Алкоголизм; ♦ СД; ♦ Стресс; ♦ ИМ в прошлом и манифестация любых других проявлений атеросклероза; ♦ Воспалительные заболевания кишечника (в частности болезнь Крона и язвенный колит. Патогенез. ИМ в своем развитии проходит 4 стадии: 1. Ишемии; 2. Повреждения (некробиоза); 3. Некроза; 4. Рубцевания . Считается, что ишемия продолжительностью 20 минут уже приводит к первым признакам гибели КМ. В основе процесса - нарушение гемодинамики М. Обычно клинически значимым считается сужение просвета КА до такой степени, когда ограничение кровоснабжения М не может быть компенсировано. Чаще всего это происходит при сужении артерии на 70% площади её сечения. При исчерпывании компенсаторных механизмов идет повреждение клеток М (вначале обратимого характера), нарушение их метаболизма и функций. Стадия повреждения длится от 4 до 7 часов. Некроз характеризуется необратимостью повреждения. Через 1-2 недели после ИМ некротический участок начинает замещаться рубцовой тканью. Окончательное формирование рубца происходит через 2 месяца. Принято считать, что основой развития ИМ является патофизиологическая триада, включающая разрыв АБ, тромбоз и вазоконстрикцию. При полном внезапном закрытии просвета КА тромбом при отсутствии достаточного развития КК развивается трансмуральный ИМ - некроз всей толщи мышцы от эндокарда к эпикарду, который однороден по сроку развития. При интермиттирующей окклюзии КА и существовавших ранее коллатералей формируется нетрасмуральный ИМ, при этом некроз чаще всего располагается в субэндокардиальных отделах или интрамурально, в толще М, может быть однородным и неоднородным по сроку развития. Локализация ИМ обычно соответствует бассейну пораженной (так называемой, « инфаркт-связанной») КА. Наиболее часто «страдает» передняя межжелудочковая артерия, поэтому ИМ передней стенки и верхушки занимает 1-е место в структуре заболевания ( высок риск образования аневризмы ). Развитию тромбоза КА предшествует разрыв АБ или ее эрозия. Надрыву и разрыву бляшки способствуют накопление в ней ЛПНП и их окисление, значительное давление тока крови на края бляшки, курение, выраженное ↑ АД, интенсивная ФН. Далее запускается процесс внутрикоронарного тромбообразования, который течет по всем законам внутрисосудистого гемостаза с активацией тромбоцитарных и плазменных факторов свертывания. Выделяют следующие этапы поражения М при инфаркте: между здоровым и некротизированным М в электрокардиографии выделяют промежуточные стадии: ишемию и повреждение. 1) Ишемия - это начальное поражение М, при котором микроскопически видимых изменений в сердечной мышце еще не наступило, а функция уже частично нарушена . Как известно, в N на клеточных мембранах нервных и мышечных клеток последовательно происходят два противоположных процесса: деполяризация (возбуждение) и реполяризация( восстановление разности потенциалов). Деполяризация (Д) - процесс физиологически несложный, реализуется посредством открытия в мембране клетки ионных каналов, по которым (из-за разницы концентраций вне и внутри клетки) устремляются ионы. Р еполяризация (Р) в отличие от Д, процесс энергоемкий, требующий затрат энергии в форме АТФ, для синтеза которого постоянно требуется О2. Поэтому при ишемии М в 1-ю очередь нарушается процессР, что проявляется изменениями зубца T .

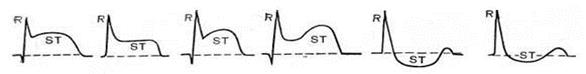
Варианты изменений зубца T при ишемии Рис. 3
а - норма, б - отрицательный симметричный «коронарный» зубец T (при ИМ), в - высокий положительный симметричный «коронарный» зубец T (при ИМ и ряде др. заболеваний), г, д - двухфазный зубец T, е - сниженный зубец T (амплитуда меньше 1/10-1/8 зубца R), ж - сглаженный зубец T, з - слабо отрицательный зубец T.
При ишемии М комплекс QRS и сегменты ST остаются в N, а зубец T претерпевает изменения: он расширенный, симметричный, равносторонний, ↑ по амплитуде (размаху) и имеет заостренную вершину. При этом зубец T может быть, как положительным, так и отрицательным (зависит от расположения очага ишемии в толще стенки сердца, а также направления выбранного ЭКГ-отведения). Ишемия - процесс обратимый, со временем метаболизм восстанавливается до N или продолжает ухудшаться с переходом в стадию повреждения. 2) Повреждение - это более глубокое поражение М, при котором под микроскопом определяются↑ числа вакуолей, набухание и дистрофия мышечных волокон, нарушение структуры мембран, функции митохондрий, ацидоз и т. д. Нарушается процесс как Д, так и Р. Считается, что повреждение влияет в первую очередь на сегмент ST. Сегмент ST может смещаться выше или ниже изолинии, но его дуга (!!! ) при повреждении обращена выпуклостью в сторону смещения, что отличает ее от многих других состояний, при которых дуга направлена к изолинии (гипертрофия Ж, блокада ножек пучка Гиса и др. ).
Варианты смещения сегмента ST при повреждении Рис. 4.
Зубец T при повреждении может быть разной формы и размеров, что зависит от выраженности сопутствующей ишемии. Повреждение тоже не может существовать долго и переходит в некроз. 3) Некроз - гибель КМ. «Погибший миокард» не способен к Д, поэтому мертвые клетки не могут формировать зубец R в желудочковом комплексе QRS. По этой причине при трансмуральном ИМ (гибель М на некотором участке по всей толщине сердечной стенки) в этом ЭКГ-отведении зубца R вообще нет и формируется желудочковый комплекс типа QS. Если некроз затронул только часть стенки М, формируется комплекс типа QrS , в котором зубец R уменьшен, а зубец Q ↑ по сравнению с N. В N зубцы Q и R должны подчиняться ряду правил: ♦ зубец Q должен всегда присутствовать в V4-V6; ♦ ширина зубца Q не должна превышать 0. 03 с, а его амплитуда превышает 25% (1/4) от амплитуды соседнего зубца R в том же отведении - 1/4 амплитуды зубца R в этом отведении; ♦ зубец R должен нарастать по амплитуде с V1 по V4( т. е. в каждом последующем отведении с V1 по V4 зубец R должен выть выше, чем в предыдущем); ♦ В V1 зубец r в N может отсутствовать , тогда желудочковый комплекс имеет вид QS. ♦ У людей до 30 лет комплекс QS в N изредка может быть в V1-V2, а у детей - даже в V1-V3, хотя это всегда подозрительно – может быть ИМ передней части межжелудочковой перегородки . Н а ЭКГ некроз в сердечной мышце сопровождается изменениями зубца Q и влияет на весь желудочковый комплекс QRS, п овреждение отражается на сегменте ST, а ишемиязатрагивает зубец T. В клиническом течении ИМ выделяют 5 периодов (или этапов, стадий): 1 период - предынфарктный (продромальный); 2-й – острейший (до 6 часов от начала ИМ); 3-й – острый (от 7 часов до 7-14 дней, чаще всего 8 - 10); 4-й – подострый (до 2 месяцев); 5-й – постинфарктный (более 2 месяцев). Чаще всего предынфарктный период определяется уже после того, как произошел собственно ИМ. Период фактически совпадает по проявлениям и симптомам с нестабильной СК. Боли за грудиной усиливаются, учащаются по сравнению с прошлым состоянием пациента либо возникают впервые (впервые возникшая СК). Во всех этих случаях имеет место ухудшающееся кровоснабжение М, которое в любой момент может перейти в некроз с развитием ИМ. На данном этапе может появиться ряд незначительных симптомов-предвестников (слабый цианоз губ и ногтей, сбивчивый пульс на запястьях, гиперчувствительность кожи на груди, тупые боли и дискомфорт за грудиной при стенокардии, которая затем переходит в инфаркт), которым зачастую не придают значения. Однако их появление необязательно, болезнь может начаться сразу с острейшей стадии. Длительность периода может составлять от нескольких часов до нескольких дней. Диагностировать именно предынфарктный синдром в этот период времени очень трудно. Поэтому многие специалисты рассматривают продромальный период как условный и необязательный. Острейшим называют период от начала развития ишемии до появления очага некроза в М. Чаще всего данный период наступает под воздействием каких-либо провоцирующих факторов. Из проявлений наиболее характерен чрезвычайной интенсивности болевой синдром с локализацией болей в грудной клетке и иррадиацией в левое плечо, шею, зубы, ухо, ключицу, нижнюю челюсть, межлопаточную зону. Характер болей может быть сжимающим, распирающим, жгучим, давящим, острым («кинжальным»). Чем больше зона поражения М, тем интенсивнее боль. Болевой приступ протекает волнообразно (то усиливаясь, то ослабевая), продолжается от 30 минут до нескольких часов не купируется повторным приемом нитроглицерина. Боль сопряжена с резкой слабостью (больной буквально не стоит на ногах из-за резкого ↓ АД), возбуждением, чувством страха смерти, одышкой, тахикардией, усилением потоотделения. Может развиться острая левожелудочковая СН (сердечная астма, отек легких). Клинические проявления и характер гемодинамических нарушений при ИМ зависят от размеров некротизированного участка М и состояния интактных отделов М. Определенный вклад в особенности клиники и гемодинамики может вносить вторичная активация САС, РАА и др. систем, имеющих отношение к регуляции гемодинамики. Для больных ИМ, особенно в первые часы после возникновения болевого синдрома, характерны высокие концентрации в крови многих БАВ. Наиболее неблагоприятное действие на КМ оказывают высокие концентрации КхА. Под их влиянием резко ↑ процессы окислительного фосфорилирования в митохондриях и сократимость М, ↑ ЧСС, ↑ потребность М в О2. Кроме того, КхА усиливают липолиз, что ↑ уровень свободных жирных кислот (СЖК) в крови. Окисление СЖК в КМ также сопряжено с ↑ потребности М в О2. Гиперкатехоламинемией в значительной мере объясняются отмечаемые у многих больных в первые часы после возникновения ИМ гипердинамические изменения кровообращения. Наконец, КхА оказывают неблагоприятное влияние на Тr (стимуляция реакций освобождения) и повышают тонус КА. Итогом всех этих нарушений является почти обязательное развитие при ИМ нарушений ритма и КхА. Развитие СН в ранние сроки после возникновения ИМ обусловлено выключением из сократительной активности некротизированного участка М. Фракция изгнания ↓ уже у пациентов с некрозом, вовлекающим около 10% М ЛЖ, а при повреждении 25% массы М возникают клинические проявления СН. ↓ фракции изгнания приводит к ↑ конечно-диастолического V ЛЖ. Фактически сердце больного ИМ работает в условиях остро возникшей перегрузки объемом, и компенсация нарушенной насосной функции осуществляется интактными отделами М (аварийная стадия СН по Ф. З. Меерсону). В этих условиях развивается как систолическая, так и диастолическая дисфункция М. Систолическая дисфункция М, как уже указывалось, обусловлена нарушениями сократительной активности некротизированной зоны М, перегрузкой интактных отделов М и изменениями формы (геометрии) полости ЛЖ, что приводит к асинхронизму сокращений различных участков М и ↓ эффективности сокращения из-за неспособности полости желудочка принимать сферическую форму во время систолы. Перерастяжение саркомеров, согласно закону Франка - Старлинга, должно приводить к усилению их сократительной активности. Однако даже в интактных отделах М при остром ИМ, действие закона Франка-Старлинга нарушено. Это связано с тем, что саркомеры в периинфарктной зоне, испытывающие максимальное напряжение, оказываются чрезмерно перерастянутыми. Результатом чрезмерного перерастяжения даже интактных саркомеров является ↓ их способности к сокращению. Кроме того, ИМ нередко развивается у больных с распространенным коронарным атеросклерозом с уже предшествовавшими изменениями М. Эти же причины лежат в основе диастолической дисфункции М, что проявляется не только отсутствием активной релаксации инфарцированной зоны, но и недостаточным диастолическим расслаблением интактных отделов М. Нарушение диастолического расслабления интактных отделов М связывают, с отсутствием должного уменьшения концентрации Сa2+ в цитоплазме КМ из-за отсутствия адекватного энергообеспечения процесса обратного его поступления в эндоплазматический ретикулум в результате дефицита АТФ. Резкие нарушения сократительной функции М лежат в основе таких тяжелых осложнений острого ИМ, как отек легких и кардиогенный шок. Возможно атипичное течение острейшего периода ИМ, которое значительно затруднеют диагнистику ИМ. Атипичные формы ИМ чаще встречаются у пожилых пациентов с выраженными признаками кардиосклероза, НК, на фоне повторного ИМ. Атипично протекает только острейший период, а все дальнейшее развитие ИМ становится типичным. Различают следующие атипичные формы ИМ: 1. Атипичный болевой синдром или периферическая форма ИМ - отличается локализацией боли не в загрудинной или прекардиальной области, а в области горла, левого уха, шеи, пальцев левой руки, левой лопатки или шейно-грудного отдела позвоночника, эпигастрия, нижней челюсти. 2) Абдоминальная (гастралгическая) форма чаще наблюдается при диафрагмальном (заднем) ИМ и проявляется интенсивными болями в эпигастральной области, иногда в области правого подреберья. Боли часто сопровождаются тошнотой, рвотой, диарей. Иногда может быть желудочно-кишечное кровотечение, обусловленное развитием острых (стрессорных) язв слизистой желудка и кишечника. При пальпации живота может быть болезненность в эпигастральной области, местные признаки раздражения брюшины. Поэтому всем больным с диагнозом «острый живот» необходимо выполнять ЭКГ. 3) Астматическая форма характеризуется внезапным появлением у больного резко выраженного приступа удушья, кашлем с выделением пенистой розовой мокроты, холодным потом, акроцианозом. В легких выслушиваются влажные хрипы. Эти проявления соответствуют сердечной астме и обусловлены быстрым развитием острой левожелудочковой СН. Боли в области сердца при этом могут быть выражены слабо. Чаще этот вариант ИМ встречается у пожилых пациентов, при повторных ИМ, при обширном трансмуральном поражении, инфаркте сосочковых мышц, когда развивается острая недостаточность митрального клапана. 4) Коллаптоидная форма начинается с развития коллапса; в клинике доминируют резкая внезапная артериальная гипотензия, головокружение, появление холодного пота, потемнение в глазах; расценивается как проявление кардиогенного шока; Сходные проявления наблюдаются при шоковых состояниях, вызванных др. причинами (гиповолемический шок при кровотечениях, анафилактический шок и др. ). 5) Церебральная форма проявляется головокружениями, нарушениями сознания, неврологическими симптомами, на первый план в клинической картине выступают симптомы ишемии мозга. Развивается эта форма чаще у пожилых лиц с выраженным атеросклерозом мозговых артерий. Следует взять за правило: при любом внезапно появившемся виде церебральных нарушений необходимо провести ЭКГ-исследование. 6) Аритмическая форма проявляется нарушениями ритма и проводимости (синоатриальные и атриовентрикулярные блокады, наджелудочковые и желудочковые тахикардии), нередко приводящие к синкопальным состояниям или остановке кровообращения. 7) Безболевая ишемия М (встречается редко) начинается общей слабостью. Такое развитие ИМ характерно для больных ИМ + СД (боль отсутствует из-за нарушения чувствительности). 8) Отёчная форма проявляется одышкой, слабостью, сравнительно быстрым формированием отеков (и даже асцита), ↑ печени (признаками острой правожелудочковой СН). 9) Стертая форма характеризуется отсутствием ярких симптомов, клиническая картина заболевания неотчетливая; Боль в груди напоминает скорее дискомфорт, слабость умеренная и быстро проходит, усиленному потоотделению (также короткому) пациент не придает большого значения. Может расцениваться пациентом (да и многими врачами) как отсутствие какой-либо патологии. Диагноз подтверждается лишь ЭКГ или др. инструментальными исследованиями. 10) Комбинированная форма- сочетает различные проявления нескольких атипичных форм. Нередко больные ИМ из-за атипичного течения госпитализируются только через несколько суток после развития заболевания, посетив предварительно стоматолога, невропатолога, ЛОР врача, а иногда успевают получить неадекватное лечение, к примеру, физиотерапевтические процедуры по поводу «обострения остеохондроза». Острым называют период от образования некроза до миомаляции (ферментативного расплавления некротизированной мышечной ткани). В этот промежуток времени окончательно формируется очаг, содержащий погибшие КМ. Сердце в пораженной области размягчается, КМ разрушаются. В результате некроза, миомаляции и перифокального воспаления развивается лихорадка (от 3-5 до 10 и более дней). Всасывание некротических масс в кровоток вызывает резорбционно-некротический синдром ( ↑ t C тела, лейкоцитоз, ↑ СОЭ, появление «биохимических признаков воспаления»). Это своеобразная интоксикация организма продуктами распада погибших КМ. Длительность и высота подъема t C при лихорадке зависят от площади некроза. В остром периоде болевой синдром, как правило, исчезает. Сохранение болей бывает вызвано выраженной степенью ишемии околоинфарктной зоны или присоединением перикардита. Артериальная гипотензия и признаки СН сохраняются и нарастают. В подостром периоде наблюдаются начальные процессы организации рубца, происходит развитие грануляционной ткани (на месте погибших КМ), которая впоследствии превращается в соединительную (рубцовую). Длительность периода во многом зависит от того, как протекает период восстановления. При неосложненном течении болезни он занимает 6 - 8 недель. В этот срок образуется и набирает прочность соединительнотканный рубец. Для пациентов, перенесших ИМ, данный период означает ↓ риска. Дело в том, что наиболее серьезные и опасные осложнения, которые часто заканчиваются смертью пациента, случаются именно на острой или острейшей стадии. При диагностическом обследовании нормализуются многие показатели, исчезают признаки резорбционно-некротического синдрома. При появлении новых участков ишемии возможен рецидив боли, однако чаще всего она отсутствует. ТК исчезает, гипотензия может еще сохраняться. Иногда (если пациент и до инфаркта страдал ГБ) АД ↑ вновь. Постинфарктный период называется периодом постинфарктного кардиосклероза (более 2 мес. ). Это период окончательного созревания постинфарктного рубца, адаптации М к новым условиям функционирования. Длится, фактически, до конца жизни (рубец не может трансформироваться обратно в мышцу). При этом выделяют ранний постинфарктный период (до полугода) и отдаленный (более полугода). У большинства пациентов симптомы к этому времени уже проходят.
Каждая из стадий ИМ имеет характерные только для нее особенности на ЭКГ. 1) В предынфарктном периодена ЭКГ отмечается: ♦ ↓ сегмента ST более чем на 1 мм ниже изолинии (реже смещение кверху); ♦ Появление «коронарного» отрицательного зубца Т. ♦ Отсутствие патологического зубца Q (так как некроз еще не наступил). Фаза ишемии длится всего лишь 15-30 минут. Н а ЭКГ видны высокие положительные симметричные «коронарные» зубцы T, характерные для субэндокардиальной ишемии. Именно под эндокардом находится самая уязвимая часть М сердечной стенки, поскольку в полости сердца повышенное Р, которое мешает кровоснабжению М («выдавливает» кровь из КА назад). Острейший период ИМ (до 6 часов), в основном, характеризуется ишемией М, появлением признаков повреждения. В первые 15 - 30 минут от начала приступа некроза КМ еще нет. Однако ишемия приводит к ♦ ↑ амплитуды и заострению зубца Т. После этого идет расширение зоны ишемии, которое характеризуется ♦ смещением интервала ST книзу от изолинии. По мере распространения зоны некроза (когда ИМ становится трансмуральным) ♦ сегмент ST поднимается кверху от изолинии, ♦ куполообразно выпячивается и иногда ♦ сливается с зубцом Т. ♦ После формирования зоны некроза уже в этой стадии может появиться ♦ патологический невысокий зубец Q (или QS). Основные ЭКГ-признаки: ♦ Куполообразный сегмент ST выше изолинии; ♦ Сегмент ST сливается с зубцом T; ♦ Зубец R высокий; ♦ Зубец Q невысокий. Наиболее характерным является (для трансмурального ИМ) формирование так называемой монофазной кривой (или кривой в виде «кошачьей спинки» ), которая включает подъем сегмента ST и высокий положительный зубец T ( сливаются воедино). Некроз и соответствующий ему зубец Q может начать формироваться, но его может и не быть. Если зубец Q формируется, то высота зубца R в этом отведении ↓, нередко вплоть до полного исчезновения (комплекс QS при транcмуральном ИМ). Смещение сегмента ST выше изолинии на 4 мм и выше хотя бы в одном из 12 обычных отведений говорит о серьезности поражения сердца. 2) Острая стадия длится от 7 часов до 7-14 дней. Зоны ишемии и повреждения начинают ↓ . Зона некроза уже сформировалась, может нарастать. Поэтому на ЭКГ расширяется и ↑ по амплитуде зубец Q (трансмуральный Q-инфаркт). Если зубец Q отсутствовал на ЭКГ в острейшей стадии, то он формируется в острую. Могут встречаться ИМ и без зубца Q ( субэндокардиальные, с лучшим прогнозом), при которых зона некроза располагается под эндокардом и не приближается к эпикарду, зубец Q в этом случае не формируется. Сегмент ST из-за ограничения зоны повреждения начинает постепенно приближаться к изолинии, а зубец T становится отрицательным симметричным «коронарным» из-за формирования зоны трансмуральной ишемии вокруг зоны повреждения. В острой стадии присутствуют все зоны поражения, поэтому на ЭКГ видны патологический зубец Q и комплекс QS, отражающие наличие некроза (углубление зубца Q), ↓ амплитуды зубца R, элевация (от англ. elevation - подъем) сегмента ST (обычно остается куполообразно поднятым над изолинией), начальное формирование зубца T (зубец T отрицательный). 3)В подострой стадии ИМ ЭКГ формируется под влиянием зоны некроза и зоны ишемии: ♦ Сохраняется патологический зубец Q или QS, так как зона некроза все еще присутствует. ♦ Сегмент ST возвращается на уровень изолинии. ♦ Зубец Т обычно отрицательный, но постепенно ♦ его глубина ↓. Когда амплитуда зубца Т перестает изменяться (что видно из повторных данных ЭКГ), подострую стадию считают завершившейся. Подострая стадия длится при неосложненном течении болезни до 6 - 8 недель, изредка дольше (3 мес). Зона повреждения исчезает за счет перехода в зону ишемии (поэтому сегмент ST вплотную приближается к изолинии), зона некроза стабилизируется (поэтому об истинном размере ИМ судят именно в эту стадию). В первую половину подострой стадии из-за расширения зоны ишемии отрицательный зубец T уширяется и нарастает по амплитуде вплоть до гигантского. Во вторую половину зона ишемия постепенно исчезает, что сопровождается нормализацией зубца T (амплитуда его ↓, он стремится стать положительным). Динамика изменений зубца T особенно заметна на периферии зоны ишемии. Если подъем сегмента ST не пришел в N после 3 недель с момента инфаркта, рекомендуется проведение ЭхоКГ для исключения аневризмы сердца. В рубцовой стадии данные ЭКГ, по сути, отражают очаговый кардиосклероз (ЭКГ проявления обусловлены наличием в М рубцовой ткани). Это конечная стадия ИМ, при которой на месте некроза формируется прочный соединительнотканный рубец. Зон повреждения и ишемии уже нет. Поскольку рубец не возбуждается и не сокращается, на ЭКГ регистрируется ♦ стойкий патологический зубец Q или QS, который обычно сохраняется до конца жизни. Кроме того, на ЭКГ видны: ♦ Положительный зубец T, Амплитуда зубца T не меняется со временем; ♦ Сегмент ST расположен на изолинии; ♦ Амплитуда зубца R сниженная. Если со временем зубец Q ↓ (глубина и ширина), то речь, вероятно, идет о формировании новых сосудов и разрастании (гипертрофии) М вокруг зоны некроза, что можно расценивать как хороший признак. Углубление же зубца T, наоборот, часто говорит о том, что в зоне рубца все еще сохраняется ишемия М. Зона рубца (а значит, и зубец Q) может в некоторой степени уменьшиться за счет: стягивания (уплотнения) рубцовой ткани, которое сближает неповрежденные участки М и компенсаторной гипертрофии ( ↑ ) соседних участков здорового М. Зоны повреждения и ишемии в рубцовой стадии отсутствуют, поэтому сегмент ST на изолинии, а рубец T бывает положительным, сниженным или сглаженным. Однако в ряде случаев в рубцовой стадии все равно регистрируется небольшой отрицательный зубец T, что связывают с постоянным раздражением соседнего здорового М рубцовой тканью. В подобных случаях зубец T по амплитуде не должен превышать 5 мм и не должен быть длиннее половины зубца Q или R в этом же отведении. Длительность всех стадий подчиняется правилу тройки и↑ по нарастающей: до 30 минут (фаза ишемии), до 3 суток (острейшая стадия), до 3 недель (острая стадия), до 3 месяцев (подострая стадия), остаток жизни (рубцовая стадия).
Для ИМ характерны ранние и поздние осложнения. К ранним относятся: 1) Острая СН (отёк лёгких, шок); 2) Кардиогенный шок; 3) Нарушения ритма и проводимости, вплоть до фибрилляции Ж; 4) Тромбоэмболические осложнения; 5) Разрыв М с развитием тампонады сердца; 6) Перикардит; 7) Рецидив ангинозной боли (постинфарктная СК); 8) Артериальная гипотензия (в том числе медикаментозная); 9) Артериальная гипотензия, аллергические, аритмические, геморрагические осложнения при введении стрептокиназы; 10) Нарушения дыхания при введении наркотических анальгетиков. Поздние осложнения ИМ: 1) Постинфарктный синдром Дресслера; 2) Тромбоэмболические осложнения; 3) Хроническая СН; 4) Аневризма сердца. Нередко осложнения возникают уже в первые часы и дни ИМ, утяжеляя его течение. У большинства пациентов в первые трое суток наблюдаются различные виды СА. Наиболее опасно мерцание Ж, которое может перейти в фибрилляцию и привести к гибели пациента. Левожелудочковая СН с явлениями сердечной астмы, отека легких нередко развивается в острейший период ИМ. Крайне тяжелой степенью левожелудочковой СН является кардиогенный шок, развивающийся при обширном ИМ и обычно приводящий к летальному исходу. Признаками кардиогенного шока служит ↓ систолического АД ниже 80 мм рт. ст., нарушение сознания, ТК, цианоз, ↓ диуреза. Разрыв мышечных волокон в зоне некроза может вызывать тампонаду сердца - кровоизлияние в полость перикарда. У 2-3% пациентов ИМ осложняется тромбоэмболиями системы легочной артерии (могут стать причиной инфаркта легких или внезапной смерти) или большого круга кровообращения. Пациенты с трансмуральным ИМ в первые 10 суток могут погибнуть от разрыва Ж вследствие острого прекращения кровообращения. При обширном ИМ может возникать несостоятельность рубцовой ткани, ее выбухание с развитием острой аневризмы сердца. Острая аневризма может трансформироваться в хроническую, приводящую к СН. Отложение фибрина на стенках эндокарда приводит к развитию пристеночного тромбоэндокардита, опасного возможностью эмболии сосудов легких, мозга, почек оторвавшимися тромботическими массами. В более позднем периоде может развиться постинфарктный аутоиммунный синдром Дреслера, проявляющийся перикардитом, плевритом, артралгиями, эозинофилией. Среди диагностических критериев ИМ важнейшими являются анамнез заболевания, характерные изменения на ЭКГ, показатели активности ферментов сыворотки крови. Жалобы пациента при ИМ зависят от формы (типичной или атипичной) заболевания и обширности поражения М. ИМ следует заподозрить при тяжелом и продолжительном (дольше 30-60 минут) приступе загрудинных болей, нарушении проводимости и ритма сердца, острой СН. К характерным изменениям ЭКГ относятся формирование отрицательного зубца Т (при мелкоочаговом субэндокардиальном или интрамуральном ИМ), патологического комплекса QRS или зубца Q (при крупноочаговом трансмуральном ИМ). При ЭхоКГ выявляется нарушение локально сократимости Ж, истончение его стенки. В первые 4-6 часов после болевого приступа в крови определяется ↑ миоглобина. ↑ активности КФК в крови > чем на 50% наблюдается спустя 8-10 ч от развития ИМ и ↓ до N через двое суток. Определение уровня КФК проводят через каждые 6-8 часов. ИМ исключается при трех отрицательных результатах. Для диагностики ИМ на более поздних сроках прибегают к определению ЛДГ, активность которой ↑ позже КФК - спустя 1-2 суток после формирования некроза и приходит к нормальным значениям через 7-14 дней. Высокоспецифичным для ИМ является ↑ изоформ миокардиального сократительного белка тропонина - тропонина-Т и тропонина-I, увеличивающихся также при нестабильной СК. В крови определяется ↑ СОЭ, лейкоцитов, активности АсАт и АлАт. Коронарография позволяет установить тромботическую окклюзию КА и ↓ желудочковой сократимости, а также оценить возможности проведения АКШ или ангиопластики - операций, способствующих восстановлению кровотока в сердце.
Лечение ИМ. При ИМ показана экстренная госпитализация в кардиологическую реанимацию. В остром периоде пациенту предписывается постельный режим и психический покой, дробное, ограниченное по объему и калорийности питание. В подостром периоде больной переводится из реанимации в отделение кардиологии, где продолжается лечение ИМ и осуществляется постепенное расширение режима. Купирование болевого синдрома проводится сочетанием наркотических анальгетиков (фентанила) с нейролептиками (дроперидолом), внутривенным введением нитроглицерина. Терапия при ИМ направлена на предупреждение и устранение СА, СН, кардиогенного шока. Назначают антиаритмические средства (лидокаин), ß -адреноблокаторы (атенолол), тромболитики (гепарин, ацетилсалициловая к-та), антогонисты Са (верапамил), магнезию, нитраты, спазмолитики и т. д. В первые 24 часа после развития ИМ можно произвести восстановление перфузии путем тромболизиса или экстренной баллонной коронарной ангиопластики. Прогноз больного ИМ в значительной мере определяется не только нарушениями насосной функции сердца, но и электрической нестабильностью М, приводящей к развитию СА. В последние годы в связи с широким использованием в комплексной терапии больных ИМ тромболитической терапии достаточно актуальной стала проблема реперфузионных СА. СА являются одной из наиболее частых причин возникновения ВКС. По истечении острого периода прогноз на выздоровление хороший. Неблагоприятные перспективы у пациентов с осложненным течением ИМ. ИМ является тяжелым, сопряженным с опасными осложнениями заболеванием. Большая часть летальных исходов развивается в первые сутки после ИМ. Насосная способность сердца связана с локализацией и V зоны инфаркта. При повреждении более 50% М, как правило, сердце функционировать не может, что вызывает кардиогенный шок и гибель пациента. Даже при менее обширном повреждении сердце не всегда справляется нагрузками, в результате чего развивается СН. Необходимыми условиями профилактики ИМ являются ведение здорового и активного образа жизни, отказ от алкоголя и курения, сбалансированное питание, исключение физического и нервного перенапряжения, контроль АД и уровня холестерина крови.
V. Сердечные аритмии (СА) – ТФП сердца, которая характеризуется нарушением частоты и периодичности генерации возбуждения и/или последовательности возбуждения предсердий (П) и Ж. Они являются следствием парциальных или комбинированных (что чаще) нарушений автоматизма, проводимости и возбудимости М. Нарушения ритма - одно из наиболее часто встречающихся нарушений деятельности сердца. Они могут возникать у практически здоровых лиц при нарушении функционального состояния АНТ (симпатикотония, ваготония), у лиц с врожденными изменениями проводящей системы сердца (дополнительные проводящие пути). При суточном ЭКГ-мониторировании те или иные нарушения ритма, преимущественно экстрасистолы, выявляются у 43-63% здоровых лиц. Их частота резко возрастает при различных ССЗ. Наиболее частой причиной СА являются возникающие при многих заболеваниях изменения метаболизма как элементов проводящей системы сердца, так и сократительного М. Нередко появление СА существенно влияет на течение основного патологического процесса и определяет прогноз больного. Аритмогенное действие присуще и многим препаратам, используемым в кардиологической практике, в том числе и антиаритмическим средствам. В физиологических условиях импульсы к сокращению сердца возникают в СУ, расположенном в правом П в месте впадения верхней полой вены. Генераторами импульсов, или истинными пейсмекерами (Пкр), являются Р-клетки с бледной цитоплазмой (Р - pale, бледный) и узловые М-клетки (nodal - узловые), находящиеся в компактной зоне СУ. Р-клетки обладают наиболее высоким уровнем автоматизма. Потенциальными Пкр II и III порядка могут быть и др. элементы проводящей системы М - атриовентрикулярное соединение (АВс), пучок Гиса (пГ), волокна Пуркинье (вП). Самопроизвольная генерация ими импульсов обусловлена их способностью к медленной спонтанной диастолической деполяризации (СДД): в этих клетках нет периода покоя, отрицательный потенциал в IV фазе постоянно ↓ и когда достигается критический уровень (пороговый потенциал), Пкр самопроизвольно разряжается, генерируя очередной импульс. Известно, что исходная величина МП (максимальный диастолический потенциал или начало IV фазы) в Р-клетках СУ равна -50 mV (рис. 5). Она меньше, чем в др. элементах проводящей системы и сократительного М. При таком значении трансмембранного потенциала быстрые натриевые каналы частично инактивированы (закрыты), и деполяризация происходит в основном за счет тока в клетку ионов Са2+ и Na+ по медленным каналам и выходящего тока К+. При -40 mV (пороговый потенциал) СДД непосредственно переходит в фазу " О" потенциала действия (ПД), имеющую пологий характер. Максимальная величина ПД в Р-клетках также меньше, чем в латентных Пкр и сократительном М. Поэтому Р-клетки относят в группу с медленным электрическим ответом вместе с латентными Пкр дистальной части АВ узла и мышечными клетками вокруг атриовентрикулярных отверстий и в створках митрального и трикуспидального клапанов.
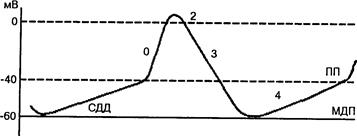
Автоматизм, ПД пейсмейкеров . Рис. 5
СДД, ПП - пороговый потенциал, МДП - максимальный диастолический потенциал, 0, 2, 3, 4 - фазы ПД " медленных" клеток.
Ведущая роль Пкр СУ в генерации импульсов связана с максимальной скоростью их СДД, обусловленной максимальной крутизной подъема ее кривой при меньших абсолютных величинах как МП, так и ПД. Кроме указанных особенностей, преобладание Р-клеток СУ связано с так называемым сверхчастым подавлением скрытыхПкр с временным угнетением спонтанной активности латентных водителей. С ЭФ позиций АВс, пГ и вП принято объединять в систему Гиса-Пуркинье (сГП). Клетки этой системы характеризуются быстрым электрическим ответом, и в них идет СДД, но значительно слабее, чем в Р-клетках СУ. В физиологических условиях автоматизм этих клеток подавляется импульсами, поступающимииз СУ. Особенностью проведения импульсов в этой системе является различная скорость. В АВс она составляет 0, 05 м/с, в пГ скорость проведения импульса колеблется, но не превышает 1, 5 м/с, в вП - 3-4 м/с. На расстоянии 2-3 мм от места соединения вП с КМ располагается зона наибольшей продолжительности ПД - так называемый " шлюз", который также защищает Ж от сверхранних импульсов, формирующихся проксимальнее. Образование и проведение импульсов в сГП контролируется в основном симпатическими волокнами, парасимпатическая иннервация представлена значительно меньше как морфологически, так и функционально. В клетках сократительного М отсутствует СДД. В фазе покоя их потенциал (МП) равен -90 mV, что обусловлено активным выведением Na+ из клетки против осмотического градиента через Na+-К+-каналы с обменом 3-х ионов Na+ на 2 иона К+. Одновременно значительная часть К+ пассивно диффундирует из клетки (по градиенту), в то время как пассивное движение Na+ в клетку по градиенту концентраций резко ограничено. Подобные перемещения ионов и приводят к тому, что в клетке начинают превалировать отрицательно заряженные соединения, преимущественно белки. Фаза 0 ПД КМ в физиологических условиях возникает при возбуждении клетки импульсом из СУ. Возбуждение мембраны КМ поступившим импульсом сопровождается деполяризацией части мембраны с открытием Na+-х каналов. Na+ медленно поступает в клетку, что приводит к ↓ выраженности отрицательного заряда внутренней поверхности клеточной мембраны, при ↓ потенциала до порогового уровня (-65-50 mV) открываются быстрые Na+-е каналы. В течение 1-2 миллисекунд в клетку поступает большое количество Na+ и заряд внутренней поверхности клеточной мембраны становится положительным - около +30 mV (реверсия ПД). Превращение внутреннего заряда клетки в положительный сопровождается закрытием быстрых Na+-х каналов, прекращением поступления Na+ в клетку с одновременным началом движения в клетку Са2+ и С1- или активацией выхода К+. Эти изменения сопровождаются быстрой реполяризацией клеточной мембраны почти до 0 mV (ранняя быстрая реполяризация - фаза 1). Далее проводимость всех ионов резко ↓ - возникает наиболее продолжительная фаза ПД (фаза 2 - плато), которая может продолжаться несколько десятков мс (рис. 6).
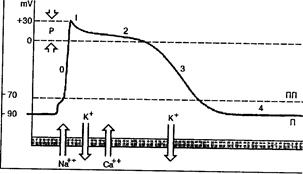
ПД сократительных КМ - " быстрых" клеток. Рис. 6
0-4 - фазы ПД, П - потенциал покоя, ПП - пороговый потенциал, Р - реверсия ПД.
В фазу плато в клетку по медленным Сa2+-м и Na+-м каналам поступают соответствующие ионы на фоне продолжающегося выхода К+. Заключительную фазу реполяризации (фаза 3) связывают с быстрым выходом из клетки К+. Важным свойством КМ является рефрактерность (Р), состояние физиологической невозбудимости, которое предотвращает сердце от тетануса. В клетках с быстрым ответом динамика Р четко связана с фазами и длительностью ПД. В сердечном цикле имеется несколько последовательных периодов, отражающих постепенный выход сердца из рефрактерного состояния (рис. 7). Выделяют абсолютный рефракторный период (АРП), во время которого стимул, даже во много раз превышающий пороговый, не вызывает ПД. После его окончания электрические стимулы некоторое время вызывают только локальные реакции. Близко к АРП понятие эффективного рефракторного периода (ЭРП), под которым понимают отрезок времени, в течение которого не удается вызвать распространяющийся ПД. ЭРП соответствует 0-й, 1-й, 2-й и началу 3-й фазы ПД.
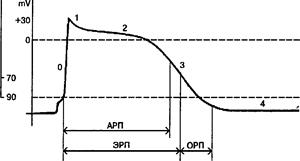
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|