
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Побочные реакции
Основная побочная реакция при взаимодействии триалкилфосфитов с алифатическими галогенидами R1Hal обусловлена образованием нового алкилгалогенида RHal, который также может вступать в реакцию с триалкилфосфитом. Так, например, при получении диэтилового эфира иодметилфосфоновой кислоты при медленном добавлении триэтилфосфита к кипящему метилениодиду при постоянной отгонке образующегося этилиодида по реакции
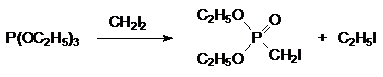
выход целевого продукта не превышает 70 % даже при десятикратном избытке метилениодида. При этом главным побочным продуктом становится диэтиловый эфир этилфосфоновой кислоты, образующийся из триэтилфосфита и этилиодида:
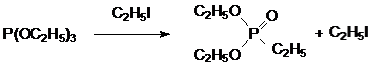
16. Способы получения глюфосината (БАСТА), механизм действия, практическое применение.
Глюфосинат аммония является действующим веществом гербицида под торговой маркой «БАСТА», выпуск которого налажен в ФРГ. Глюфоксином аммония было решено называть аммонийную соль D, L-фосфинотрицин. Биологическая активность данного вещества основана на её структурном подобии с глютаминовой кислотой. Одной из функций глютаминовой кислоты в живой природе состоит связывании свободного аммиака в глютамин, которое идет в присутствии АТФ при катализе глютаминсинтезатов. Именно это процесс блокируется фосфинатным аналогом глютаминовой кислоты, поскольку получение амида по фосфинатной группе, в отличие от карбоксилатной, не может идти при участии АТФ в связи со спецификой энергетики РО-связей. Ещё ассимиляция идет через глиоксиловую кислоту и глицин с участием глютамина. Возможно, что вызванное блокировкой глютаминсинтетазы повышение концентрации аммиака приводят к росту значений рН в тилакоидах и к остановке фотосинтеза, что в свою очередь приводит к образованию активных форм кислорода (фотодинамическое поражение растений).
Способы получения:
Патентные данные по синтезу этого гербицида достаточно обширны.
1) Реакция свободнорадикального присоединения моноэфира метилфосфонистой кислоты к различным производным акролеина (ацетали, циангидриды), с последующим превращением продуктов реакции в аминокислоту.
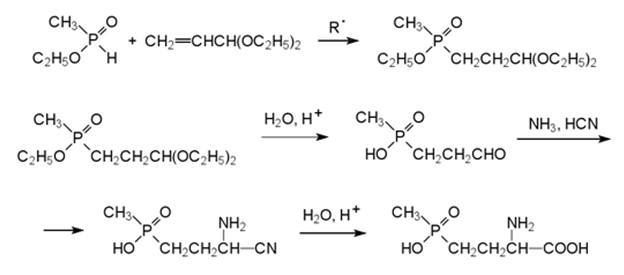
Реакция Штрекера через промежуточное соединение, образующееся из этилового эфира метилфосфорной кислотыи ацеталя акролеина.
2) Реакция диэфира метилфосфонистой кислоты с акролеином
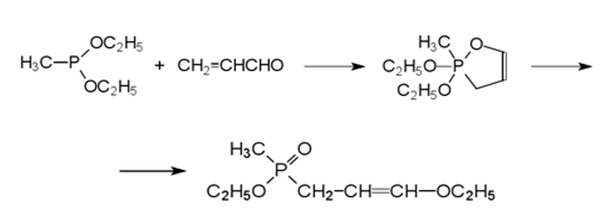
Полученный фосфорсодержащий виниловый эфир превращается в соответствующий альдегид в результате гидролиза в кислой среде:
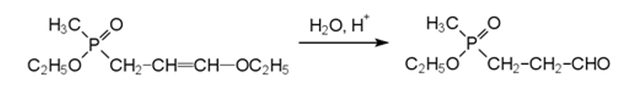
Превращение альдегида в кислоту может протекать по реакции Бухерера-Бергса через соответствующий гидантоин, который гидролизуют с образованием фосфинотрицина в щелочной среде под давлением:
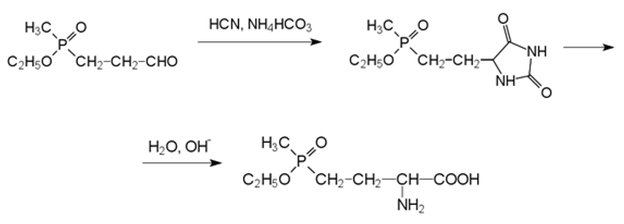
17. Фосфорорганические соединения с противовирусной активностью. Получение фосфонуксусной кислоты и тринатриевой соли фосфонкарбоновой кислоты. Механизм противовирусной активности.
Натриевая соль фосфонуксусной кислоты (фосфонет) ингибирует ДНК-полимеразу вирусов, связываясь с пирофосфатным сайтом, при этом вирусная полимераза значительно более чувствительна к этому препарату, чем ДНК-полимераза человека. Фосфонуксусная кислота, в частности, специфично ингибирует синтез ДНК в цитомегаловирусах, инфицирующих фибробласты человека. Она также ингибирует синтез ДНК вируса Нerpes simplex и активность вирус-специфичной ДНК-полимеразы в модельных опытах. Однако использование фосфонуксусной кислоты в составе лекарственных средств осложнено сильным цитотоксическим эффектом.
Еще более эффективна в качестве ингибитора ДНК-полимеразы тринатриевая соль фосфонмуравьиной кислоты (фоскарнет, фоскавир). При внутрибрюшинном введении в опытах на мышах её токсичность ЛД50 составляет от 2000 до 4000 ммоль/кг. Разработаны методики поддерживающей терапии приобретенного иммунодефицита (ВИЧ-инфекций) с участием фоскарнета.
Получение фосфонуксусной кислоты проводят в основном по реакции Михаэлиса-Арбузова:
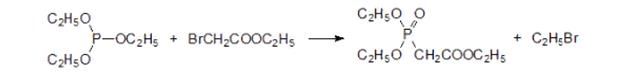
При температуре около 150°С триэтилфосфит реагирует с бромацетатом. Выделяющийся в реакции этилбромид с т. кип. 38 °С значительно уступает по реакционной способности бромацетату и поэтому не участвует во взаимодействии с триалкилфосфитом
Предложено также получать триметиловый эфир фосфонуксусной кислоты по реакции Михаэлиса-Беккера алкилированием диметилфосфита метилхлорацетатом в присутствии безводного карбоната калия. В этом случае диметилфосфит выполняет роль полярного апротонного растворителя, значительно повышающего основность поташа:
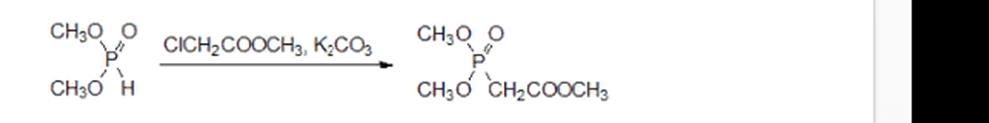
!!! (ОТЛИЧИЕ ОТ ЗАДАНИЯ)!!!
По реакции Михаэлиса-Арбузова из триалкилфосфита и эфира хлоругольной кислоты получают триэфир фосфонмуравьиной кислоты, который можно гидролизовать в концентрированной щелочи и получать, например, тринатриевую соль фосфонмуравьиной кислоты (фоскарнет):
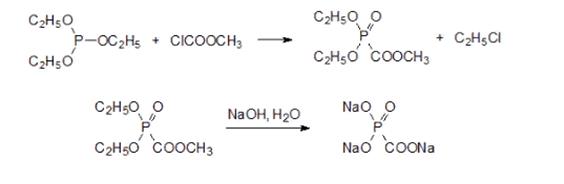
Однако для получения фоскарнета в качестве активного начала лекарственного средства запатентованы способы, в которых в качестве исходного соединения используют фосфористую кислоту. Её переводят в бис(триметилсилиловый) эфир гексаметилдисилазаном или гексаметил-дисилоксаном, например, по схеме:

И далее действием гексаметилдисилазана и хлоркарбоната переводят бис(триметилсилил)фосфит в бис(триметилсилокси)фосфорилформиат
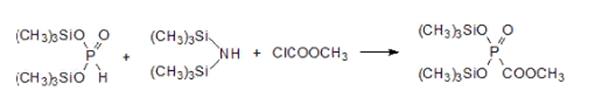
Гидролиз триметилсилильных групп и карбоксилатной группы 20 %-ным раствором гидроксида натрия протекает с практически количественным выходом тринатриевой соли.
18. Ингибирование холинэстеразы соединениями с ацилирующей способностью, особенности ингибирования производными кислот фосфора, формула Шрадера.
Токсичность О-этил-S-(2-диизопропиламиноэтил)метилтиофосфоната (VX), 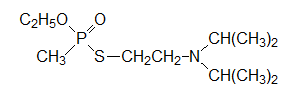 разработанного в Великобритании при нанесении на кожу составляет 10 мг на человека.
разработанного в Великобритании при нанесении на кожу составляет 10 мг на человека.
Изучение механизма действия токсикантов нервно-паралитического действия показало, что они необратимо блокируют ферменты, относящие к классу гидролаз. При этом основной токсический эффект у теплокровных проявляется в результате ингибирования холинэстеразы (ХЭ) – фермента, катализирующего гидролитическое разложение нейромедиатора ацетилхолина на уксусную кислоту и холин:
В синапсе, где нервное окончание нейрона контактирует с клетками иннервируемой ткани, ацетилхолин передает им сигнал возбуждения, поступающий в виде волны изменения полярности мембраны, по аксонам нейронов центральной нервной системы (ЦНС), соматического и вегетативного отделов периферической нервной системы. При этом после передачи импульса возбуждения ацетилхолин должен быть инактивирован (для этого и предназначена холинэстераза), иначе вместо единичных импульсов возбуждения получится постоянная активация соответствующих биохимических систем, которая закончится исчерпанием энергетических ресурсов иннервируемых клеток и их гибелью. В соответствии с этим отравляющие вещества с таким механизмом токсического действия получили название нервно-паралитических.
Исследования различных фосфорсодержащих аналогов ацетилхолина были проведены в Швеции, где в послевоенные годы была организована рабочая группа под руководством Л. Э. Таммелина. Простейший подход к фосфорным аналогам ацетилхолина с заменой остатка уксусной кислоты на фосфатный, например,
не приводит к получению высокотоксичных соединений, поскольку эфиры кислот фосфора не обладают ацилирующей способностью. Они взаимодействуют с нуклеофильными реагентами по схеме алкилирования, а активный центр холинэстеразы такие реакции не катализирует.
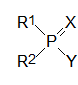
Г. Шрадер в послевоенные годы продолжил работы по синтезу производных кислот фосфора с инсектицидной активностью. Анализ экспериментального материала, полученного в процессе изучения зависимости токсичности от строения таких соединений, позволил ему предложить эмпирическую формулу, которой должны соответствовать соединения с антихолинэстеразным механизмом биологической активности. В соответствии с этой формулой ингибиторами холинэстеразы являются производные кислот фосфора общей формулы:
 ,
,
где Х означает атом кислорода или серы, остатки R1 и R2 независимо один от другого означают алкильные, арильные группы, алкоксигруппы, арилокси-группы, алкилмеркаптогруппы, алкиламидные и ариламидные группы, а остаток Y означает уходящую группу, обеспечивающую перенос фосфориль-ной группы на соответствующий нуклеофильный структурный элемент в каталитическом центре холинэстеразы. При этом в роли заместителя Y должны выступать остатки слабых кислот, например, синильной, фтористоводородной кислоты, меркаптана, остаток фосфорной кислоты, это может быть замещенная электроноакцепторными заместителями арилоксигруппа и т. д. Конечно, более эффективными уходящими группами являются, например, атомы галогенов или остатки других сильных кислот, но фосфорилирующая активность таких соединений оказывается настолько высокой, что они просто не могут попасть в защищенные глиальными клетками синапсы центральной и периферической нервной системы, где локализована участвующая в передаче нервного импульса холинэстераза. При поступлении в организм такие ангидриды прореагируют с водой или с другими менее важными нуклеофильными группами в составе биомолекул.
Многие фосфорорганические соединения с антихолинэстеразной активностью соответствуют эмпирической формуле Шрадера, поскольку они представляют собой смешанные ангидриды соответствующих производных кислот фосфора и слабых кислот. В частности, тиолфосфатный токсикант VX можно рассматривать как фосфорилированный аминотиол, меркаптогруппа которого, конечно, обеспечивает ему свойства слабой кислоты.
19. Получение аминофосфонатов по реакции Кабачника-Филдса. Механизм реакции, варианты ее проведения.
Один из способов получения: конденсация гидрофильных соединений с аминами и карбонильными соединениями. Данная трёхкомпонентная реакция приводит к образованию α -аминофосфонатов.
Схема реакции: 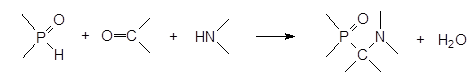
Продукт реакции: соединения, представляющие собой структурные аналоги эфиров α -аминокислот, а присутствие в их структуре аминной и фосфорильной групп, позволяло рассчитывать на получение на их основе соединений с комплексообразующей способностью.
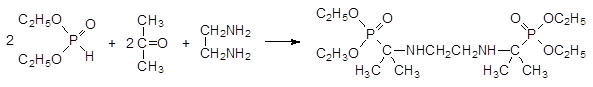
Комплексообразующая способность этих соединений по отношению к ионам металлов может быть повышена путём перевода их в соответствующие кислоты гидролитическим отщеплением эфирных групп. Так были получены кислые бис(аминофосфонаты), которые могут быть использованы в качестве антидотов при хронических отравлениях такими токсичными металлами, как бериллий.
Ещё один комплексообразователь - нитрило-трис(метилфосфоновая кислота) - образуется из фосфористой кислоты, формальдегида и хлорида аммония в присутствии соляной кислоты:
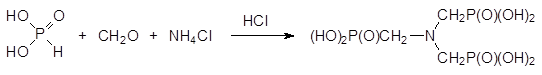
Эта кислота может найти применение в производстве стиральных порошков в качестве заменителя экологически небезопасных полифосфатов и нитрилотриуксусной кислоты для снижения жесткости воды.
Получаемые по реакции Кабачника-Филдса α ‑ аминофосфонаты проявляют фунгицидную, гербицидную, рострегуляторную, фармакологическую активность. В связи с этим большое внимание уделялось разработке стереоселективных способов получения этих веществ.
Механизм аналогичен механизму реакции Манниха:
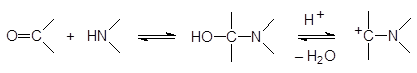
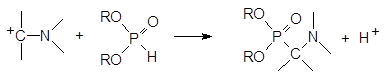
В соответствии с этим механизмом аминоалкилирование фосфитов может также протекать при действии аминоацеталей карбонильных соединений и геминальных диаминов:
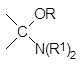 и
и 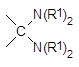
Реакция диалкилфосфитов с этими соединениями протекает с выделением спирта или амина. Первичные амины и карбонильные соединения могут реагировать с фосфитами через образующиеся в качестве промежуточных продуктов имины. Именно этот механизм считается наиболее вероятным для реакции диалкилфосфитов с бензальдегидом и анилином:
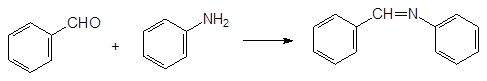
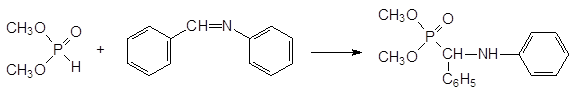
20. Метаболические превращения с образованием токсичных соединений на примере хлорофоса и тиофосфатов («летальный синтез»).
оксигеназы, предназначенные для метаболического превращения поступающих в организм ксенобиотиков, переводят входящую в состав этого соединения электронодонорную метилмеркаптогруппу в электроноакцепторную метилсульфоксидную группу и это превращение представляет собой один из примеров летального синтеза:
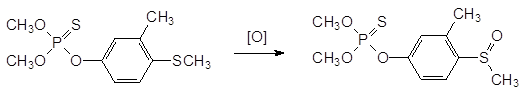
Другой механизм летального синтеза отвечает за антихолинэстеразную активность диметилового эфира 1-гидрокси-2, 2, 2-трихлорэтилфосфоновой кислоты с ЛД50 для крыс 560 мг/кг. Это соединение, известное под названием хлорофос, диптерекс и др., в присутствии даже слабых оснований претерпевает фосфонат-фосфатную перегруппировку с отщеплением молекулы хлористого водорода:
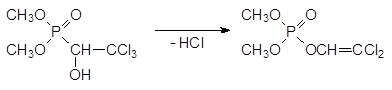
В результате дегидрохлорирования не соответствующий формуле Шрадера фосфонат превращается в фосфорилированный енол, который уже может выступать в качестве фосфорилирующего средства, поскольку в его составе появляется уходящая группа, соответствующая остатку слабой кислоты. В данном случае речь идет о енольной форме дихлоруксусного альдегида.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|