
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Механизм реакции Михаэлиса-Арбузова
1. Способы получения диэфиров фосфористой кислоты.
Этерификацией фосфористой кислоты высшими спиртами в условиях азеотропной отгонки образующейся в результате реакции воды соответствующие диалкилфосфиты могут быть получены с количественным выходом по фосфористой кислоте. Так, например, ди-(2-этилгексиловый) эфир фосфористой кислоты получают при нагревании фосфористой кислоты с 2‑ этилгексиловым спиртом при добавлении раствора фосфористой кислоты в 2‑ этилгексаноле к кипящему 2-этилгексанолу: 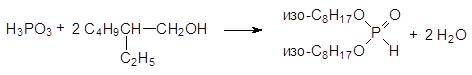
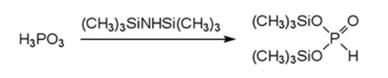
Взаимодействие фосфористой кислоты с силлирующми реагентами (триметилсиллилхлорид с триэтиламином, гексаметилдисилоксан или гексаметилдисизилан) протекает с образованием моно- и бис(триметилсиллил)-фосфатта. С помощью гексаметилдисилоксана не удается провести полное силлирование всех гидроксильных групп в молекуле фосфористой кислоты. Получения био(триметилсилил)-фосфита проводят действием гексаметилдисизилана:
Еще один способ получения алкиловых эфиров фосфористой кислоты основан на взаимодействии спиртов с ангидридом фосфористой кислоты, который образуется при пропускании сухого воздуха в суспензию белого фосфора в спирте: 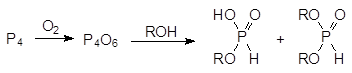
Продуктом реакции в этом случае становится смесь моноэфира и диэфира фосфористой кислоты.
Тем не менее, при получении диэфиров фосфористой кислоты с высшими спиртами предпочитают использовать реакцию переэтерификации. При этом на первой стадии получают диметилфосфит и нагревают его с соответствующим спиртом, отгоняя образующийся метанол:
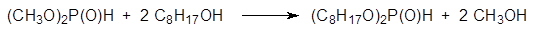
Основные побочные продукты в этой реакции представлены соответствующим изооктеном и бис-(2-этилгексиловым) эфиром, которые образуются из 2‑ этилгексанола в присутствии кислот.
2. Реакция Пудовика. Исходные соединения, связь с реакцией Кабачника—Филдса в варианте с основаниями Шиффа.
Гидрофосфорильные соединения присоединяются также по С=N-связям оснований Шиффа. В отечественной литературе эта реакция иногда считается одним из вариантов реакции Пудовика, однако она представляет собой способ получения α ‑ аминофосфонатов, вписывающийся в рамки реакции Кабачника-Филдса (вопрос 19).
Реакция присоединения гидрофосфорильных соединений к активированным этиленовым связям, катализируемая сильными основаниями, называется реакцией Пудовика. В качестве непредельных соединений в этой реакции могут участвовать α, β -ненасыщенные кислоты, их эфиры и нитрилы, различные винилкетоны, нитроалкены и другие винильные соединения с электроноакцепторными группами, например: 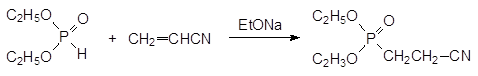
При добавлении этилата натрия к смеси диалкилфосфита и акрилонитрила реакция достаточно быстро останавливается с невысокой степенью превращения реагентов. При добавлении новой порции катализатора она возобновляется и для её завершения добавление катализатора надо повторять несколько раз или непрерывно добавлять его к реакционной массе небольшими порциями.
При взаимодействии диалкилфосфитов с винилкетонами реакция может идти по двум направлениям в соответствии с реакцией Абрамова или реакцией Пудовика:
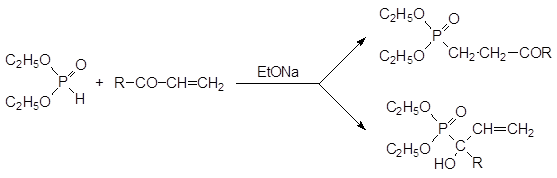
Превращение по реакции Пудовика конкурирует с присоединением гидрофосфорильного соединения по карбонильной группе по реакции Абрамова. Кетофосфонат, образовавшийся в результате присоединения диалкилфосфита по этиленовой двойной связи винилкетона, может присоединять еще одну молекулу фосфита по карбонильной группе по реакции Абрамова с образованием гидроксизамещенного бисфосфоната.
В случаях, когда этиленовая двойная связь активирована несколькими электроноакцепторными заместителями, реакция присоединения фосфитов может протекать и без катализатора.
3. Реакции ацидолиза эфиров кислот фосфора, ацидолиз при получении диалкилфосфитов, условия перегонки реакционных масс. Окисление и галогенирование диалкилфосфитов.
Реакция гидролиза эфиров кислот фосфора с фософорильной группой при нагревании в 10-%ной соляной кислоте приводит к образованию алкилхлоридов, а не спиртов. Такие реакции называют реакциями ацидолиза.

Они, а также реакции гидролиза всегда присутствуют в реакционной массе в синтезе диалкилфосфатов, образуя кислые примеси. Эти кислые примеси при нагревании вызывают разложение диалкилфосфитов, с образованием непредельных соединений или простых эфиров, например, по схеме:
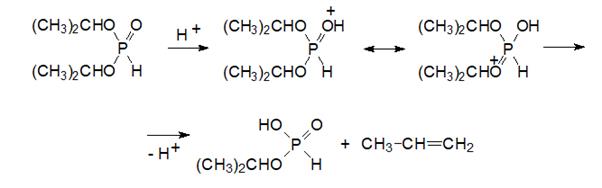
В результате разложения в кубовой жидкости увеличивается содержание кислых примесей и скорость этой реакции возрастает. При нагревании кислые эфиры фосфористой кислоты диспропорционируют с образованием фосфатов, фосфина и аморфного фосфора оранжевого цвета. В соответствии с этим перегонку таких реакционных масс следует проводить в вакууме при температурах в кубовой жидкости не выше 100-130°С. При появлении оранжевого осадка перегонку следует прекратить, а воздух в прибор для перегонки можно впускать только после полного его охлаждения.
Однако в общем случае диэфиры с алкильными остатками нормального строения в чистом виде устойчивы до температуры около 160°С. Эфиры с вторичными и тем более с третичными спиртами более чувствительны к термическому воздействию.
Невысокой термической стабильностью в ряду диалкилфосфитов выделяется диметилфосфит. Это связано с тем, что это соединение представляет собой хорошее метилирующее средство, при этом в его структуре присутствует атом водорода гидрофосфорильной группы, который может замещаться на алкильные остатки.
что скорость реакции диэтилфосфита с галогенами (Сl2, Br2, I2) не зависит ни от концентрации галогена, ни от его природы. Это можно объяснить только тем, что лимитирующей скорость реакции стадией является изомеризация Н-фосфоната в таутомерную форму с трикоординированным атомом фосфора, которая с высокой скоростью реагирует с соответствующим галогеном:
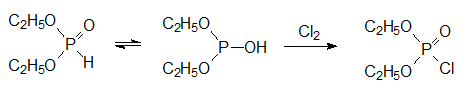
Окислительные превращения гидрофосфорильной группы в диалкилфосфитах протекают при действии многих реагентов. Интересно, что первичным продуктом окисления диалкилфосфитов диоксидом азота являются тетраалкилпирофосфаты:
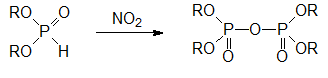
Как отмечалось выше, в присутствии оснований диалкилфосфиты присоединяют серу и превращаются в соли диалкилтиофосфорных кислот.
Галогены переводят диалкилфосфиты в соответствующие моногалогениды диалкиловых эфиров фосфорной кислоты в результате замещения атома водорода галогеном. Если эта реакция протекает в присутствии воды, то продуктами реакции становятся соответствующие диалкилфосфаты:

4. Получение диметилового эфира 1-гидрокси-2, 2, 2-трихлорэтилфосфоновой кислоты, фосфонат-фосфатная перегруппировка в присутствии оснований. Инсектицидная активность продуктов реакций.
Реакция диалкилфосфитов с альдегидами и кетонами протекает при катализе основаниями по схеме нуклеофильного присоединения по карбонильной группе по схеме:
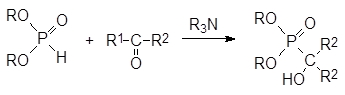
В качестве основания могут быть также использованы алкоголяты или гетерогенные катализаторы: γ -оксид алюминия, оксид магния, фториды калия и цезия на оксиде алюминия.
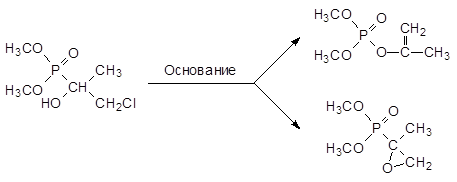
В присутствии триэтиламина диметилфосфит реагирует с хлорацетоном с образованием фосфонатного хлоргидрина:

Дегидрохлорирование этого соединения в присутствии основания приводит к фосфонат-фосфатной перегруппировке, протекающей с образованием изопропенилфосфата, однако в отдельных случаях условия проведения реакции дегидрохлорирования С-фосфорилированных хлоргидринов можно подобрать так, чтобы наряду с фосфонат-фосфатной перегруппировкой протекало образование С-фосфорилированного эпоксидного соединения, как это характерно для обычных хлоргидринов без фосфонатной группы:
Без участия катализатора идёт реакция диметилфосфита с хлоралем. При этом образуется кристаллический диметиловый эфир 1-гидрокси-2, 2, 2-трихлорэтилфосфоновой кислоты с инсектицидной активностью (хлорофос, диптерекс, гиподермин-хлорофос):
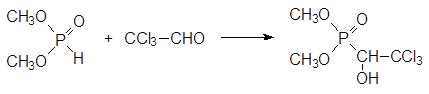
По аналогии с представленной выше фосфонат-фосфатной перегруппировкой продуктов реакции Абрамова хлорофос при действии оснований превращается в более летучий и более токсичный жидкий 2, 2‑ дихлорвинилфосфат, используемый для борьбы с летающими насекомыми:
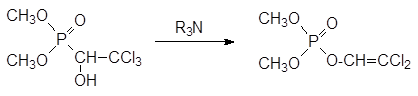
В ряду других превращений гидроксизамещенных фосфонатов можно отметить их окисление с образованием ацилфосфонатов.
Другой механизм летального синтеза отвечает за антихолинэстеразную активность диметилового эфира 1-гидрокси-2, 2, 2-трихлорэтилфосфоновой кислоты. Это соединение в присутствии даже слабых оснований претерпевает фосфонат-фосфатную перегруппировку с отщеплением молекулы хлористого водорода:
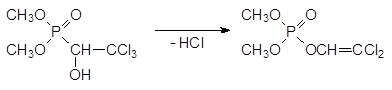
В результате дегидрохлорирования не соответствующий формуле Шрадера фосфонат превращается в фосфорилированный енол, который уже может выступать в качестве фосфорилирующего средства, поскольку в его составе появляется уходящая группа, соответствующая остатку слабой кислоты. В данном случае речь идет о енольной форме дихлоруксусного альдегида.
Важной особенностью фосфорорганических ядов и серьезным недостатком многих фосфорорганических инсектицидов с антихолинэстеразным механизмом действия является их хроническая токсичность, связанная с необратимостью вызванного ими ингибирования холинэстеразы.
5. Присоединение диалкилфосфитов к кратным связям (С=С, С=О, С=N), реакция Абрамова.
Реакцию присоединения диалкилфосфитов по карбонильным группам называют реакцией Абрамова. он провел систематические исследования взаимодействия гидрофосфорильных и карбонильных соединений, благодаря которым этот способ получения α ‑ гидроксизамещенных фосфонатов стал одним из ключевых синтетических методов в химии фосфорорганических соединений.
Реакция диалкилфосфитов с альдегидами и кетонами протекает при катализе основаниями по схеме нуклеофильного присоединения по карбонильной группе по схеме:
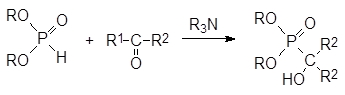
Из 4 вопроса голубое + В. С. Абрамов исследовал взаимодействие триалкилфосфитов с карбо-нильными соединениями. В этом случае продуктами реакции становятся α ‑ алкоксифосфонаты, например:
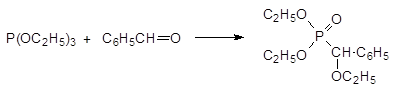
6. Взаимодействие α -галогензамещеных кетонов с триалкилфосфитами (реакция Перкова и Михаэлиса-Арбузова).
При взаимодействии триалкилфосфита с хлорацетоном основным продуктом реакции (с выходом около 90%) становится соответствующий изопропениловый эфир диалкилфосфорной кислоты (реакция Перкова):

В то же время реакция триалкилфосфита с бромацетоном приводит к смеси продукта реакции Перкова и продукта реакции Михаэлиса-Арбузова в примерно равных количествах, тогда как взаимодействие триалкилфосфита с иодацетоном протекает преимущественно по схеме реакции Михаэлиса-Арбузова с образованием соответствующего ацетонилфосфоната с выходом около 90%:
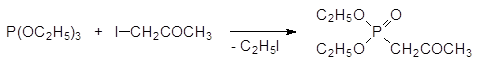
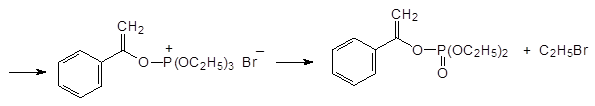
Механизм реакции Перкова может быть представлен двумя схемами. В соответствии с одной из них первичным продуктом взаимодействия является квазифосфониевое соединение, образующееся в результате атаки нуклеофильного атома фосфора по атому углерода карбонильной группы, которое далее претерпевает перегруппировку с образованием РО-связи и стабилизируется с отщеплением алкилбромида по схеме:
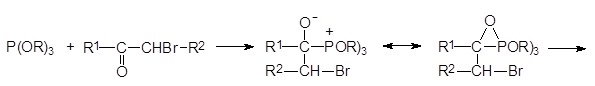

Если α -галогензамещенное карбонильное соединение может отщеплять галоген в виде положительно заряженного иона и превращаться в стабилизиро-ванный сопряжением анион енольной формы кетона, то механизм реакции Перкова представляется как атака образующегося при этом квазифосфониевого соединения непосредственно по атому кислорода:
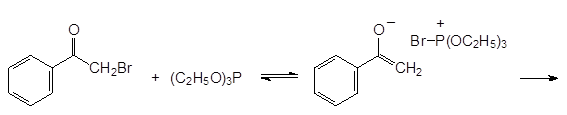
7. Реактивация ацилированной фосфорорганическими соединениями холинэстеразы производными гидроксиламина.
Серьезным недостатком фосфорорганических ядов является их хроническая токсичность, связанная с необратимостью вызванного ими ингибирования холинэстеразы. Фермент относится к сериновым гидролазам, в активном центре которых находится гидроксиметильная группа включенной в пептидную цепь белка аминокислоты серина.
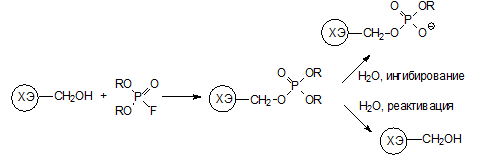
В синапсах биосинтез новых молекул холинэстеразы вместо заблокированных идет очень медленно, и после воздействия сублетальных доз антихолинэстеразных ядов содержание этого фермента уже никогда не выходит на прежний уровень, а его недостаток компенсируется организмом другими путями.
Именно поэтому для лечения острых отравлений антихолинэстеразными токсикантами были разработаны антидотные композиции, в состав которых наряду с антагонистами ацетилхолина, обратимыми ингибиторами холинэстеразы и успокаивающими средствами входят производные гидроксиламина.
1. Например, гидроксамовая кислота на основе никотиновой кислоты нейтрализует попавший в организм токсикант. Она взаимодействует с поступающим в организм антихолинэстеразным ядом, разлагая его до того, как он прореагирует с холинэстеразой:
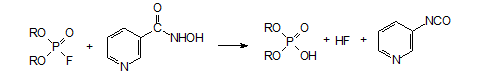
Промежуточным продуктом: фосфорилированная по гидроксильной группе гидроксамовая кислота, которая разлагается на диалкилфосфат и соответствующий изоцианат, гидролизующийся водой с образованием нестойкой карбаминовой кислоты.
2. Также можно использовать монооксимы α -дикарбонильных соединений. Монооксим диацетила, образующийся при нитрозировании метилэтилкетона, реагирует с диалкилфторфосфатом по схеме:
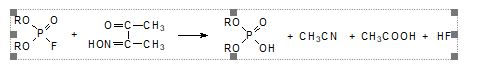
Промежуточным продуктом и в этом случае является фосфорилированный по гидроксильной группе оксим, разлагающийся водой с образованием диалкилфосфорной кислоты, уксусной кислоты и ацетонитрила.
3. Оксимы альдегидов на основе пиридиниевых солей предназначена для реактивации молекул, фосфорильная группа которых ещё не перешла в ионную форму.
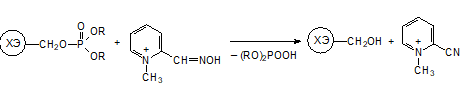
Роль четвертичного атома азота в молекуле 2-ПАМ состоит в фиксации молекулы антидота в активном центре фермента в результате взаимодействия с анионным сайтом, предназначенным для связывания с триметиламмонийной группой в молекуле ацетилхолина.
Многие О-фосфорилированные производные гидроксиламина соответствуют формуле Шрадера и, согласуясь с этим, они должны быть антихолинэстеразными ядами. В качестве примера таких соединений можно назвать инсектицид фоксим и один из токсинов сине-зеленых водорослей:

представленные выше гидроксамовые кислоты, оксимы α ‑ дикарбонильных соединений и оксимы альдегидов можно использовать в качестве антидотов только потому, что продукты их фосфорилирования разлагаются на малотоксичные соединения сразу после образования.
8. Получение полных ариловых и алкиловых эфиров фосфористой кислоты.
Для получения эфиров фосфористой кислоты можно также использовать реакцию её этерификации. В частности, моноэфиры фосфористой кислоты лучше получать этерифицированием фосфористой кислоты спиртом без добавления другой сильной кислоты, отгоняя выделяющуюся в результате реакции воду: 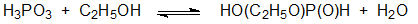
Этерификацией фосфористой кислоты высшими спиртами в условиях азеотропной отгонки образующейся в результате реакции воды соответствующие диалкилфосфиты могут быть получены с количественным выходом по фосфористой кислоте. Так, например, ди-(2-этилгексиловый) эфир фосфористой кислоты получают при нагревании фосфористой кислоты с 2-этилгексиловым спиртом при добавлении раствора фосфористой кислоты в 2-этилгексаноле к кипящему 2-этилгексанолу: 
Взаимодействие фосфористой кислоты с различными силилирующими реагентами (триметихлорсилан с триэтиламином, гексаметилдисилоксан и гексаметилдисилазан) протекает с образованием моно- и бис-(триметилсилил)-фосфита. С помощью гексаметилдисилоксана не удается провести полное силилирование всех гидроксильых групп в молекуле фосфористой кислоты. Получение бис(триметилсилил)фосфита проводят действием гексаметилдисилазана: 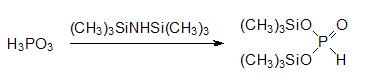
Еще один способ получения алкиловых эфиров фосфористой кислоты основан на взаимодействии спиртов с ангидридом фосфористой кислоты, который образуется при пропускании сухого воздуха в суспензию белого фосфора в спирте: 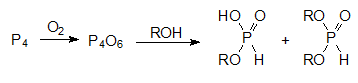
Продуктом реакции в этом случае становится смесь моноэфира и диэфира фосфористой кислоты.
При получении диэфиров фосфористой кислоты с высшими спиртами предпочитают использовать реакцию переэтерификации. При этом на первой стадии получают диметилфосфит и нагревают его с соответствующим спиртом, отгоняя образующийся метанол: 
Полярный характер фосфорильной группы облегчает течение реакций переэтерификации. В ряду диалкилфосфитов легче всего в реакцию переэтерификации вступает метильная группа, еще легче замещаются на алкильные остатки арильные группы в диарилфосфитах, однако эти вещества получать сложнее, чем, например, диметилфосфит. Феноксигруппы в дифенилфосфите замещаются также на алкилмеркаптогруппы.
Чаще всего циклические фосфиты синтезируют в две стадии в результате взаимодействия соответствующего гликоля с трихлоридом фосфора: 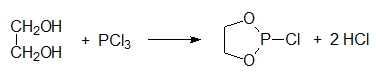
Реакцию проводят при температуре от 0°С до 5°С в присутствии третичного амина при стехиометрическом соотношении реагентов: Далее полученный хлорид циклического фосфита (его систематическое название 2-хлор-1, 3, 2-диоксафосфолан) осторожно гидролизуют водой:
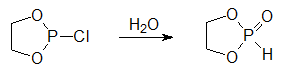
Эту реакцию проводят в метиленхлориде при охлаждении, прибавляя к раствору хлорангидрида при интенсивном перемешивании раствор воды в 1, 4-диоксане. Важно, чтобы в процессе гидролиза исходный хлорид был в небольшом избытке по отношению к воде (примерно 1, 0 к 0, 8), иначе образующийся циклический фосфит полимеризуется с раскрытием диоксафосфоланового цикла.
Аналогичные представленным выше схемы могут быть использованы для получения эфиров алкил- и арилфосфонистых кислот.
9. Реакция Хорнера-Вадсворта-Эммонса, синтез фосфонацетатов.
Исходными продуктами в реакции Хорнера-Вадсворта-Эммонса являются триэфиры фосфонуксусной кислоты, у которых электроноакцепторный эффект карбоксилатной группы дополняется электронно-акцепторным эффектом фосфорильной группы. При действии таких сильных оснований, как трет-бутилат калия, гидрид натрия, амид натрия или DBU с хлоридом лития, в тетрагидрофуране, 1, 2-диметоксиэтане, бензоле или ацетонитриле, полные эфиры фосфонуксусной кислоты депротонируются с образованием аниона, который реагирует с карбонильными соединениями по аналогии с реакцией Виттига. Конечными продуктами при этом становятся эфиры замещенных акриловых кислот:
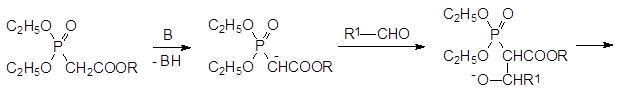
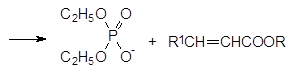
Представленный реакцией Хорнера-Вадсворта-Эммонса способ получения производных акриловых кислот был впервые реализован группой исследователей под руководством Л. Хорнера. В качестве примера использования этой реакции на практике можно привести синтез регулятора роста насекомых метопрена:
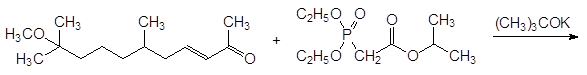
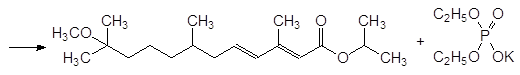
Реакция Хорнера-Вадсворта-Эммонса приводит к получению соответствующих непредельных соединений в виде термодинамически более выгодных Е‑ изомеров. Замена этильных остатков в эфирных группах у атома фосфора на 2, 2, 2-трифторэтильные позволяет получать преимущественно Z‑ изомеры. Это связано с тем, что фосфонат с трифторэтильными группами реагирует с карбонильными соединениями с более высокой скоростью. В соответствии с этим реакция с участием трифторэтиловых эфиров фосфонуксусной кислоты (W. C. Still, C. Gennari, 1983) протекает при более низкой температуре по пути с более низким значением энергии активации (кинетический контроль течения реакции).
10. Примеры тиофосфосфатов с инсектицидной активностью, механизм выработки резистентности на примере карбофоса.
Синтез О‑ метил-О-этилхлортиофосфата, который получали в промышленном масштабе в качестве исходного продукта в производстве инсектицидов:
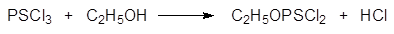
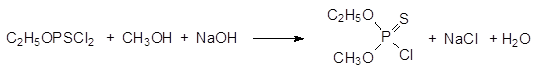
Диалкилхлортиофосфаты использовались в качестве исходных продуктов для получения широкого ряда инсектицидов, которые были более безопасны, чем соответствующие кислородные аналоги.
Альтернативные схемы синтеза диалкилхлортиофосфатов. Могут быть получены контролируемым хлорированием О, О-диалкилдитиофосфатов, которые с высокими выходами образуются из соответствующих спиртов и декасульфида фосфора
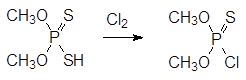
Еще один способ получения диалкилхлортиофосфатов, при реализации которого резко сокращается количество жидких отходов, представлен хлорированием диалкилдитиофосфатов пентахлоридом фосфора:
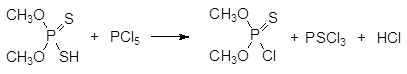
При гидролитическом разложении О, О-диалкилхлортиофосфатов образуются соответствующие кислоты, которые могут существовать в двух таутомерных формах:
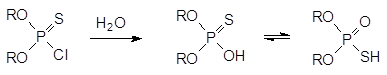
Оптимальным соотношением токсичности и инсектицидной активности характеризуется тиофосфорилированный оксим:
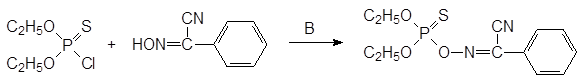
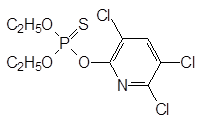
В качестве системного инсектицида для борьбы с оводами использовался трихлорметафос-3:
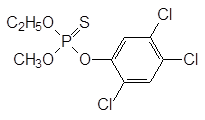
Инсектицид на основе эфиров дитиофосфорной кислоты О, О-диметил-S-(N-метилкарбамоил)-метилдитиофосфат:
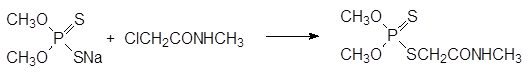
Инсектицидные препараты с этим действующим началом поступают в продажу и в наше время. В качестве агрохимического средства для борьбы с насекомыми вредителями продолжают использовать дикротофос и некоторые производные тиофосфорных кислот, например, хлорпирифос и пиримифос-метил (актеллик, камикадзе), соответственно:
 и
и 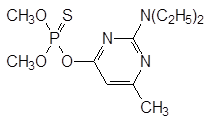
Хлорпирифос применяют для борьбы с москитами и в качестве средства для борьбы с насекомыми в личиночной стадии развития. По ларвицидной активности он в деятки раз превосходит другие фосфорорганические инсектициды.
Высокой инсектицидной активностью отличается амид О, S-диметил-тиофосфорной кислоты:
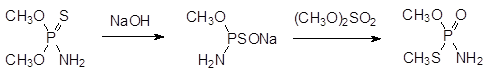
Это соединение может быть также получено в результате термической тион-тиольной изомеризации (реакция Пищимуки) амида диметилового эфира тионфосфорной кислоты в присутствии диметилсульфата:
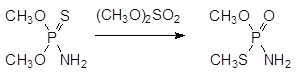
В качестве исходных продуктов для получения широкого ряда инсектицидов с невысокой токсичностью для теплокровных используются эфиры дитиофосфорной кислоты, образующиеся из соответствующего спирта и декасульфида фосфора. Присоединение О, О‑ диметил-дитиофосфата к диэтиловому эфиру малеиновой кислоты при катализе основаниями приводит к карбофосу, который нашел применение в сельском хозяйстве:
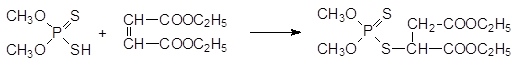
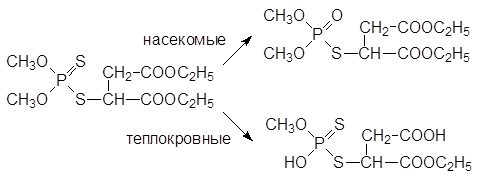
В бытовых условиях производные дитиофосфорных кислот не используются из-за присущего им неприятного запаха. Высокая избирательность карбофоса основана на том, что в организме насекомых это малотоксичное соединение окисляется с превращением тиофосфорильной группы в фосфорильную, что приводит к получению вещества с инсектицидной активностью, а в организме теплокровных идёт гидролиз сложноэфирных групп и образуются малотоксичные тионные метаболиты с кислотными функциональными группами:
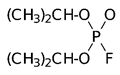
11. Зависимость токсичности от строения для фосфорорганических соединений, эмпирическая формула Шрадера.
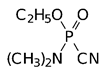
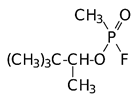
Отравляющие вещества нервно-паралитического действия: Диизопропилфторфосфат, диметиламид этилового эфира цианфосфорной кислоты (табун), изопропиловый эфир фторангидрида метилфосфоновой кислоты (зарин, GB) и пинаколиновый эфир фторангидрида метилфосфоновой кислоты (зоман, GD), соответственно:
| 
| 
| 
|
О, О-диэтил-S-(2-диэтиламиноэтил)фосфат: впервые вещество было синтезировано Шрадером, токсичность около 3 мг/кг: 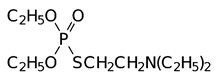
Подобное, но более токсичное О-этил-S-(2-диизопропиламиноэтил)метилтиофосфонат: 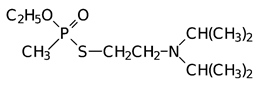
Механизм действия токсикантов нервно-паралитического действия основан на необратимом блокировании ферментов - гидролаз. При этом основной токсический эффект у теплокровных проявляется в результате ингибирования холинэстеразы (ХЭ) – фермента, катализирующего гидролитическое разложение нейромедиатора ацетилхолина на уксусную кислоту и холин:

В синапсе тацетилхолин передает сигнал возбуждения, поступающий в виде волны изменения полярности мембраны. При этом после передачи импульса возбуждения ацетилхолин должен быть инактивирован (для этого и предназначена холинэстераза), иначе вместо единичных импульсов возбуждения получится постоянная активация соответствующих, которая закончится исчерпанием энергетических ресурсов иннервируемых клеток и их гибелью. В соответствии с этим отравляющие вещества с таким механизмом токсического действия получили название нервно-паралитических.
Токсические вещества с нейротоксическим эффектом: Первым органическим производным фосфорной кислоты, которое вызывало параличи нижних конечностей, проявлявшиеся по истечении нескольких недель после отравления, стал три-о-крезилфосфат (ТОКФ). Это соединение использовали в качестве присадки к моторным маслам и в качестве пластификатора для пластмасс: 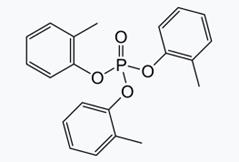
основную опасность представляют вещества, соответствующие формуле Шрадера, и производные кислот фосфора, которые могут превращаться в них под действием ферментов, предназначенных для метаболической трансформации ксенобиотиков.
Высокую токсичность показывают некоторые полициклические эфиры фосфорной кислоты, получаемые на основе полиолов. Они блокируют хлорные каналы в нейронах, передающих сигналы торможения, но такую же токсич-ность показывают аналогичные полициклические простые эфиры, кремний-органические силатраны и циклические лактамы:
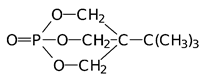
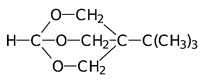
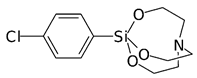
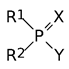
Формула Шрадера описывает общую структуру соединений с антихолинэстеразным механизмом биологической активности. В соответствии с этой формулой ингибиторами холинэстеразы являются производные кислот фосфора общей формулы:
 ,
,
где Х означает атом кислорода или серы, остатки R1 и R2 независимо один от другого означают алкильные, арильные группы, алкоксигруппы, арилокси-группы, алкилмеркаптогруппы, алкиламидные и ариламидные группы, а остаток Y означает уходящую группу, обеспечивающую перенос фосфориль-ной группы на соответствующий нуклеофильный структурный элемент в каталитическом центре холинэстеразы. При этом в роли заместителя Y должны выступать остатки слабых кислот, например, синильной, фтористоводородной кислоты, меркаптана, остаток фосфорной кислоты, это может быть замещенная электроноакцепторными заместителями арилоксигруппа и т. д. Вещества, не соответствующие формуле: Однако формула Шрадера не учитывает возможности образования токсич-ных соединений в результате так называемого «летального синтеза». Так, например, фенольная структурная единица действующего начала препарата лебайцид (О, О-диметил-О-(3-метил-4-метилмеркапто-фенил)тиофосфат) включает только электронодонорные заместители, но, тем не менее, это вещество проявляет высокую инсектицидную активность с токсичностью для крыс около 230 мг/кг. 
Другой механизм летального синтеза отвечает за антихолинэстеразную активность диметилового эфира 1-гидрокси-2, 2, 2-трихлорэтилфосфоновой кислоты с ЛД50 для крыс 560 мг/кг. Это соединение, известное под названием хлорофос, диптерекс и др., в присутствии даже слабых оснований претерпевает фосфонат-фосфатную перегруппировку с отщеплением молекулы хлористого водорода:

В результате дегидрохлорирования не соответствующий формуле Шрадера фосфонат превращается в фосфорилированный енол, который уже может выступать в качестве фосфорилирующего средства, поскольку в его составе появляется уходящая группа, соответствующая остатку слабой кислоты.
12. Реакция Виттига, получение трифенилфосфина, образование илидов трифенилфосфония, механизм реакции Виттига.
Одной из наиболее известных реакций, протекающих с участием фосфорорганических соединений, является реакция Виттига. Представляет собой взаимодействие алкилидентрифенилфосфоранов, образующихся при действии сильных оснований на соответствующие соли алкилтрифенилфосфония, с карбонильными соединениями (альдегидами и кетонами).
Реакция между алкилидентрифенилфосфораном и карбонильным соединением протекает с образованием нестабильного оксафосфетана, разлагающегося на трифенилфосфиноксид и непредельное соединение в виде Z-изомера по схеме:

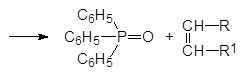
Реакция Виттига широко используется для получения полиненасыщенных природных соединений. В качестве примера можно привести синтез сквалена из геранилацетона и дифосфоранового соединения, образтирующегося из бисфосфониевой соли на основе 1, 4-дибромэтана и трифенилфосфина:
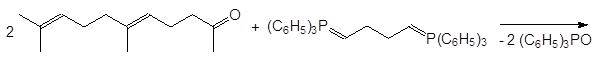
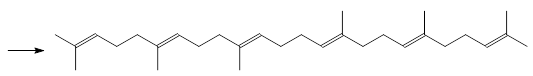
Исп. В крупномасштабном производстве, получение трифенилфосфина: 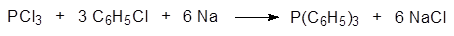
При действии бутиллития на иодид метилтрифенилфосфония образуется соединение, которое можно называть мет илид ом трифенилфосфония или метилентрифенилфосфораном: 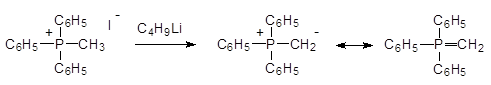
Такие илидные соединения используются в качестве реагентов для замены карбонильных атомов кислорода на алкилиденовые группы в реакциях Виттига.
Образование дибромметилида трифенилфосфония (дибромметилентрифенил-фосфорана): 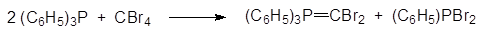
Это соединение может быть использовано в реакции Виттига с альдегидами для замены карбонильного атома кислорода на метилендибромидную группу. Например, именно так был впервые получен эфир кислоты, получившей затем название дельтаметриновой: 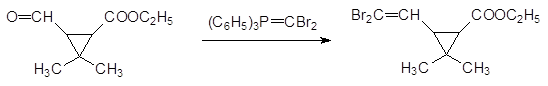
13. Механизм реакции Михаэлиса-Беккера, получение натриевой соли диалкилфосфористой кислоты, побочные реакции.
реакция Михаэлиса-Беккера представляет собой взаимодействие соли диалкилфосфористой кислоты с соответствующими алкилгалогенидами. В общем случае взаимодействие солей диалкилфосфористых кислот с алкилгалогенидами протекает с низким выходом и в соответствии с этим образующиеся фосфонаты сильно загрязнены различными примесями. В идеальном варианте эта реакция описывается последовательностью превращений:
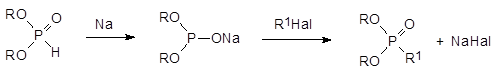
Однако на каждой из двух стадий, представленных этой схемой, образуются побочные продукты, которые крайне трудно отделить от целевого фосфоната. В начальном варианте реализации этого способа получения фосфонатов натриевые соли диалкилфосфористых кислот получали длительным нагреванием раствора диалкилфосфита в бензоле с металлическим натрием. При этом параллельно образованию натриевой соли идет её алкилирование диалкилфосфитом:

Образовавшийся в этой реакции диалкилфосфонат также может алкилировать соль диалкилфосфористой кислоты:
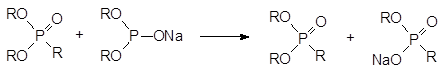
Следствием этого становится присутствие в реакционной массе по крайней мере трёх побочных продуктов – диалкилалкилфосфоната, натриевой соли моноалкилфосфита и натриевой соли моноалкилалкилфосфоната. В соответствии с этим выход получаемой таким способом натриевой соли диалкилфосфористой кислоты может составлять менее 70 %.
На следующей стадии полученная смесь натриевых солей диалкилфосфористой и моноэфиров фосфоновых кислот взаимодействует с соответствующим алкилгалогенидом R1Наl. При этом в реакцию с ним вступает не только натриевая соль диалкилфосфористой кислоты (RO)2РОNа, но и соли моноэфиров фосфористой и фосфоновой кислот, образовавшиеся на стадии получения соли диалкилфосфористой кислоты. все полученные полные эфиры фосфоновых кислот могут реагировать с галогенидом натрия с образованием алкилгалогенида RНаl:
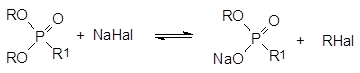
Этот алкилгалогенид также вступает в реакции алкилирования солей, и это ещё более осложняет состав реакционной массы. В общем случае продуктами реакции, кроме целевого диалкилфосфоната (RО)2Р(О)R1, становятся ещё и представленные выше соли и по крайней мере три алкилфосфоната:
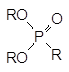
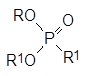
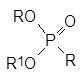
Кроме этих веществ в реакционной массе остаётся непрореагировавший диалкилфосфит, что практически полностью исключает выделение из неё целевого продукта в чистом виде.
В последнее десятилетие проводились опыты по проведению реакции Михаэлиса-Беккера в ионных жидкостях и при микроволновом облучении. Реакция Михаэлиса-Беккера была также реализована в условиях межфазного катализа с образованием соли диалкилфосфита при действии водной щелочи в присутствии бромида бензилтриэтиламмония. Проводились опыты и по изучению влияния растворителя на течение основной реакции. При этом оказалось, что при использовании таких высокополярных апротонных растворителей, как, например, диметилформамид (ДМФА), алкилирование солей диалкилфосфористых кислот идёт по атому кислорода и продуктами реакции становятся триэфиры фосфористой кислоты:
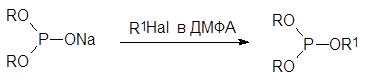
По типу реакции Михаэлиса-Беккера протекает взаимодействие диалкилфосфитов и ароматических галогенидов, в которых атомы галогенов активированы электроотрицательными заместителями:
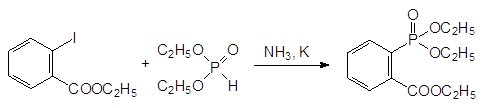
При этом, правда, не исключено, что реакция протекает по одному из механизмов ароматического нуклеофильного замещения.
14. Гербицидная активность фосфонометилглицина (глифосата). Способы его получения. Экологические последствия использования глифосата.
Гербицидная активность фосфонометилглицина была обнаружена при изучении биологической активности возможных продуктов метаболической трансформации бис(фосфонометил)глицина, который получают по реакции Кабачника-Филдса из фосфористой кислоты, формальдегида и глицина:
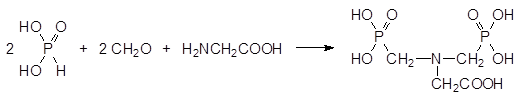
Это соединение предполагалось использовать для повышения урожайности сельскохозяйственных культур в качестве регулятора роста растений под названием Полярис.
Образование в природе: окислительное отщепление одной из фосфонометильных групп в молекуле бис(фосфонометил)глицина:
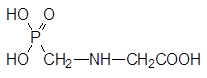
Исследование биологической активности этого вещества показало, что оно показывает очень хорошие гербицидные свойства, останавливая биосинтез фенилаланина и триптофана.
В клетках растений имеется специальной комплекс ферментов, обеспечи-вающих биосинтез фенилаланина, триптофана и тирозина. Ключевым этапом в этом биосинтезе является взаимодействие 3-фосфошикимовой кислоты с фосфоенолпируватом с образованием в конце концов хоризмовой кислоты (из неё образуется фенилаланин, а через антраниловую кислоту образуется триптофан):
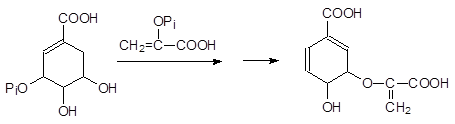
Представленная реакция – это единственное известное биохимическое превращение, в котором фосфоенолпируват участвует в протонированном виде, а у фосфонометилглицина атом азота протонируется гораздо легче, чем атом кислорода в фосфоенолпирувате:
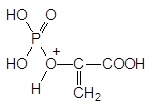 и
и 
Один из способов получения глифосата представлен реакцией конденсации N‑ монозамещенных глицинов с фосфористой кислотой или её диэфирами и формальдегидом:
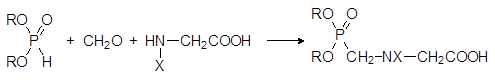
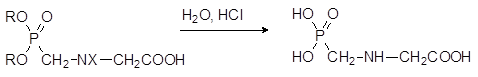
В роли заместителей Х при этом выступают остатки, образующие стабилизированный электронодонорным эффектом карбокатион (бензильная, бензгидрильная, трет-бутильная и другие группы). При нагревании с сильными кислотами продукты конденсации диалкилфосфитов с формальдегидом и глицином отщепляют эфирные группы у атома фосфора и защитную группу Х.
Были разработаны и другие синтетические подходы к фосфонометилглицину, однако в настоящее время основной способ получения этого вещества представлен цепочкой превращений, начинающихся с диэтаноламина, который дегидрируют в присутствии гидроксида натрия на катализаторе из меди Ренея (скелетная металлическая медь, получаемая выщелачиванием сплава меди и алюминия). К полученному в реакции дегидрирования раствору соли иминодиукусной кислоты осторожно прибавляют трихлорид фосфора, при этом идет его гидролиз до фосфористой кислоты и нейтрализация реакционной массы образующимся хлористым водородом. После этого прибавляют водный раствор формальдегида и по реакции Кабачника-Филдса получают фосфонометилиминодиуксусную кислоту:
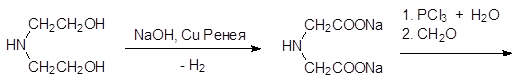
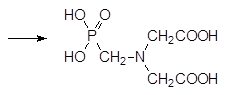
Фосфонометилиминодиуксусную кислоту окисляют пероксидом водорода в присутствии вольфрамата или молибдата аммония до соответствующего N‑ оксида и разлагают его сульфатом железа(II):
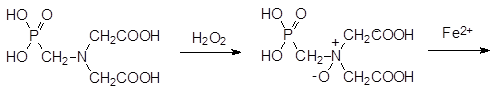
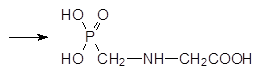
Поиск более экологичных способов получения глифосата из фосфонометилиминодиуксусной кислоты завершился разработкой катализируемого активированным углем отщепления одной из карбоксиметильных групп кислородом в качестве окислителя в соответствии со схемой:
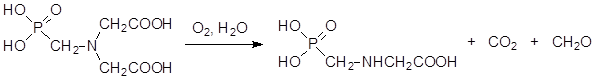
Широкие масштабы использования глифосата требуют очень тщательного изучения возможных последствий воздействия на человека и окружающую среду даже небольших доз этого вещества. Такие исследования были проведены Европейским Союзом и на их основании глифосат был признан абсолютно безопасным агрохимическим препаратом.
токсикологическая проблема глифосата связана с хорошей комплексообразующей способностью. В регионах с повышенным содержанием в почве тяжелых металлов (мышьяк, кадмий и др. ), где употребляют воду из источников, в которые она может попадать с обработанных глифосатом селькохозяйственных угодий, отмечено большое число заболеваний почек со смертельным исходом.
Глифосат представляет собой гербицид сплошного действия, однако, что почвенная бактерия Agrobacterium tumefaciens, вызывающая у растений образование аналогичных опухолям галлов, переносит в их геном свой ген 5-енолпируват-шикимат-З-фосфатсинтазы (EPSPS), кодирующий учтойчивый к действию глифосата фермент. В результате такой трансформации были получены устойчивые к глифосату генетически модифицированные сорта кукурузы. Технология выращивания таких культур значительно упрощается, поскольку гербицид становится избирательным, поражая только сорные растения. Это стимулирет выращивание такой генетически модифицированной кукурузы и увеличивает спрос на фосфонометилглицин. Такой естественный путь получения трансгенных растений лежит, очевидно, и в основе появления устойчивых к глифосату сорняков.
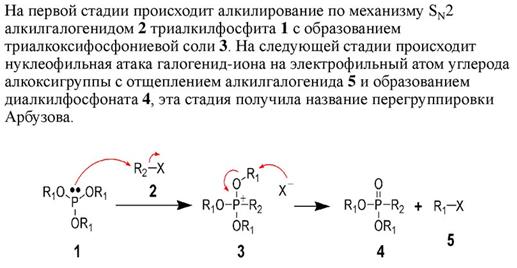
15. Механизм реакции Михаэлиса-Арбузова, реакционная способность исходных соединений, побочные реакции.
Механизм реакции Михаэлиса-Арбузова
Взаимодействие триалкилфосфитов с алифатическими галогенидами (реакция Михаэлиса-Арбузова) протекает обычно при температурах С по схеме:
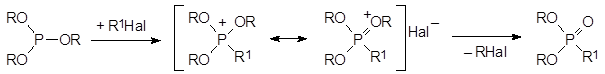
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|