
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Реакционная способность
В соответствии с поляризуемостью связи атома галогена с атомом углерода алифатического остатка реакционная способность алкилгалогенидов увеличивается в ряду R1Cl < R1Br < R1I. Строение остатка R1 в значительной мере влияет на реакционную способность галогенида в этом превращении. Так, например, алкилхлориды лишь в очень жестких условиях вступают в реакцию с триалкилфосфитами, тогда как, эфиры бромуксусной кислоты или бензилхлорид реагируют с эфирами кислот трикоординированного фосфора достаточно легко.
Полные эфиры алкилфосфонистых RP(OR1)2 и диалкилфосфинистых кислот R2P(OR1), а также эфироамиды отличаются более высокой реакционной способностью в реакции Михаэлиса-Арбузова в сравнении с триалкилфосфитами, например:
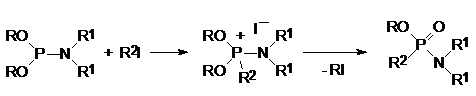
Силильная эфирная группа повышает нуклеофильность атома фосфора, ускоряя течение реакции Михаэлиса-Арбузова. В соответствии с этим реакционная способность увеличивается в ряду:
(RO)3P < (RO)2POSi(CH3)3 < ROP(OSi(CH3)3)2 < P(OSi(CH3)3)3
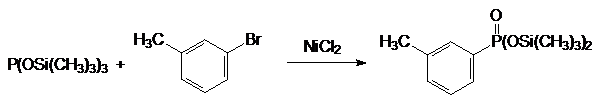
Нуклеофильность трисилилфосфитов настолько велика, что в присутствии хлорида никеля они могут реагировать даже с ароматическими галогендами, например:
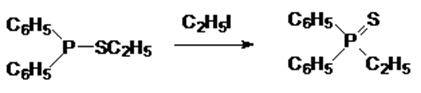
В реакцию с алкилгалогенидами могут вступать и тиоэфиры кислот трикоординированного фосфора, причем при отсутствии О-эфирных групп в такой реакции образуются тионные производные. Так, например, этиловый эфир дифенилтиофосфи-нистой кислоты в реакции с этилиодидом превращается в дифенил-этилфосфинсульфид:
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|