
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ЕГЭ Теория и практика Задания №21. Гидролиз
ЕГЭ Теория и практика Задания №21. Гидролиз
Гидролиз — разложение с помощью воды. В задании №21 речь идет только о гидролизе солей
Соль состоит из катиона металла или NH₄ ⁺ и кислотного остатка и образуется в результате взаимодействия гидроксида и кислоты. Поэтому можно выделить 4 вида солей:
- Соль образована сильным гидроксидом и сильной кислотой
- Соль образована слабым гидроксидом и сильной кислотой
- Соль образована сильным гидроксидом и слабой кислотой
- Соль образована слабым гидроксидом и слабой кислотой
Каждый из типов солей будет гидролизовать по-своему, но об этом немного позже
Для решения задания на гидролиз четко нужно знать сильные/слабые кислоты и гидроксиды:
- Сильные кислоты: HCl, HBr, HI, H₂ SO₄, HNO₃, HHalO₄, HHalO₃, HMnO₄, H₂ Cr₂ O₇, H₂ CrO₄
- Слабые кислоты: HF, H₂ S, H₂ SO₃, HNO₂, H₃ PO₄, H₂ CO₃, H₂ SiO₃, HHalO₂, HHalO + все органические кислоты
- Сильные гидроксиды: щелочи (гидроксиды щелочных и щелочноземельных металлов)
- Слабые гидроксиды: все остальные гидроксиды
Кислотность среды
Перед тем как перейдем к разбору гидролиза, надо сначала поговорить о кислотности среды
Кислотность среды характеризуется показателем кислотности (pH) и определяется по формуле pH = -lg[H⁺ ]. То есть, чем больше концентрация H⁺, тем pH меньше. pH изменяется в пределах от 0 до 14
- pH < 7 → среда раствора кислая
- pH = 7 → среда раствора нейтральная
- pH > 7 → среда раствора щелочная
Кислотность среды можно определить с помощью индикатора. Если поместить его в раствор, то цвет индикатора изменится в зависимости от кислотности раствора
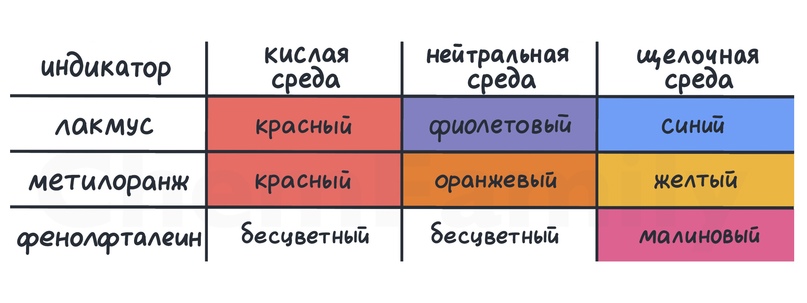
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|