
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
10. Участие в гибридизации d-орбиталей.
10. Участие в гибридизации d-орбиталей.
· Если энергии орбиталей одного из d-подуровней атома не очень сильно отличаются от энергий s- и p-орбиталей, то d-орбитали также могут участвовать в гибридизации.
· Самым распространённым типом гибридизации с участием d-орбиталей является sp3d2-гибридизация, в результате которой образуется шесть равноценных по форме и энергии гибридных облаков:
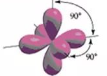 (октаэдр)
(октаэдр)
гибридные облака направлены к вершинам октаэдра, в центре которого находится ядро атома.
Октаэдр – это правильный восьмигранник. Все рёбра в нём равной длины, а все грани – правильные треугольники.
· Реже встречается sp3d-гибридизация, в результате которой образуется пять гибридных облаков, направленных к вершинам тригональной бипирамиды.
· Тригональная бипирамида – это две равнобедренные пирамиды, соединённые общим основанием. Основание – правильный треугольник:
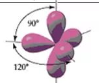 (тригональная бипирамида)
(тригональная бипирамида)
Метод Гиллеспи
1. Уточнения к методу Гиллеспи.
1) Облако двойной и тройной связи не разделяется, но они занимают больше места в пространстве, чем облако однократной связи.
2) НЭП занимает большее пространство, чем пара электронов, дающая связь.
3) Облако полярной связи занимает большее место вблизи более электроотрицательного атома.
2. Процедура метода.
А – обозначение центрального, самого многовалентного атома
В – обозначение любого партнёра А по химической связи
Е – обозначение НЭП атома А
n – число атомов В
m – число свободных пар А
Таким образом, любая частица (молекула, ион) сворачивается в запись ABnEm.
Считается (n+m), находится исходная модель, далее «отбрасываются» свободные пары и определяется собственно геометрия молекулы.
При определении геометрии удобно пользоваться следующей таблицей:
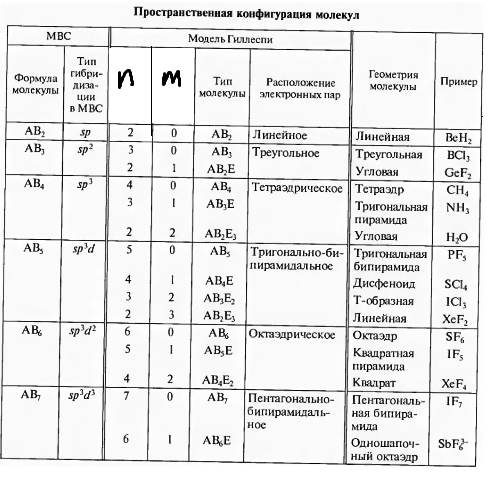
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|