
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Гибридизация. 1. Определение.
Гибридизация
1. Определение.
Гибридизация – это выравнивание (усреднение) энергии у атома различных атомных орбиталей в результате смешения перед химическим взаимодействием (или в его процессе), что приводит к образованию гибридных орбиталей.
2. Зачем понадобилось вводить гибридизацию?
Приведём примеры:
· В молекуле H2O атом кислорода образует две σ -связи с атомами водорода за счёт р-облаков внешнего энергетического слоя, ориентированных взаимно перпендикулярно. Следовательно, угол связи Н-О-Н должен быть близок к 90⁰:
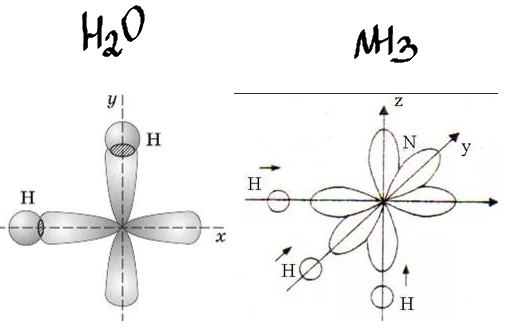
· В молекуле NH3 углы между связями, образованными тремя р-орбиталями атома азота, также должны быть близкими к 90⁰.
Однако экспериментально определенные валентные углы (104, 5⁰ в молекуле H2O и 107, 3⁰ в молекуле NH3 отличаются от рассчитанных.
· Рассмотрим молекулу CH4.
Атом углерода в возбуждённом имеет четыре неспаренных электрона: один на s-орбитали и три на р-орбиталях. В результате должны образоваться четыре ковалентные связи. Три из них должны быть s-p-связями, образованными за счёт перекрывания р-облаков углерода и s-облаков водорода. Эти связи должны иметь равную длину, энергию и располагаться под углами 90⁰ друг к другу. Четвёртая связь должна образоваться за счёт перекрывания s-облака атома углерода и s-облака атома водорода. В результате этого перекрывания должна образоваться связь, отличающаяся от трёх других длиной и энергией. Однако точно установлено, что в CH4 все связи равноценны по длине и энергии, а угол между связями равен 109⁰ 28ʹ.
Таким образом, есть проблема, решить которую метод валентных связей не может!
Есть проблема → надо искать решение! Решение проблемы может быть найдено только введением новой концепции!
Эта концепция получила название гибридизация атомных орбиталей.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|