
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Вариант 3
Вариант 2
Четырёхкомпонентная схема, длительность терапии 10—14 дней:
· один из ИПН в «стандартной дозировке» +
· висмута трикалия дицитрат (по 120 мг 4 раза в день) +
· амоксициллин (500 мг 4 раза в день или 1000 мг 2 раза в день) +
· нитрофурановый препарат: нифурател (400 мг 2 раза в день) или фуразолидон (100 мг 4 раза в день).
Вариант 3
Четырёхкомпонентная схема, длительность терапии 14 дней:
· один из ИПН в «стандартной дозировке» +
· висмута трикалия дицитрат (по 120 мг 4 раза в день) +
· амоксициллин (500 мг 4 раза в день или 1000 мг 2 раза в день) +
· рифаксимин (400 мг 2 раза в день).
Третья линия
Проводится только при отсутствии результата от эрадикации Нр по второй линии и после определения чувствительности микроорганизма к определённым антибиотикам.
№2
Быстрый уреазный тест нельзя использовать после лечения HP, так как его чувствительность будет снижена.
Для контроля эрадикации, который проводят через 4-6 недель после окончания эрадикационной терапии, лучше всего применять С-уреазный дыхательный тест или определение антигена Н.pylori в кале. Во избежание ложноотрицательных результатов прием ИПП необходимо прекратить за 2 недели до предполагаемого контрольного исследования. Кроме того, отрицательный результат исследования на инфекцию Н.pylori должен быть обязательно подтвержден другим методом диагностики.(уровень доказательности 2а; класс рекомендация В)
№3
Диагноз инфекции Helicobacter pylori
Диагностические тесты для определения инфекции Hp включают как эндоскопические, так и неэндоскопические методы.
Используемые методики могут быть прямыми (исследование культуры, микроскопическое определение организма) или непрямыми (использование уреазы, определение антигена в кале, или ответ антитела, как маркера заболевания). Выбор теста зависит в большой степени от его доступности и стоимости, и включает различие между методами в возможности определения заболевания и использования результатов для подтверждения эрадикации. Другие важные факторы – это клиническая картина, популяционная частота инфицирования, предполагаемое заранее наличие инфекции, различия в тестовых результатах и факторы, влияющие на результат тестов, например, применение антисекреторных препаратов и антибиотиков.
А) Доказательства наличия инфекции
Быстрый уреазный тест : чувствительность 98%
Гистология 95%
Культура
ПЦР – не стандартизирован, экспериментальный метод
Серологическое исследование методом ELISA 85-92%
Дыхательный тест с мочевиной 95%
Анализ АГ в кале 95%
Б) оценка эффективности лечения
Дыхательный тест с мочевиной 95%
Анализ АГ в кале 95%
Бактериологический метод
Он позволяет выделить чистую культуру Н.pylori, провести ее идентификацию, изучить морфологические, биохимические и биологические свойства бактерий. В эпидемиологической практике выделение чистой культуры Н.pylori необходимо для внутривидового типирования штаммов, что может быть использовано при мониторинге для дифференциации между реинфекцией новым штаммом и рецидивированием инфекции, которое может быть обусловлено тем же штаммом. В научной практике бактериологический метод важен, так как позволяет изучать факторы патогенности Н.pylori и изготовлять препараты для серологической диагностики. Как и любой метод диагностики, бактериологический метод исследования обладает не только достоинствами, но и недостатками, которые зачастую ограничивают его широкое использование в клинической практике. К недостаткам этого метода относятся, прежде всего, необходимость специального лабораторного оборудования, реактивов, специальных питательных сред, а также обученных специалистов. Все это сопряжено с большими материальными затратами. Результаты бактериологического исследования отсрочены от момента взятия биопсийного материала минимум на 3–5 дней, а при необходимости получения данных о чувствительности Н.pylori к антибактериальным препаратам длительность исследования увеличивается и составляет в среднем 6–7 дней. Кроме того, для проведения бактериологического исследования необходимо проведение эзофагогастродуоденоскопии с забором биопсийного материала.
Уреазный дыхательный тест (УДТ) основан на способности уреазы разлагать мочевину до НСО3I и NH4+. Из НСО3I образуется СО2, который попадая в кровоток затем транспортируется в легкие. Для проведения УДТ необходима мочевина, меченная радиоактивным углеродом 13С или 14С. Чаще в клинической практике используется нерадиоактивный стабильный углерод 13С. 14С используется реже, так как является источником излучения низкоэнергетических β-частиц, которые обнаруживаются сцинтиляционным счетчиком. Изотоп количественно определяют газовым спектрометром. В начале исследования берутся две фоновые пробы выдыхаемого воздуха. Далее пациент съедает легкий завтрак и тестовый субстрат и в течение одного часа, с интервалом в 15 минут у него берут по четыре пробы выдыхаемого воздуха. Уровень радиоактивного изотопа в выдыхаемом воздухе определяется в течение 10–30 минут. Затем пробирки направляются на масс-спектрометрию. Результат выражается как приращение 13СО2 — д13СО2, его экскреция (%о) и считается положительным при значениях выше 5%о. В ряде стран используется определение изотопического отношения концентраций 13СО2/12СО2, что позволяет свести к минимуму влияние на конечный результат методических и инструментальных погрешностей.
Быстрый урезаный тест основан на определении в биоптате слизистой оболочки желудка местной уреазной активности H.pylori. Быстрота изменения окраски индикатора (с желтого цвета на красный или малиновый) зависит от уреазной активности, которая в свою очередь зависит от количества бактерий. К недостаткам теста относится его инвазивность, невозможность морфологической оценки состояния слизистой оболочки желудка, а также получение ложноотрицательных (при малом количестве микробных тел) или ложноположительных результатов (контаминирование материала другими уреазопродуцентами, например H.heilmannii — грамм-негативной спиралевидной бактерии рода Helicobacter, которую возможно обнаружить у 0,25% пациентов при проведении гастроскопии [12]).
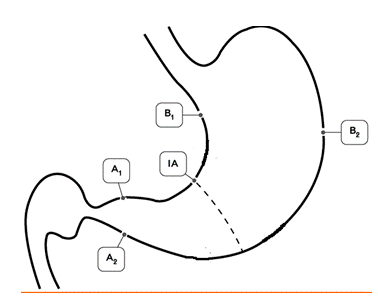
Гистологический метод — золотой стандарт диагностики инфекции H.pylori, который является наиболее объективным методом, так как позволяет обнаружить возбудитель инфекции, определить положение бактериальных тел в слизи, покрывающей слизистую оболочку желудка, наблюдать взаимоотношение Н.pylori с апикальной мембраной эпителиоцитов, а также определить пути взаимодействия бактерии с тканями макроорганизма. Забор биопсийного материала производится из зон слизистой оболочки желудка с признаками наиболее активного воспалительного процесса (максимально выраженная гиперемия и отeк). Биопсия и забор материала для диагностики инфекции из области дна язв и эрозий, а также из их краев, является ошибкой, так как в них нет эпителиальных клеток, обладающих свойствами, необходимыми для адгезии и колонизации Н.pylori. Поскольку бактерии Н.pylori могут быть распределены неравномерно в различных отделах желудка, для повышения чувствительности метода, а также для оценки состояния слизистой оболочки и определения типа и локализации гастрита, степени его выраженности биоптаты целесообразно брать из антрального, фундального отделов, а также области угла желудка.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|