
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Слабые электролиты. Степень диссоциации. Константа диссоциации.
17) Слабые электролиты. Степень диссоциации. Константа диссоциации.
Количественной характеристикой силы электролита является степень электролитической диссоциации α, которая равна отношению количества молекул, распавшихся на ионы, к общему числу молекул растворенного вещества в растворе. α = Nдисс/N
В зависимости от степени диссоциации все электролиты делятся на сильные, средней силы b слабые. Если α < 5 %, то вещества относятся к слабым электролитам.Диссоциация слабых электролитов - обратимый процесс. Воспользуемся уравнением диссоциации азотистой кислоты (HNO2 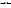 H+ + NO2-).
H+ + NO2-).
В растворе слабого электролита существует химическое равновесие между молекулярной и ионной формами вещества. Количественной характеристикой любого химического равновесия является константа равновесия, которая по отношению к процессу электролитической диссоциации называется константой диссоциации . Кд = [Н+] *[NО2- ]/[HNO2]
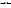 H+ + NO2-) Молярная концентрация кислоты в растворе равна См. В условиях равновесия при степени электролитической диссоциации (α) концентрация распавшихся на ионы молекул составит α * См. В условиях равновесия концентрация частиц кислоты, оставшихся в молекулярном виде, будет равна (СМ - α *СМ) = (1 - α) • См. Подставляя указанные равновесные концентрации продуктов диссоциации и молекул в выражение для константы диссоциации, получим Кд, = α*См* α*См/((1- α). Для слабых электролитов α « 1, Кд ≈ α ² *См, отсюда α = (Кд/См)в степени ½ -закон разведения Оствальда.
H+ + NO2-) Молярная концентрация кислоты в растворе равна См. В условиях равновесия при степени электролитической диссоциации (α) концентрация распавшихся на ионы молекул составит α * См. В условиях равновесия концентрация частиц кислоты, оставшихся в молекулярном виде, будет равна (СМ - α *СМ) = (1 - α) • См. Подставляя указанные равновесные концентрации продуктов диссоциации и молекул в выражение для константы диссоциации, получим Кд, = α*См* α*См/((1- α). Для слабых электролитов α « 1, Кд ≈ α ² *См, отсюда α = (Кд/См)в степени ½ -закон разведения Оствальда.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|