
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Давление пара растворителя над раствором. Закон Рауля.
| 1.Эквивалент. Эквивалентная масса. Эквивалентный объём (привести примеры). Закон эквивалентов. Эквивалент – величина, которая в целое число раз меньше или равна структурной или формульной единице вещества. Молярная масса эквивалента (эквивалентная масса) вещества С – произведение фактора эквивалентности на молярную массу этого вещества. Эс = Fэкв * Мс. Эквивалентная масса элемента Ээ – отношение молярной массы элемента М к его окислительному числу В в этом соединении. Ээ = М/B (г/моль). ЭМ оксида – сумма эквивалентных масс и кислорода. Эок = Ээ + Эо. ЭМ соли - отношение молярной массы соли к произведению числа атомов n металла на его валентность В. Эс = Мс/ (n*В). ЭМ основания – отношение молярной массы кислоты к числу заменённых гидроксогрупп чзОН. Эос = Мос/ чзОН. ЭМ кислоты – отношение молярной массы кислоты к числу заменённых атомов водорода чз Н. Эк = Мк/ чзН. Эквивалентный объём С – объём, который занимает эевавалент вещества С. Он может быть найден делением эквивалентной массы Эс вещества на плотность pc или делением объёма Vc на число эквивалентов nэкв(С) этого вещества. Vэкв(С) = Эс/ pc (л/моль).Vэкв(С) = VС/ nэкв(С) Пример. При нормальных условиях один моль любого газа занимает объём 22,4 л. Масса газа равна молярной массе Мс, плотность pc= Мс/22,4 г/л, отсюда эквивалентный объём газа С составляет: Vэкв(С) = 22,4 * Эс/Мс (л/моль). Закон эквивалентов – если два вещества взаимодействуют без остатка, то число эквивалентов одного вещества соответствует числу эквивалентов второго. | 2. Примеры расчёта эквивалента элемента, оксида, основания, кислоты, соли, окислителя, восстановителя. Эквивалентная масса элемента. Ээ = М/B (г/моль) Пример. Определим экв массу серы в H2SO4. Окислительное число серы Bs в H2SO4 равно 6. По формуле эквивалента масса серы равна: Эs = Мs/В = 32/6 = 5.33 г/моль. Эквивалентная масса оксида. Эок = Ээ + Эо. Пример. Определим эквивалентную массу оксида алюминия Al2O3. 27/3 + 16/2 = 17 г/моль. Эквивалентная масса соли. Эс = Мс/ (n*В)Определим эквивалентную массу хлорида цинка ZnCl2. 65+35+35/ 1*2 = 117,5 г/моль. Эквивалентная масса основания. Эос = Мос/ чзОНПример. Определим эквивалентную массу гидроксида натрия NaOH. 23+16+1/ 1 = 40 г/моль. Эквивалентная масса кислоты. Эк = Мк/ чзНПример. Определим эквивалентную массу хлороводорода HCL. 1+35/1= 36 г/моль. Эквивалентная масса окислителя. Эох = Мох/ z Пример. +6 +4 +3 +6 K2Cr2O7 + 3Na2SO3 + 4H2SO4 = Cr2(SO4)3 + 3Na2SO4 + K2SO4 + 4H2O Окислителем в этой реакции является K2Cr2O7 Cr2O72- + 14Н+ + 6ē = = 2Cr3+ + 7Н2О Э(K2Cr2O7)=294/6=49 Эквивалентная масса восстановителя.Эred = Mred/z Пример. +6 +4 +3 +6 K2Cr2O7 + 3Na2SO3 + 4H2SO4 = Cr2(SO4)3 + 3Na2SO4 + K2SO4 + 4H2O восстановителем в этой реакции является Na2SO3. SO32- + Н2О - 2ē = SO42- + 2Н+ Э(Na2SO3) =126/2=63 | 3. Основные термодинамические характеристики. 1-й, 2-й и 3-й законы химической термодинамики.
Термодинамика - раздел химии, изучающий превращение энергии в хим процессах. Термодинамические системы - совокупность тел, которые энергетически могут взаимодействовать с другими телами и обмениваться с ними в-вом, мысленно или реально отделена от окружающей среды. Равновесие системы - когда её состав и свойства длительное время не изменяются.Гомогенная система - все входящие в неё вещества находятся в одинаковом агрегатном состоянии. Гетерогенная система - входящие в неё в-ва находятся в разном агрегатном состоянии.Закрытая система - её масса остаётся постоянной, энергия может изменяться.Открытая система - изменяется масса и энергия.Термодинамические параметры - величины, которыми характеризуется состояние термодинамической системы. (Температура, давление, плотность)Экстенсивные параметры – зависят от массы или объёма вещества. (Внутр энергия, энтропия)Интенсивные параметры – не зависят от объёма и массы вещества. (Давление, плотность, концентрация) Термодинамические процессы - всякое изменение системы, связанное с изменением хотя бы одного термодинамического параметра. Обратимые и необратимые. Равновесные и неравновесные. При постоянной температуре – изотермические, при постоянном давлении – изобарные, при постоянном объёме – изохорные. Термодинамический обратимый – процесс после которого система и окр среда могут возвратиться в изначальное состояние.Необратимый – при протекании которого в прямом или обратном направлении в окр среде или в системе остаются изменения. Энтальпия системы (Н) – величина, равная сумме внутренней энергии и произведения объёма на давление. Н = U+р*V Её изменение определяется лишь начальным и конечным состоянием системы и не зависит от пути процесса.Первый закон термодинамики. Первый закон термодинамики является экспериментальным, представляя собой частный случай закона сохранения и превращения энергии в применении к процессам, протекающим с выделением, поглощением или преобразованием теплоты. В нём говорится:Количество теплоты, переданное системе, идёт на изменение внутренней энергии системы и на совершаемую системой работу против внешних сил.Q = ∆U+ W Рассмотрим выражение этого закона применительно к процессам, протекающим при различных условиях.При изобарном процессе давление р не изменяется: Qр = ∆U+р*∆V=∆Н.Где ∆V=V2-V1- изменение объёма, V1 и V2 – объём системы в начальном и конечном состояниях.При адиабатическом процессе отсутствует теплообмен с окружающей средой, т.е. Q=0:р*∆V= -∆U
Откуда следует, что работа производится за счёт убыли внутренней энергии системы.При изохорном процессе объём системы не изменяется, ∆V=0:Qv=∆UСледовательно, вся сообщённая системе теплота идёт на изменение внутренней энергии системы.Второй закон термодинамики.Энтропия (S) – функция, полный дифференциал которой равен отношению элементарного количества теплоты равновесного процессов к абсолютной температуре.dS=  Q/T
Энтропия является аддитивной величиной: энергия системы равна сумме значений энтропии её компонентов. В равновесных адиабатических (процесс, при котором система не получает теплоты извне и не отдаёт её) процессах энтропия системы не изменяется. В равновесных изотермических процессах изменение энтропии системы ∆S равно отношению теплоты процесса Q к температуре Т.∆S = Q/Т. В изобарно-изотермическом процессе изменение энтропии связано с изменением энтальпии системы соотношением ∆S =∆Н/Т.Второй закон термодинамики характеризует направленность реальных, необратимых процессов теплообмена: Невозможен процесс, единственным результатом которого является передача энергии в форме теплоты от тела менее нагретого к телу более нагретому. Возможны лишь такие процессы, которые ведут к увеличению энергии изолированной системы: ∆S≥ 0 (неравенство Клаузиуса) Равенство ∆S=0 справедливо только для идеальной обратимой системы. В природе полностью обратимых систем не существует. Больцман связал энтропию с термодинамической вероятностью состояния системы: Энтропия S пропорциональна натуральному логарифму термодинамической вероятности состояния Р системы S = k * lnP+ const,
где k – постоянная Больцмана Изменение энтропии системы при протекании процесса связано с изменением термодинамической вероятности состояния системы соотношением: S = k * ln(Р2/Р1) Термодинамическая вероятность состояния изолированной системы в случае обратимых процессов остаётся постоянной ∆S=0, Р2/Р1=1 А в случае необратимых – возрастает ∆S>0, Р2/Р1>1 Таким образом, второй закон имеет систематический характер. Он справедлив для систем, содержащих большое число частиц. Он применим к процессам жизнедеятельности. В процессе жизнедеятельности живой ограним накапливает отрицательную энтропию. Увеличивает энтропию в окр среде, а в себе понижает.Третий закон термодинамики. В реакциях, протекающих между чистыми кристаллическим или жидкими веществами в области температур, близких к абсолютному нулю, энтропия системы практически не изменится. Отсюда вытекает теорема Нернста: В конденсированных системах при абсолютном нуле и вблизи него процесс протекает без изменения энтропии. Q/T
Энтропия является аддитивной величиной: энергия системы равна сумме значений энтропии её компонентов. В равновесных адиабатических (процесс, при котором система не получает теплоты извне и не отдаёт её) процессах энтропия системы не изменяется. В равновесных изотермических процессах изменение энтропии системы ∆S равно отношению теплоты процесса Q к температуре Т.∆S = Q/Т. В изобарно-изотермическом процессе изменение энтропии связано с изменением энтальпии системы соотношением ∆S =∆Н/Т.Второй закон термодинамики характеризует направленность реальных, необратимых процессов теплообмена: Невозможен процесс, единственным результатом которого является передача энергии в форме теплоты от тела менее нагретого к телу более нагретому. Возможны лишь такие процессы, которые ведут к увеличению энергии изолированной системы: ∆S≥ 0 (неравенство Клаузиуса) Равенство ∆S=0 справедливо только для идеальной обратимой системы. В природе полностью обратимых систем не существует. Больцман связал энтропию с термодинамической вероятностью состояния системы: Энтропия S пропорциональна натуральному логарифму термодинамической вероятности состояния Р системы S = k * lnP+ const,
где k – постоянная Больцмана Изменение энтропии системы при протекании процесса связано с изменением термодинамической вероятности состояния системы соотношением: S = k * ln(Р2/Р1) Термодинамическая вероятность состояния изолированной системы в случае обратимых процессов остаётся постоянной ∆S=0, Р2/Р1=1 А в случае необратимых – возрастает ∆S>0, Р2/Р1>1 Таким образом, второй закон имеет систематический характер. Он справедлив для систем, содержащих большое число частиц. Он применим к процессам жизнедеятельности. В процессе жизнедеятельности живой ограним накапливает отрицательную энтропию. Увеличивает энтропию в окр среде, а в себе понижает.Третий закон термодинамики. В реакциях, протекающих между чистыми кристаллическим или жидкими веществами в области температур, близких к абсолютному нулю, энтропия системы практически не изменится. Отсюда вытекает теорема Нернста: В конденсированных системах при абсолютном нуле и вблизи него процесс протекает без изменения энтропии.
|
4. Энергия Гиббса. Направленность протекания самопроизвольных химических процессов.
Энергия Гиббса – это изобарно-изотермический потенциал. Термодинамические потенциалы – функции параметров системы, выражающие термодинамические свойства системы. Для изобарных процессов (р= const) соотношение имеет вид  W` ≤ -d ( H- T * S) – S * dT W` ≤ -d ( H- T * S) – S * dT  W` ≤ -dG – S *dT,где W` ≤ -dG – S *dT,где  W` = W` =  W – p * dV – элементарная работа изобарного процесса, G = ( H- T * S) – энергия Гиббса. Работа изобарно-изотермического процесса связана с изменением энергии Гиббса соотношением W – p * dV – элементарная работа изобарного процесса, G = ( H- T * S) – энергия Гиббса. Работа изобарно-изотермического процесса связана с изменением энергии Гиббса соотношением  W` ≤ -dG, W` ≤ -∆G, W` ≤ -(G2 – G1) W` = -∆G – обратимый процесс W`< -∆G – необратимый процесс Из этого следует, что максимальная работа изобарно-изотермического процесса равна убыли свободной энергии системы. В изотермических условиях ( Т = const) энтальпия системы равна сумме свободной G и связанной энергии Т * S. Н = G + Т * S. В изотермическом процессе свободная энергия системы может быть передана в форме работы, а связанна энергия представляет ту часть энтальпии, которая не может быть передана в форме работы процесса. Направленность химических процессов.
Энергия Гиббса может быть записана: G = Н- Т * S. Или ∆G = ∆Н- Т * S. В общем случае изменение свободной энергии ∆G при протекании процесса характеризует энергию, которая может быть доступной для совершения работы, в то время как система стремится к равновесию.
Для изолированной системы, которая не находится в состоянии термодинамического равновесия, при постоянных значениях давлении и температуры ∆G = - W`. Величина -∆G является движущей силой химического процесса. По мере приближения к равновесному состоянию системы движущая сила процесса -∆G уменьшается. В равновесном состоянии ∆G=0.Системы, не находящиеся в равновесии, претерпевают самопроизвольные изменении, только если при этом свободная энергия уменьшается. Когда равновесие достигнуто, никакого дальнейшего самопроизвольного изменения свободно энергии системы происходить не может. В равновесном состоянии количество доступной свободной энергии равно нулю. W` ≤ -dG, W` ≤ -∆G, W` ≤ -(G2 – G1) W` = -∆G – обратимый процесс W`< -∆G – необратимый процесс Из этого следует, что максимальная работа изобарно-изотермического процесса равна убыли свободной энергии системы. В изотермических условиях ( Т = const) энтальпия системы равна сумме свободной G и связанной энергии Т * S. Н = G + Т * S. В изотермическом процессе свободная энергия системы может быть передана в форме работы, а связанна энергия представляет ту часть энтальпии, которая не может быть передана в форме работы процесса. Направленность химических процессов.
Энергия Гиббса может быть записана: G = Н- Т * S. Или ∆G = ∆Н- Т * S. В общем случае изменение свободной энергии ∆G при протекании процесса характеризует энергию, которая может быть доступной для совершения работы, в то время как система стремится к равновесию.
Для изолированной системы, которая не находится в состоянии термодинамического равновесия, при постоянных значениях давлении и температуры ∆G = - W`. Величина -∆G является движущей силой химического процесса. По мере приближения к равновесному состоянию системы движущая сила процесса -∆G уменьшается. В равновесном состоянии ∆G=0.Системы, не находящиеся в равновесии, претерпевают самопроизвольные изменении, только если при этом свободная энергия уменьшается. Когда равновесие достигнуто, никакого дальнейшего самопроизвольного изменения свободно энергии системы происходить не может. В равновесном состоянии количество доступной свободной энергии равно нулю.
| 5.Термохимический закон Гесса. Тепловой эффект реакции. Тепловой эффект реакции – процесс протекания любой химической реакции при постоянном объёме или постоянном давлении, сопровождающийся выделением или поглощением кол-ва теплоты Q. При постоянном давлении тепловой эффект хим реакции равен энтальпии ∆Н. При экзотермических реакциях энтальпия системы понижается ∆Н<0, тепловой эффект реакции имеет отрицательный знак Q<0. Выделившиеся кол-во теплоты расходуется на нагревание хим системы и окр среды. Закон Гесса является законом сохранения энергии в химических реакциях. Закон Гесса – тепловой эффект химической реакции не зависит от пути реакции, а зависит только от вида и начального и конечного состоянии вещества. для реакции с постоянным давлением тепловой эффект равен изменению энтальпии химической системы в результате протекания реакции. Из закона Гесса следует, что изменение энтальпии системы в химической реакции ∆Н равно разности между суммарным значением энтальпии продуктов реакции ∆Н2 и суммарным значением энтальпии исходных веществ суммарным значением энтальпии ∆Н1. ∆Н=∆Н2-∆Н1 | 6.Скорость химической реакции. Закон действия масс (кинетический).
Скорость химической реакции – измерение концентрации исходного или образовавшегося в реакции вещества в единицу времени.
Различают среднюю v (черта сверху) и мгновенную v скорость хим реакции.
Средняя скорость хим реакции v (черта сверху) равна отношению изменении концентрации исходного вещества ∆С от значения С1 в момент времени t1 до значения С2 в момент времени t2 к промежутку времени ∆t, за которое это изменение произошло. v (черта сверху) = - ∆С/∆t. Мгновенная скорость химической реакции выражается в виде производной концентрации исходного реагирующего вещества по времени. v = - dС/dt. Скорость реакций зависит от природы реагирующих веществ и от условий, в которых она протекает, так же от концентрации, температура, наличие катализатора .Зависимость скорости химической реакции от концентрации реагирующих веществ выражает закон действия масс, являющийся основным законом химической кинетики..Скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ. Для гомогенной реакции:А+В 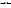 С+D Математическое выражение закона: v = k*[А]*[В] где [А] и [В]– концентрации реагирующих вещ А и В, k – коэффициент пропорциональности. Коэффициент пропорциональности k – константа скорости химической реакции. Константа скорости реакции k равна скорости химической реакции v при единичных концентрациях реагирующих веществ [А]=[В]=1. v=k, при [А]=[В]=1 Константа не зависит от концентрации реагирующих веществ и времени протекании реакции, но зависит от температуры (имеются табличные значения). Математическое выражение закона химической кинетики или основной постулат химической кинетики: v = k* [А]а * [В]b
Показатели степени (а и b) называются порядком реакции по веществу, а сумма (а + b) – общий порядок реакции.. Порядок реакции – один из признаков, по которому классифицируют реакции в хим кинетике.
Молекулярность реакции – ещё один кинетический признак, определяет число молекул, взаимодействующих друг с другом в элементарном акте химической реакции. С+D Математическое выражение закона: v = k*[А]*[В] где [А] и [В]– концентрации реагирующих вещ А и В, k – коэффициент пропорциональности. Коэффициент пропорциональности k – константа скорости химической реакции. Константа скорости реакции k равна скорости химической реакции v при единичных концентрациях реагирующих веществ [А]=[В]=1. v=k, при [А]=[В]=1 Константа не зависит от концентрации реагирующих веществ и времени протекании реакции, но зависит от температуры (имеются табличные значения). Математическое выражение закона химической кинетики или основной постулат химической кинетики: v = k* [А]а * [В]b
Показатели степени (а и b) называются порядком реакции по веществу, а сумма (а + b) – общий порядок реакции.. Порядок реакции – один из признаков, по которому классифицируют реакции в хим кинетике.
Молекулярность реакции – ещё один кинетический признак, определяет число молекул, взаимодействующих друг с другом в элементарном акте химической реакции.
|
6.Скорость химической реакции. Закон действия масс (кинетический).
Скорость химической реакции – измерение концентрации исходного или образовавшегося в реакции вещества в единицу времени.
Различают среднюю v (черта сверху) и мгновенную v скорость хим реакции. Средняя скорость хим реакции v (черта сверху) равна отношению изменении концентрации исходного вещества ∆С от значения С1 в момент времени t1 до значения С2 в момент времени t2 к промежутку времени ∆t, за которое это изменение произошло. v (черта сверху) = - ∆С/∆t Мгновенная скорость химической реакции выражается в виде производной концентрации исходного реагирующего вещества по времени. v = - dС/dt Скорость реакций зависит от природы реагирующих веществ и от условий, в которых она протекает, так же от концентрации, температура, наличие катализатора Зависимость скорости химической реакции от концентрации реагирующих веществ выражает закон действия масс, являющийся основным законом химической кинетики. Скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ. Для гомогенной реакции: А+В 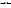 С+D Математическое выражение закона: v = k*[А]*[В] где [А] и [В]– концентрации реагирующих вещ А и В, k – коэффициент пропорциональности. Коэффициент пропорциональности k – константа скорости химической реакции. Константа скорости реакции k равна скорости химической реакции v при единичных концентрациях реагирующих веществ [А]=[В]=1. v=k, при [А]=[В]=1. Константа не зависит от концентрации реагирующих веществ и времени протекании реакции, но зависит от температуры (имеются табличные значения). Математическое выражение закона химической кинетики или основной постулат химической кинетики: v = k* [А]а * [В]b Показатели степени (а и b) называются порядком реакции по веществу, а сумма (а + b) – общий порядок реакции. Порядок реакции – один из признаков, по которому классифицируют реакции в хим кинетике. Молекулярность реакции – ещё один кинетический признак, определяет число молекул, взаимодействующих друг с другом в элементарном акте химической реакции. С+D Математическое выражение закона: v = k*[А]*[В] где [А] и [В]– концентрации реагирующих вещ А и В, k – коэффициент пропорциональности. Коэффициент пропорциональности k – константа скорости химической реакции. Константа скорости реакции k равна скорости химической реакции v при единичных концентрациях реагирующих веществ [А]=[В]=1. v=k, при [А]=[В]=1. Константа не зависит от концентрации реагирующих веществ и времени протекании реакции, но зависит от температуры (имеются табличные значения). Математическое выражение закона химической кинетики или основной постулат химической кинетики: v = k* [А]а * [В]b Показатели степени (а и b) называются порядком реакции по веществу, а сумма (а + b) – общий порядок реакции. Порядок реакции – один из признаков, по которому классифицируют реакции в хим кинетике. Молекулярность реакции – ещё один кинетический признак, определяет число молекул, взаимодействующих друг с другом в элементарном акте химической реакции.
| 8) Явление катализа. Катализаторы, принцип действия. Теория переходного состояния и образования активированных комплексов. Биокатализаторы. Катализ - процесс ускорения реакции с помощью катализаторов. Катализаторы - вещества, которые увеличивают скорость реакции, но сами при этом не изменяются. Катализаторами в растворах служат кислоты (катион Н+), основания (анион ОН-), ионы металлов (М+, MeJ), а также вещества, способствующие образованию свободных радикалов. Механизм кислотно-основного (ионного) катализа в растворах заключается в том, что идет обмен протонами между катализатором и реагирующими веществами, сопровождающийся внутримолекулярными превращениями. По агрегатному состоянию, в котором находятся катализатор и реагирующие вещества, различают гомогенный и гетерогенный катализ. При гомогенном катализатор и реагирующие вещества находятся в одной фазе, например, это может быть газовая смесь или раствор. При гетерогенном катализе катализатор и реагирующие вещества находятся в разных фазах. Катализаторы могут образовывать промежуточные продукты с реагентами, а по окончании всех стадий реакции такие катализаторы полностью возвращаются в исходную форму. Так в гомогенной реакции А+В->АВ могут протекать следующие стадии с участием катализатора К : 1) А+К->АК; 2) АК+В->АВ+К. Возможна и другая схема процесса катализа, когда осуществляется сильное взаимодействие катализаторв с активированными комплексом и слабое с исходными реагентами и продуктами реакции. Такое взаимодействие катализатора приводит к снижению энергии активации и к увеличению скорости реакции. При катализе положение химического равновесия не смещается, а только ускоряется достижение равновесного состояния. Суть теории переходного состояния (активированного комплекса): 1) частицы реагентов при взаимодействии теряют свою кинетическую энергию, которая превращается в потенциальную, и для того чтобы реакция свершилась, необходимо преодолеть некий барьер потенциальной энергии; 2) разница между потенциальной энергией частиц и упомянутым энергетическим барьером и есть энергия активации; 3) переходное состояние находится в равновесии с реагентами; 4) в тех реакциях, где энергия активации существенно ниже энергии разрыва химических связей, процессы образования новых связей и разрушения старых связей могут полностью или частично совпадать по времени. Биокатализаторы-ферменты. По химической природе ферменты являются белками. Им присущи два фундаментальных свойства: специфичность катализа и способность ускорять реакцию. В организме имеется значительно число различных ферментов, которые катализируют превращение определнных субстратов или единственного вещества ( пепсин катализирует расщепление пептидов в желудке, амилазы-гидролиз крахмала) | 9) Химическое равновесие с точки зрения термодинамики. Константа равновесия.
Химическое равновесие устанавливается только в обратимых реакциях.
Химическое равновесие устанавливается самопроизвольно, поэтому с позиции термодинамики при равновесии изменение энергии Гиббса равно нулю, ΔG=0, если реакция протекает при постоянном давлении или изменение энергии Гельмгольца равно нулю, ΔА=0, при протекании реакции в условиях постоянного объема системы. С точки зрения термодинамики состояние равновесия – это предел убыли энергии Гиббса.
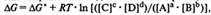 Величина К, равная отношению констант скоростей прямой к1и обратной к2 реакций, называется константой равновесия химической реакции: К= к1/к2
Она не зависит от начальных концентраций исходных веществ, определяется природой реагирующих веществ и температурой. Константа равновесия(Kp) является функцией изменения стандартной энергии Гиббса в реакции
lnKp= -ΔG°/(RT) Температурная зависимость константы равновесия d (lnKp)/dT связана со стандартной энтальпией ΔН° соотношением: d (lnKp)/dT= ΔН° (RT²) формула называется изобарой Вант-Гоффа.
Величина К, равная отношению констант скоростей прямой к1и обратной к2 реакций, называется константой равновесия химической реакции: К= к1/к2
Она не зависит от начальных концентраций исходных веществ, определяется природой реагирующих веществ и температурой. Константа равновесия(Kp) является функцией изменения стандартной энергии Гиббса в реакции
lnKp= -ΔG°/(RT) Температурная зависимость константы равновесия d (lnKp)/dT связана со стандартной энтальпией ΔН° соотношением: d (lnKp)/dT= ΔН° (RT²) формула называется изобарой Вант-Гоффа.
|
| 10) Смещение химического равновесия. Принцип Ле Шателье. Если на химическую систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие смещается в направлении, уменьшающем оказанное воздействие. Согласно принципу Ле Шателье: При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении темп- в направлении экзотермической реакции. Повышение давления сдвигает равновесие в сторону образования веществ, обладающих меньшим объемом.В гомогенной системе при увеличении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции, а при увеличении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ. Данный принцип применяется для анализа разнообразных процессов, в том числе биохимических. | 11)Агрегатные состояния. Растворы: понятие, теория. Растворы насыщенные, ненасыщенные и пересыщенные. Состояние одного и того же вещества, переходы между которыми сопровождаются скачкообразными изменениями объема и физических свойств вещества, называются агрегатными. Вещества могут существовать в твердом, жидком и газообразном состоянии. Переходы вещества из одного состояния в другое обусловлены изменением характера теплового движения частиц и их взаимодействия. Газом называют состояние вещества, из которого без понижения температуры не может быть получено твердое или жидкое состояния. Переход вещества из жидкого состояния в газообразное называется парообразованием. Пар можно получить также сублимацией твердого вещества. Обратные процессы перехода пара в жидкое и твердое состояние называется конденсацией. Переход твердого вещества в жидкое называется плавлением. Обратный процесс –кристаллизацией. Температура, при которой существуют три фазы называется тройной точкой.Растворами называются многокомпонентные гомогенные системы, состоящие из растворителя, растворенного вещества и продуктов их взаимодействия. Растворы могут быть твердыми, жидкими и газовыми. Наибольший интерес в ветеринарной практике представляют жидкие, преимущественно водные растворы. Существует физичеко-химическая теория растворов. С физической точки зрения процесс растворения заключается в диффузии растворенного вещества в растворителе. Чтобы вещество могло раствориться, должна быть разрушена его структура, а затем образующиеся ионы, атомы или молекулы распределяются между молекулами растворителя. Менделеев же доказал химическую природу процесса растворения, что подтверждают 3 признака химической реакции: тепловые эффекты, изменение объема и изменение окраски системы. При образовании раствора разрушается структура как растворителя, так и растворимого вещества. По содержанию растворенного вещества растворы разделяют на насыщенные, ненасыщенные и пересыщенные. Насыщенным называется раствор, находящийся в динамическом равновесии с избытком растворяемого твердого вещества. Суть образования насыщенного раствора заключается в достижении равновесия между раствором и осадком, которое с кинетических позиций характеризуется равенством скорости процесса растворения V1, т.е. перехода вещества в раствор и скорости кристаллизации V2. Когда эти скорости выравниваются, устанавливается равновесие > образуется насыщенный раствор. С термодинамических позиций равенству скоростей V1=V2 соответствует равенство нулю свободной энергии растворения вещества. Из биологических жидкостей примером раствора является моча. ΔG=0 Ненасыщенным называется раствор, содержание растворенного вещества в котором ниже растворимости этого вещества при данных условиях. Ненасыщенные растворы стабильнее насыщенных, могут иметь различные концентрации, меньшие, чем растворимость ΔG<0 Пересыщенным называется раствор, в котором концентрация растворенного вещества выше, чем концентрация данного вещества в насыщенном растворе при тех же условиях. Перенасыщение достигается следующим образом: растворяют вещество полностью, получая ненасыщенный раствор при повышенной температуре. Затем раствор медленно охлаждают. Возникновение п.р. в организме животного может иметь неприятные последствия. ΔG >0 | 12) Способы выражения концентрации растворов. Концентрация - основная характеристика раствора. Она характеризует количественный состав раствора. Концентрацией называет отношение количества растворенного вещества или его массы к объему раствора. Ее выражают в моль/л- молярная концентрация или г/л- массовая концентрация. Кроме того, состава раствора выражают через безразмерные относительные величины - доли. Массовая доля растворенного вещества ω- отношение массы растворенного вещества m к массе раствора m(p) : ω=m/m(p) Массовый процент растворенного вещества С- массовая доля, выраженная в процентах- показывает, сколько грамм вещества содержится в 100 г раствора m(p) : С=( m/m(p))*100, % Мольная доля N – отношение количества вещества, т.е. числа молей растворенного вещества n2 к суммарному количеству растворенного вещества и растворителя n1 : Молярная доля раст вещ-ва : N2=n2/(n1+n2) Молярная доля растворителя : N1=n1/(n1+n2) Число молей вещества n находится делением массы вещества m на его молярную массу М : n=m/M(моль) Молярная концентрация Сm показывает, сколько молей растворенного вещ-ва содержится в 1 кг раст-ля : C(m)=m/m'= m/(M* m') (моль/кг), где m'- масса растворителя в кг. Нормальная концентрация Сн показывает, сколько эквивалентных масс растворенного вещества (m/Э) содержится в 1 л растора : Сн=m/(Э*Vp) (моль/л), где Э- эквивалентная масса раст вещ-ва ( Э= М/(чсН) или Э= М/(чсОН) Обычно вместо молярной и нормальной конц записывают молярность и нормальность раствора. Молярность- это безразмерная величина, численно равная молярной конц. Обозначается символом М. Нормальность- это безразмерная величина, численно равная нормальной концентрации. Обозначается символом Н. В аналитической практике определение содержания вещества в растворе используют такую хар-ку как титр. Титр раствора Т показывает массу растворенного вещества в одном миллилитре раствора Т=m/Vp (г/мл). Титр раствора связана с нормальной концентрацией соотношением Т=Э*Сн/1000 В веет практике приходится иметь дело с широким интервалом конц веществ в растворах. Для выражения очень малых содержания раст вещ-ва используются следующие дольные ед-цы: мили( м 10 в -3), микро( мк 10 в -6), нано (н 10 в -9), пико( п 10 в -12) |
| 13) Осмос. Закон Вант-Гоффа. Роль осмоса в биологических явлениях. Осмос - процесс односторонней диффузии растворителя в раствор. (Диффузия- самопроизвольный процесс переноса вещества.) Результатом осмоса является выравнивание концентрации раст вещ-ва. Идеальная полупроницаемая мембрана пропускает молекулы воды и не пропускает молекулы растворенного вещества. Из-за того, что более концентрированный раствор содержит меньшую концентрацию молекул растворителя, в него путем ДИФФУЗИИ просачивается растворитель из менее концентрированного раствора и разбавляет его до тех пор, пока концентрация не станет равной по обе стороны мембраны. Осмос является важным клеточным процессом.Закон Вант-Гоффа звучит так: осмотическое давление разбавленного раствора равно такому давлению, которое оказывало бы растворенного вещество при той же температуре, находясь в газообразном состоянии и занимая тот же объем, что и раствор. ( Осмотическое давление- противодавление, через полупроницаемую перегородку в раствор) Уравнение вант-гоффа выглядит так: Р осм = См*R*T , где См-конц неэлетролита, Т-темп, R- газовая постоянная (8,31 дж/(моль*К)) Явление осмоса широко распространено в живой природе. Стенки раст клеток и клеток живых организмом представляют собой полупроницаемые мембраны, через которые свободно проходят молекулы волы и почти полностью задерживаются вещ-ва, растворенные в клеточном соке. Поэтому осмос является причиной плазмолиза( сжатия) клеток и тургора- напряженного состояния клеток, тканей и органов вследствие давления содержимого клеток на их эластичные оболочки и обратного давление оболочек на содержимое | |||
14) Давление пара растворителя над раствором. Закон Рауля.
Если стакан с водой закрыть крышкой, то над поверхностью воды образуется насыщенный пар. Его давление - это давление насыщенного пара над чистым растворителем Р0.На поверхности растворов молекул воды меньше, чем на поверхности чистого растворителя, и, следовательно, меньшее их количество будет вылетать в единицу времени. В состояние равновесия (испарение и обратный процесс конденсации пара) установится давление насыщенного пара растворителя над раствором Р. Французский ученый Ф. Рауль в 1883 году экспериментально установил, что при постоянной температуре относительное понижение давления насыщенного пара растворителя над раствором равно полярной доле растворенного вещества N: (P0-P)/P0= N. Это соотношение выражает закон Рауля. Растворы, для которых выполнятся закон Рауля, называются идеальными.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|