
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ТИПОВЫЕ ЗАДАЧИ.
ТИПОВЫЕ ЗАДАЧИ.
Задача №1: Определите заряд комплексного иона [ Cr+3 Cl3 (H2O) ]x.
x = 1·(+3) + 3·(-1) + 1·(0) = -2
Ответ: x = -2.
Задача №2: Назовите комплексное соединение Ca [ Pt+4 (NO2)4 (Cl)2 ].
Ответ: дихлоротетранитроплатинат (IV) кальция
Задача №3: Напишите формулу комплексного иона акватригидроксокупрат (II).
Ответ: [ Cu+2 (OH)3 (H2O) ]-
Задача №4: На осаждение ионов брома из раствора комплексной соли [Cr+3(NH3)6 ]Br3 израсходовано 0,5 дм3 раствора AgNO3 с молярной концентрацией вещества в растворе С(AgNO3) = 0,2 моль·дм-3. Сколько граммов комплексной соли содержалось в растворе?
Дано: Решение:
 Vр-ра = 0,5 дм3 По закону эквивалентов:
Vр-ра = 0,5 дм3 По закону эквивалентов:
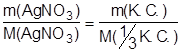 |
 С(AgNO3) = 0,2 моль·дм-3 n(AgNO3) = n(1/3 [Cr+3 (NH3)6 ] Br3)
С(AgNO3) = 0,2 моль·дм-3 n(AgNO3) = n(1/3 [Cr+3 (NH3)6 ] Br3)
m([Cr+3 (NH3)6 ] Br3) - ? M(AgNO3) = 170 г·моль-1
М(1/3 [Cr+3 (NH3)6 ] Br3) = 397 / 3 = 132,3 г·моль-1
m(AgNO3) = C(AgNO3) · M(AgNO3) · Vр-ра
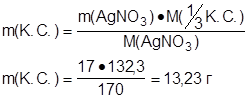 |
m(AgNO3) = 0,2 · 170 · 0,5 = 17 г
Ответ: m([Cr+3 (NH3)6 ] Br3) = 13,23 г.
Задача №5: Вычислить DG0 процесса:
[ Co(SCN)4]2- « Co2+ + 4 SCN-,
если Кнест = 5,5 · 10-3 при 250С.
Дано: Решение:
 Кнест = 5,5 · 10-3 По уравнению изотермы:
Кнест = 5,5 · 10-3 По уравнению изотермы:
Т = 298 К DG0 = - R · T · ln Kнест
R = 8,314 Дж·моль-1·К-1 DG0 = -8,314 · 298 · ln 5,5·10-3 = 12890,8 Дж·моль-1»
 » 12,89 кДж·моль-1
» 12,89 кДж·моль-1
DG0 - ?
Ответ: DG0 = 12,89 кДж·моль-1.
IV. Решить задачи:
1. Определить заряд комплексного иона и назвать соединение:
[ Ti+4 (NO3)2 (H2O)4 ]x
2. Определить степень окисления комплексообразователя и назвать соединение: Na2 [ Cox (Cl)5 (NH3) ]
3. Константа нестойкости иона [Zn(OH)4]2- при 250С равна 7,08·10-16. Вычислить DG0 процесса вторичной диссоциации комплексного иона.
Ответ: DG0 = 86,43 кДж·моль-1
4. Какой объем раствора AgNO3 с молярной концентрацией эквивалента вещества в растворе 0,2 моль·дм-3 потребуется, чтобы при взаимодействии его с раствором калия гексацианоферрат (III) образовалось 5,36 г осадка комплексной соли?
Ответ: Vр-ра = 150 см3.
ЛИТЕРАТУРА:
1. Ершов Ю.А., Попков В.А., Берлянд А.С. и др. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для мед. спец. вузов. - М.: Высшая школа, 2003. – С. 191 - 203.
2. Ершов Ю.А., Кононов А. М., Пузаков С.А. и др. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: Учеб. пособие для студентов мед. спец. вузов.-М.: Высшая школа, 2001. – С . 113 - 121.
3. Ленский А.С. Введение в бионеорганическую и биофизическую химию. – М., 1989. – С. 219 - 230.
4. Материалы лекций.
ЗАДАНИЕ №12
СТРОЕНИЕ АТОМА. ЗАКОНОМЕРНОСТИ ИЗМЕНЕНИЯ СВОЙСТВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ Д. И. МЕНДЕЛЕЕВА
I. Подготовиться к ответам на следующие вопросы:
1. Строение ядер атомов. Изотопы (радионуклиды).
2. Квантово - механическая модель атома. Квантовые числа (главное, орби-
тальное, магнитное, спиновое).
3. Строение электронных оболочек. Принцип Паули. Принцип наименьшей
энергии. Правило Гунда. Электронно-структурные формулы.
4. Периодические свойства атома. Электроотрицательность. Сродство к электрону. Энергия ионизации. S, p, d, f – блоки.
II. Ответить письменно на следующие вопросы:
1. Каковы значения квантовых чисел (n, l, m) для орбиталей, входящих в 3d – подуровень?
2. Сколько вакантных 3d – орбиталей имеют атомы в возбуждённом состоянии: а)Cl, б)V, в)Mn
3. Сколько значений магнитного квантового числа возможно для электронов
энергетического подуровня, орбитальное квантовое число которого l = 2?
l = 3?
4. Какая электронная формула соответствует иону а)Cd2+, б)I-, в)Fe3+
III. Подготовиться к тестированному контролю по теме «Строение атома и периодическая система Д. И. Менделеева».
IV. Разобрать ситуационную задачу:
Задача Радиусы ионов Na+ и Cu+ одинаковы (0,098 нм). Объяснить различие температур плавления хлорида натрия (801°С) и хлорида меди(I) (430°С).
РЕШЕНИЕ.
При одинаковых зарядах и размерах ионов Na+ и Cu+ ,ион Cu+ имеет 18 – электронную внешнюю оболочку и более сильно поляризует анион Cl- , чем ион Na+, обладающий электронной структурой благородного газа. Поэтому в хлориде меди(I) в результате поляризации с аниона на катион переносится более значительная часть электронного заряда, чем в хлориде натрия. Эффективные заряды ионов в кристалле CuCl становятся меньше, чем NaCl, а электростатическое взаимодействие между ними – более слабое. Этим объясняется более низкая температура плавления CuCl в сравнении с NaCl, кристаллическая решётка которого близка к чисто ионному типу.
ЛИТЕРАТУРА:
1. Ершов Ю.А., Попков В.А., Берлянд А.С. и др. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для мед. спец. вузов. - М.: Высшая школа, 2003. – С. 141 – 164.
2. Материалы лекций.
ЗАДАНИЕ №13
СТРОЕНИЕ МОЛЕКУЛ И ХИМИЧЕСКАЯ СВЯЗЬ
I. Подготовиться к ответам на следующие вопросы:
1. Химическая связь. Валентность.
2. Основные характеристики химической связи: длина связи, энергия связи,
валентный угол, полярность химической связи.
3. Метод валентных связей (ВС). Переменная валентность.
4. Ковалентная связь и механизмы её образования. Свойства ковалентной
связи (направленность, насыщаемость). Гибридизация атомных орбиталей.
5. Ионная связь, её свойства. Свойства ионных соединений.
6. Металлическая связь.
7. Водородная связь, её биологическая роль.
II. Ответить письменно на следующие вопросы:
1. Как изменяется прочность связи Н – Э в ряду H2O - H2S - H2Se - H2Te?
2. Объяснить строение молекулы BF3 и иона BF4 , используя метод ВС?
3. Сравнить способы образования ковалентных связей в молекулах NH3 и в
ионе NH4+. Возможно ли существование ионов CH5+ и NH52+. Ответ обосновать.
4. Обоснуйте, почему HF смешивается с водой во всех соотношениях, а HCl и NH3 характеризуются ограниченной растворимостью?
5. Объяснить механизм образования молекулы SiF4 и иона SiF62-. Может ли существовать ион СF62-? Ответ обосновать с позиций метода ВС.
ЛИТЕРАТУРА:
1. Ершов Ю.А., Попков В.А., Берлянд А.С. и др. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для мед. спец. вузов. - М.: Высшая школа, 2003. – С. 164 – 191.
2. Материалы лекций.
ЗАДАНИЕ №14
БИОГЕННЫЕ ЭЛЕМЕНТЫ
I. Подготовиться к ответам на следующие вопросы:
1. Биогеохимия. Биогенные элементы, их классификация, роль в организме. Органогены.
2. Факторы отбора биогенных элементов в процессе эволюции. Связь между положением химических элементов в периодической системе и их биологической ролью.
3. Топография микроэлементов. Формы нахождения биогенных элементов в организме. Биогеохимические провинции. Эндемические заболевания.
4. Токсическое действие нитратов на организм. Механизм формирования смога и его токсическое действие на организм.
5. Фотохимический смог, механизм его формирования, токсическое действие на организм.
II. Выполнить письменно задания:
1. Привести электронные и электронно-структурные формулы органогенов.
Указать их возможные степени окисления.
2. Дать характеристику катионам макроэлементов (Na+, K+, Ca2+) и примесных элементов (Ag+, Ba2+, Hg2+), а также анионам, находящимся в биологических жидкостях (PO43-, Cl-, OH-) с позиций электронной теории кислот и оснований Льюиса.
3. Обосновать возрастание токсичности химических элементов с увеличением их порядковых номеров.
4. Указать свойства микроэлементов, которые лежат в основе их влияния на процессы обмена веществ в организме.
ЛИТЕРАТУРА:
1. Ершов Ю.А., Попков В.А., Берлянд А.С. и др. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для мед. спец. вузов. - М.: Высшая школа, 2003. – С. 204 – 223.
2. Ершов Ю.А., Плетенева Т.В. Механизмы токсического действия неорганических соединений. – М.: Медицина, 1989. – С. 67 – 78, 207 – 215.
3. Материалы лекций.
ЗАДАНИЕ №15
S – ЭЛЕМЕНТЫ
I. Подготовиться к ответам на следующие вопросы:
1. Водород, общая характеристика, особенности положения в П.С.Э., реакции
с кислородом, галогенами, металлами, оксидами.
2. Водородпероксид, строение его молекулы, физические и химические
свойства. Понятие о перекисном окислении липидов и его роли в
повреждении клеточных мембран и нарушении функционирования клеток.
Применение водородпероксида в медицине.
3. S – элементы – металлы. Общая характеристика. Изменение свойств
элементов II А гр. в сравнении с I A гр., характеристики катионов. Ионы S –
элементов в водных растворах, энергия гидратации ионов.
4. Ионы щелочных и щелочно-земельных металлов как комплексо-образователи. Ионофоры и их роль в мембранном переносе калия и натрия. Ионы кальция и магния как комплексообразователи. Реакции с комплексонами (на примере натрия этилендиаминтетраацетата).
5. Биологическая роль металлов S – элементов (Li, Na, K, Ca, Mg) в минеральном балансе организма. Макро- и микро- S – элементы. Химические основы применения соединений указанных металлов и бария в медицине и фармации.
6. Соединения кальция в костной ткани, сходство ионов кальция и стронция, изоморфное замещение (проблема стронция - 90). Токсичность соединений бериллия.
II. Ответить письменно на следующие вопросы:
1. Как изменяется химическая активность S – элементов – металлов с увеличением их порядковых номеров?
2. Рассчитать массовую долю кальция в гидроксиапатите Ca10(PO4)6(OH)2, который является основным веществом костной и зубных тканей.
3. Объяснить химические основы применения карбоната кальция (CaCO3), как антацидного и тетрабората натрия (Na2B4O7 * 10H2O), как антисептического средства в медицинской практике.
III. Темы рефератов:
1. Вода как важнейшее соединение водорода, её физические и химические
свойства. Аквакомплексы и кристаллогидраты. Дистиллированная и апирогенная вода, их получение и применение в фармации. Природные и минеральные воды.
2. Характеристика и реакционная способность соединений водорода с азотом, углеродом и серой. Особенности поведения водорода в соединениях с сильно- и слабополярными связями. Ион водорода, ион оксония, ион аммония.
3. Взаимодействие металлов с кислородом, образование оксидов, пероксидов, гипероксидов (надпероксидов). Гидроксиды щелочных и щелочно-земельных металлов; амфотерность гидроксида бериллия. Гидриды щелочных и щелочно-земельных металлов и их восстановительные свойства.
4. Взаимодействие щелочных и щелочно-земельных металлов с водой и кислотами; соли щелочных и щелочно-земельных металлов: сульфаты, галогениды, карбонаты, фосфаты.
5. Жёсткость воды, единицы измерения, пределы, влияние на живые организмы и протекание реакций в водных растворах, методы устранения жёсткости.
ЛИТЕРАТУРА:
1. Ершов Ю.А., Попков В.А., Берлянд А.С. и др. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для мед. спец. вузов. - М.: Высшая школа, 2003. – С. 204 – 223.
2. Ершов Ю.А., Плетенева Т.В. Механизмы токсического действия неорганических соединений. – М.: Медицина, 1989. – С. 67 – 78, 207 – 215.
3. Материалы лекций.
ЗАДАНИЕ №16
ОБЩАЯ ХАРАКТЕРИСТИКА P – ЭЛЕМЕНТОВ.
I. Подготовиться к ответам на следующие вопросы:
1. Общая характеристика р – элементов.
2. Общая характеристика р – элементов IIIА группы. Биологическая роль.
3. Соединения бора и алюминия. Биологическая роль.
4. Галлий, индий, таллий. Их соединения, содержание в организме. Биологическая роль.
II. Подготовиться к лабораторной работе на тему: «Свойства р - элементов».
III. Темы рефератов:
1. Соединения селена и теллура. Биологическое значение.
2. Кислородсодержащие соединения азота, их биологическое значение.
3. Сера, её соединения. Биологическое значение.
ЛИТЕРАТУРА:
1. Ершов Ю.А., Попков В.А., Берлянд А.С. и др. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для мед. спец. вузов. - М.: Высшая школа, 2003. – С. 305 – 383.
2. Материалы лекций.
ЗАДАНИЕ №17
P – ЭЛЕМЕНТЫ.
I. Подготовиться к ответам на следующие вопросы:
1. Общая характеристика р – элементов 6А группы. Халькогены. Химические
свойства оксидов. Биологическая роль
2. Характеристика р – элементов 7А группы. Гидрогалогениды. Биологическое
значение.
3. Кислородсодержащие кислоты хлора (HClO, HClO2, HClO3, HClO4) и их соли.
Значение этих соединений в биологии и медицине.
4. Характеристика элементов 5А группы. Фосфор, его соединения. Содержа-
ние в организме, фосфорный обмен.
ЛИТЕРАТУРА:
1. Ершов Ю.А., Попков В.А., Берлянд А.С. и др. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для мед. спец. вузов. - М.: Высшая школа, 2003. – С. 305 – 383.
2. Материалы лекций.
ЗАДАНИЕ №18
ОБЩАЯ ХАРАКТЕРИСТИКА D – ЭЛЕМЕНТОВ. D – ЭЛЕМЕНТЫ I Б – II Б ГРУПП
I. Подготовиться к ответам на следующие вопросы:
1. Общая характеристика d – элементов – переменные степени окисления, валентности, способность к комплексообразованию.
2. Биологическая роль d – элементов.
3. d – элементы I - Б группы. Общая характеристика, биологическая роль
меди, серебра, золота.
4. d – элементы II - Б группы. Общая характеристика, биологическая роль
цинка, кадмия, ртути.
II. Подготовиться к лабораторной работе «d – элементы и свойства их соединений».
II. Ответить письменно на следующие вопросы:
1. Написать электронные формулы элементов – «металлов жизни» - Zn, Cu.
2. Какую реакцию среды имеют водные растворы нитрата серебра и нитрата меди (II)? Ответ подтвердить ионными уравнениями реакций.
III. Темы рефератов:
1. Соединения меди, серебра, золота. Их кислотно-основные и окислительно
-восстановительные характеристики. Способность к комплексообразова-нию. Применение соединений в медицине.
2. Биологическая роль d – элементов II - Б группы. Их растворимые соединения. Применение соединений в медицине.
ЛИТЕРАТУРА:
1. Ершов Ю.А., Попков В.А., Берлянд А.С. и др. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для мед. спец. вузов. - М.: Высшая школа, 2003. – С. 254 – 262; С. 284 – 299.
2. Материалы лекций.
ЗАДАНИЕ №19
D – ЭЛЕМЕНТЫ VI Б – VIII Б ГРУПП
I. Подготовиться к ответам на следующие вопросы:
1. d – элементы VI - Б группы. Общая характеристика, биологическая роль
хрома, молибдена, вольфрама.
2. d – элементы VII - Б группы. Общая характеристика, биологическая роль
марганца, технеция, рения.
3. d – элементы VIII - Б группы. Семейство железа. Общая характеристика,
биологическая роль железа и кобальта.
4. d – элементы VIII - Б группы. Семейство платины. Общая характеристика.
II. Ответить письменно на следующие вопросы:
1. Написать электронные формулы элементов – «металлов жизни» -Cr,Mo,Fe.
2. Закончить реакцию, уравнять методом электронного баланса:
H2C2O4+K2Cr2O7+H2SO4→ . . .
III. Темы рефератов:
1. Химические свойства кислородных соединений марганца. Биологическая
роль соединений марганца. Их применение в медицине.
2. Химические свойства соединений хрома. Биологическая роль соединений
хрома. Их применение в медицине.
3. Соединения железа (II) и железа (III), их реакционная способность. Способность к комплексообразованию. Гемоглобин и железосодержащие ферменты.
ЛИТЕРАТУРА:
1. Ершов Ю.А., Попков В.А., Берлянд А.С. и др. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для мед. спец. вузов. - М.: Высшая школа, 2003. – С. 266 – 283; С. 299 – 302.
2. Материалы лекций.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|