
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Ответ: m(Na2SO4) = 7,1 г.
Ответ: m(Na2SO4) = 7,1 г.
Задача №4: 25%-ный раствор гептагидрата магний сульфата MgSO4·7H2O применяют внутривенно для снижения давления крови. Определите молярную концентрацию эквивалента этого раствора, плотность раствора 1,15 г·см-3.
Дано: Решение:
 w( MgSO4·7H2O)=25% 1. Определить молярную массу эквивалента гептагидрата
w( MgSO4·7H2O)=25% 1. Определить молярную массу эквивалента гептагидрата

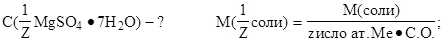 |
rp(MgSO4·7H2O)= 1,15 г·см-3 магний сульфата:
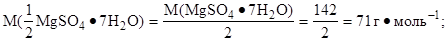 |
2. Найти массу 1 дм3 раствора:
mp = Vp · r = 1000 · 1,15 = 1150 (г);
3. Найти массу соли в 1 дм3 раствора:
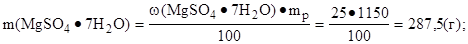 |
4. Определить молярную концентрацию эквивалента соли:
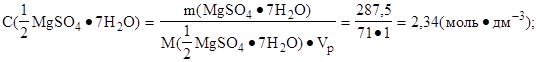 |
Ответ: C(1/2 MgSO4·7H2O) = 2,34 моль·дм-3.
Задача №5: Определите титр раствора натрий гидроксида, если на титрование 5 см3 его раствора израсходовано 5,4 см3 раствора H2SO4 с молярной концентрацией эквивалента С(1/2 H2SO4)=0,5 моль·дм-3.
Дано: Решение:
 V(NaOH) = 5 см3 1.Определить молярную концентрацию эквивалента V(H2SO4) = 5,4 см3 раствора натрий гидроксида:
V(NaOH) = 5 см3 1.Определить молярную концентрацию эквивалента V(H2SO4) = 5,4 см3 раствора натрий гидроксида:
C(1/2 H2SO4) = 0,5 моль·дм-3
 |
C(NaOH)·V(NaOH) = C(1/2 H2SO4)·V(H2SO4);
t(NaOH) - ?
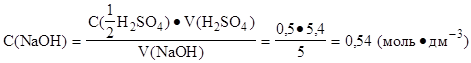 |
2. Определить титр раствора натрий гидроксида:
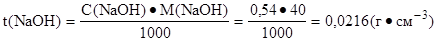 |
Ответ: t(NaOH) = 0,0216 г·см-3.
ЛИТЕРАТУРА:
1. Методическая разработка кафедры «Введение в титриметрический анализ», Омск.
2. Ершов Ю.А., Кононов А. М., Пузаков С.А. и др. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: Учебное пособие для студентов мед. спец. вузов.- М.: Высшая школа, 2001. – С . 19 – 41.
ЗАДАНИЕ №3
МЕТОД НЕЙТРАЛИЗАЦИИ. ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ НАТРИЙ ГИДРОКСИДА В РАСТВОРЕ
I. Подготовить ответы к следующим вопросам:
1. Сущность метода нейтрализации. Ацидиметрия. Алкалиметрия. Применение метода в клинических и санитарно-гигиенических анализах.
2. Индикаторы метода нейтрализации. Ионная теория индикаторов Оствальда.
3. Зона переходной окраски индикатора. Показатель титрования, его значение.
II. РЕШИТЬ ЗАДАЧИ:
1. Определить молярную концентрацию натрий гидроксида в растворе, если массовая доля его в растворе составляет 26%. ( r = 1,3 г·см-3).
Ответ: 8,45 моль·дм-3.
2. Рассчитать массовую долю (%) серной кислоты в растворе ( r = 1,12 г·см-3) с молярной концентрацией эквивалента серной кислоты С(1/2 Н2SO4) = 0,5 моль·дм-3.
Ответ: 2,18%
ЛИТЕРАТУРА:
1. Ершов Ю.А., Кононов А. М., Пузаков С.А. и др. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: Учеб. пособие для студентов мед. спец. вузов. – М.: Высшая школа, 2001. – С . 28 - 40.
2. Методическая разработка кафедры «Введение в титриметрический анализ».
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|